【Trends Mol Med】侵袭性淋巴瘤液体活检新进展:迈向风险调适治疗
2024-05-09 聊聊血液 聊聊血液 发表于上海
文章回顾了液体活检策略的新进展,重点关注 DLBCL 患者的循环核酸,并强调了其临床潜力,还为生物标志物指导的临床试验提供了建议,以支持风险调适治疗。
淋巴瘤液体活检
弥漫性大B细胞淋巴瘤 (DLBCL)具有显著的生物学和临床异质性,对风险分层和疾病监测提出挑战。风险分层的现有工具包括国际预后指数 (IPI)、组织分子分析和影像学,但在预测结局方面的准确性有限。侵袭性淋巴瘤的治疗正在快速发展,迫切需要在个体化治疗背景下识别有难治或复发性 (R/R) 疾病风险的患者。液体活检是一种用于肿瘤信号检测的微创方法,已进行探索旨在解决这些挑战。
《Trends in Molecular Medicine》近日发表综述,回顾了液体活检策略的新进展,重点关注 DLBCL 患者的循环核酸,并强调了其临床潜力,还为生物标志物指导的临床试验提供了建议,以支持风险调适(risk-adapted)治疗。

本文要点
液体活检为弥漫性大B细胞淋巴瘤患者的风险分层和疾病监测提供了有前景的生物标志物。
循环核酸(包括肿瘤和非肿瘤来源的信号)可全面了解肿瘤的遗传、表观遗传学和转录组学特征,并具有预测和预后价值。
液体活检生物标志物的临床效用必须通过前瞻性验证和随机对照试验来证实,这对于开发风险调适治疗策略至关重要。
DLBCL临床管理的挑战
DLBCL 是侵袭性淋巴瘤的最常见亚型,由于其生物学复杂性和异质性临床结局,在临床管理中提出了重大挑战。虽然大多数患者可通过R-CHOP或pola-R-CHP一线治疗治愈,但 R/R 患者预后较差,并且相当多的患者不适合挽救治疗。随着抗体偶联药物 (ADC)、双特异性抗体 (BiAb) 和嵌合抗原受体 T 细胞 (CAR-T) 疗法等靶向药物的出现,(R/R)DLBCL的治疗前景正在迅速发展。鉴于这种情况,尽早识别高危原发性 DLBCL 患者已成为当务之急,因为及时治疗一线治疗无效的患者可能会改善结局。此外,改善缓解评价和疾病监测尚存在改善空间,有助于及时识别复发患者。这两种情况都需要随机对照试验 (RCT) 来验证早期转换或重启治疗的优势。目前可用的DLBCL 患者风险分层的有效工具,包括IPI、组织活检样本的分子学分析以及18F-FDG PET-CT,以下简称PET-CT)影像学,对于治疗前风险分层及治疗期间和治疗后的疾病监测均不理想(BOX 1)。
BOX 1.DLBCL风险分层和疾病监测的现有工具
治疗前风险分层依赖于 IPI 和肿瘤分子学分析。荧光原位杂交 (FISH) 通过检测 MYC 加 BCL2 和/或 BCL6 基因重排鉴别高级别 B 细胞淋巴瘤 (HGBL),而基因表达谱和免疫组织化学确定起源细胞 (COO),并将 DLBCL 分为活化 B 细胞样 (ABC) 或生发中心 B 细胞样 (GCB) 亚型。然而,这些工具在准确识别结局较差的高危患者方面存在不足。使用 IPI 或 COO 对患者进行分层的临床试验显示,改善结局的效果有限。近期研究集中于在探索基于突变的分子学分类及基线 PET-CT 的定量放射学特征的预后价值。治疗期间缓解评估采用中期PET-CT(iPET-CT),具有>80%的高阴性预测值 (NPV);但其阳性预测值 (PPV) 为30-70%,限制了其指导治疗的能力。通过治疗结束时(EOT)PET-CT 扫描确定治疗后缓解评估。尽管PET-CT是金标准,但其使患者暴露于辐射,且有一定缺陷,因为部分 PET 阴性患者仍可能复发,而部分 PET 阳性患者从未进展,导致PPV次优 (约为45%),尽管 NPV 较高(> 80%)。目前对于疾病监测,临床随访是标准实践,因为常规影像学对改善临床结局的影响有限。
通过“液体活检”检测生物体液中的肿瘤信号有助于进行个体化治疗。液体活检可提供肿瘤负荷的近乎实时全景,从而使风险分层和可测量残留病灶 (MRD) 检测成为可能。DLBCL中基于血液的生物标志物的研究正在不断扩展,需要概述如何将这些生物标志物纳入 RCT 设计中,并为治疗不同分期DLBCL的临床决策提供信息。该综述讨论了 DLBCL 基于血液的生物标志物的最新进展,并强调了其潜在的临床实用性。文章讨论了不同类别的标志物、其检测方式、以及每个临床阶段需要的标志物。还为如何将这些生物标志物纳入未来的RCT提供了基本原理和建议,以制定风险调适治疗策略。
DLBCL中的肿瘤信号及液体活检标志物
肿瘤细胞的特征为存在驱动细胞增殖和抑制细胞死亡的遗传学和表观遗传学改变。除致癌突变外,肿瘤细胞还与支持其存活和生长的周围微环境和免疫系统相互作用。结合起来,来自恶性肿瘤细胞及其微环境的分泌信号可以通过抽血(最常见的液体活检形式)进行评估。与传统组织活检相比,液体活检具有多个优势,例如微创性、克服空间异质性的能力和纵向采样的能力。图 1A 显示了 DLBCL 患者的液体活检生物标志物;这些生物标志物大致分为循环肿瘤细胞 (CTC)、循环无细胞核酸(包括无细胞 DNA[cfDNA] 和RNA[cfRNA])、胞外囊泡 (EV) 和可溶性蛋白。图 1B 概述了 DLBCL 生物标志物分析物的肿瘤源性和非肿瘤源性信号。
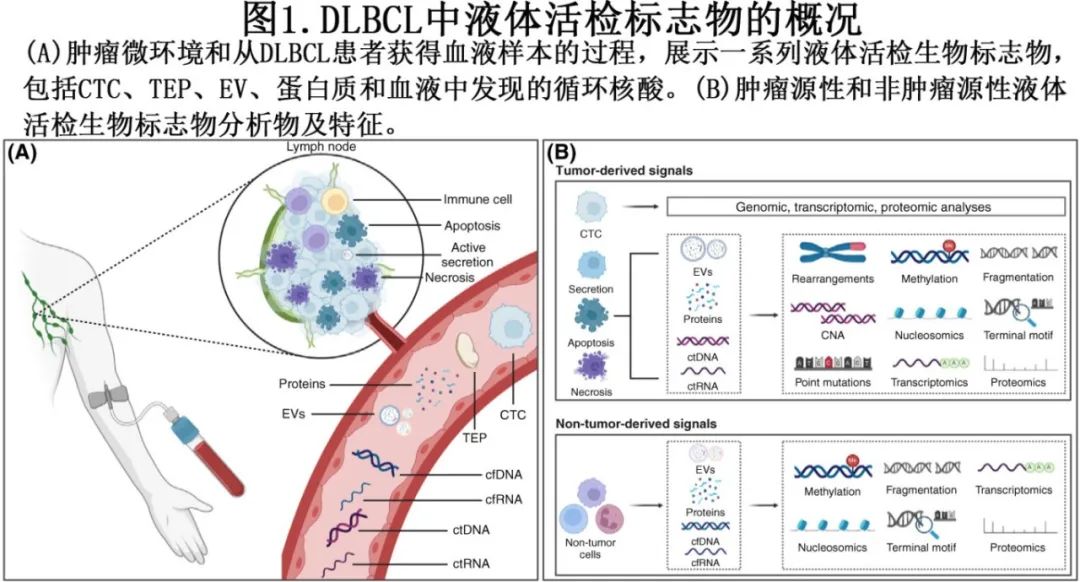
最具特异性的液体活检生物标志物是在 CTC 或肿瘤细胞释放的cfDNA(称为循环肿瘤DNA[ctDNA])中发现的突变。尽管 CTC 分析可以提供基因组、转录组和蛋白质组信息,但 DLBCL 患者很少呈现循环淋巴瘤细胞,从而限制了其生物标志物潜力。循环中的 ctDNA 是细胞通过凋亡和/或坏死及通过主动分泌导致细胞死亡的结果,导致患者的 ctDNA 水平高于健康人。最初的 ctDNA 研究使用基于(数字)PCR 的突变分析进行肿瘤检测和治疗指导。PCR因其相对较短的周转时间、操作简便、成本效益高、灵敏度高、检测限 (LOD) 约为10-4而脱颖而出,其主要局限性在于需要提前了解靶点及超多靶点检测能力有限。由于 DLBCL 具有遗传异质性,检测突变需要分析大量基因,使得基于 PCR 的方法具有挑战性。二代测序 (NGS) 方法包括免疫球蛋白高通量测序 (IgHTS)、靶向panel测序和全基因组测序 (WGS) ,其应用也越来越多。免疫球蛋白超敏反应可识别治疗前组织或血液中用于克隆性测定的免疫球蛋白序列,然后在整个治疗和监测过程中追踪这些患者特异性克隆。尽管理论上具有高灵敏度,LOD约为10-5,但其实际有效性受到每份血样中可用的 cfDNA 分子绝对量的限制,其数量约为20000个单倍体基因组当量 (hGE),从而限制了其总体灵敏度。此外,IgHTS需要组织样本来进行可靠克隆性测定,因为其检测基线血浆样本中克隆性的灵敏度通常太低。
靶向panel测序可分析单核苷酸变体 (SNV)、插入缺失、转座子和拷贝数畸变 (CNA),从而能够对肿瘤进行纵向负荷评估。CAPP-seq(通过深度测序进行癌症个性化分析,cancer personalized profiling by deep sequencing)侧重于基于已知复发性基因异常的基因panel,它利用独特的条形码策略和一种计算算法来纠正测序错误。最近开发了一种称为“分阶段变异体富集和检测测序”(phased variant enrichment and detection sequencing,phased-seq) 的技术,该技术可检测特定 cfDNA 链上邻近的至少两个 SNV 的存在(即“分阶段”变异体),进一步增加灵敏度并使 MRD 检测能够用于疾病监测。尽管靶向测序具有高灵敏度,LOD约为10-5–10-6,但由于其仅检测复发性突变,因此具有局限性;非突变 cfDNA 分子的数量优势导致进一步稀释可检测信号。此外,CAPP-seq和 PhasED-seq 都需要生殖系DNA(一般从外周血单核细胞[PBMC] 获得),以区分源于克隆性造血 (CHIP) 突变和真正来源于癌细胞的突变。由于需要广泛的测序深度和复杂的工作流,这些技术成本高昂。近年来,液体活检研究已经超越突变分析,扩展到肿瘤来源的非突变信号以及非肿瘤来源的信号,以最大限度地捕获信号。WGS利用广度而非深度,并提供了在单次测序运行中全面分析基因组、表观基因组和片段组学特征的可能性。WGS作为诊断试验成功应用的一个例子是无创产前检查 (NIPT),包括标准化的分析前处理和报告策略。但WGS 的局限性仍是其相对较低的灵敏度(LOD约为10-3),但多模分析(multimodal analyses)可以予以改善。除了突变分析,cfDNA的甲基化分析也已证明可早期检测癌症、预测治疗反应并去卷积(deconvolution)用于细胞起源确定。此外,全基因组片段化和核小体定位也正在成为有前景的生物标志物。
最近人们对循环 RNA(cfRNA) 作为生物标志物越来越感兴趣;这些转录组学信号可反映癌细胞的功能动力学及其与免疫系统的相互影响。cfRNA包括多个亚类,包括mRNA、microRNA(miRNA)、tRNA、长链非编码 RNA(lncRNA) 和环状RNA(circRNA),与健康个体相比,这些亚类在癌症患者中发生改变。一个关键区别在于,大多数活细胞释放的 RNA 为 cfRNA 或包裹在 EV 内。循环 cfRNA可以与蛋白质复合物相关,保护它们不被核糖核酸酶(RNase)降解。在各种 RNA 物种中,mRNA和 miRNA 已被广泛研究。作为在蛋白质翻译前的中间步骤,mRNA可反映(肿瘤)细胞的稳态,可以产生有价值的生物标志物潜力。miRNA在 B 细胞发育和淋巴瘤发生中起着举足轻重的作用,并且很容易被检测到,使其成为一个研究得很透彻的生物标记类别。这些小的非编码 RNA 可在转录后调节基因表达。肿瘤患者中 miRNA 的异常表达可为肿瘤和免疫系统之间复杂的相互作用提供接口。此外,研究 EV RNA 具有潜在的优势;原因在于囊泡可防止降解,由肿瘤细胞及其微环境主动释放,并在肿瘤发生、免疫调节和治疗耐药中发挥关键作用。此外,与肿瘤细胞相互作用的血小板可导致RNA 谱转化,产生所谓的肿瘤教育血小板 (tumor-educated platelets,TEP)。TEP主要作为早期癌症生物标志物的来源,但它们在淋巴瘤中的意义不如大多数实体瘤类型明确。血液循环中 cfRNA的丰度是一个关键优势,因为它可以仅用少量血浆就进行检测(通过 PCR 或测序)。PCR方法具有较高的灵敏度和经济性,但需要先了解靶点。而基于测序的技术允许 cfRNA 分析,从而促进新标志物的发现。但这些方法成本更高且需要进行复杂生物信息学分析。此外,cfRNA分析还面临着混乱,因为与它们固有的不稳定性相关的分析前变异。事实上,如果不受蛋白质、其他 RNA 和/或 EV 内包膜的保护,大多数 RNA 种类对核糖核酸酶极其敏感。在 EV RNA 分析中,EV 分离技术与单步分子排阻色谱法到差速离心法各不相同。尽管缺乏单一通用的分离金标准,但“细胞外囊泡研究的最少信息”(minimal information for studies of extracellular Vesicles,MISEV) 指南为 EV 表征提供了建议,以提高重现性。总之,有一系列分子学方法可用于识别循环核酸中的肿瘤相关信号,每种方法都有其自身的优势和局限性。生物标志物和检测技术的选择最终取决于临床需求。
接下来解析目前在 DLBCL 临床管理三个阶段的液体活检生物标志物工具和潜力。
DLBCL临床管理中的液体活检生物标志物
DLBCL 的临床管理分为三个阶段:治疗前、治疗中和治疗后。学者研究了治疗前和治疗期间基于血液的生物标志物风险分层,以及通过 MRD 评估缓解和预测复发。为了促进适应调适治疗策略,应评估生物标志物的性能(包括敏感性、特异性、阳性预测值[PPV]和阴性预测值[NPV])在预测临床结局(包括治疗结束[EOT]缓解和生存期(如无进展生存期 [PFS]、无事件生存期[EFS]和总生存期[OS])方面的能力。
治疗前风险分层
理想情况下,稳健的治疗前风险分层工具应识别一线治疗无效的高风险患者,因此需要高PPV。现有方法(如 IPI 及其变型)在预测2年 OS 结局不良方面存在不足,最高危 IPI 组2年OS率约为50%。国际代谢预后指数 (IMPI)考虑了代谢性肿瘤体积 (MTV)、年龄和分期,提高了预测不良结局的性能;但最高危组的2年 PFS 仍为约50%。细胞起源 (COO) 分类未产生令人满意的临床试验结果,导致对其临床实用性提出质疑。然而,最近的 POLARIX 研究数据表明,ABC亚型可能对 pola-R-CHP 更敏感,需要进一步前瞻性确认。以活检样本的遗传和微环境分析为指导的 II 期随机、开放标签GUIDANCE-01研究 (NCT04025593) ,证实了基于分子学诊断的调整治疗的疗效和临床效用,证明结合分子学诊断在临床试验环境中是可行的,并且可以改善临床结局。
研究人员探索了液体活检生物标志物用于治疗前风险分层的潜力(表1)。
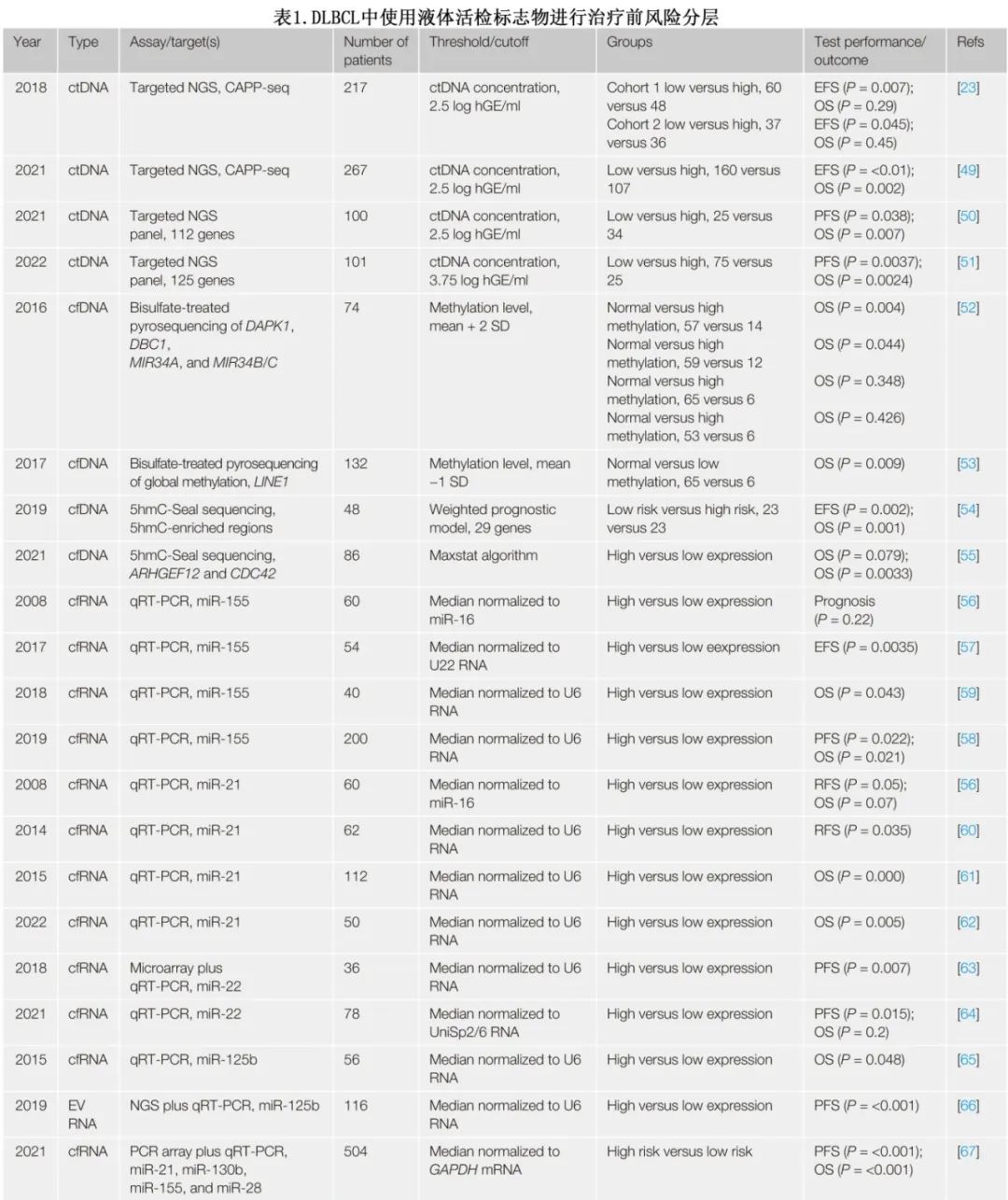
治疗前 ctDNA 浓度(通过分析肿瘤特异性突变估计)与疾病负荷参数相关联,包括IPI、MTV和诊断至治疗间隔 (DTI)。4项使用靶向panel测序的大型研究证明了治疗前 ctDNA 浓度的预后价值。但由于基线 ctDNA 浓度高的患者2年PFS/EFS >50%,因此指导治疗的风险分层性能有限。除突变分析外,4项研究评价了(整体)甲基化等表观遗传学改变的预后价值,并且均显示出中度风险分层性能。除 cfDNA 外,还研究了 cfRNA 的风险分层。本文重点关注至少两项研究中一致报告的生物标志物。四种miRNA,包括miR-155、miR-21、miR-22和miR-125b 已显示出风险分层的潜力;但关于血清 miR-21 的研究得出相互矛盾的结果。总之,使用循环核酸进行的治疗前风险分层对于指导治疗仍次优。虽然许多研究证实生物标志物阳性和阴性组之间的生存率存在统计学显著差异,但高危组通常仍表现出相对较高的长期生存率,反映了该方法的分层性能有限。
治疗期间反应监测和风险分层
治疗期间的风险分层可通过整合肿瘤对治疗的反应数据,提供优于治疗前风险分层的明显获益,实现对肿瘤负荷进行近乎实时的评价。尽管可以进行中期 PET-CT(iPET-CT) 以评价缓解,但 PPV 仅为中度,范围为40-60%;其局限性主要归因于FDG 的非特异性摄取,限制了其影响治疗选择的有效性。液体活检生物标志物可通过提供分子信息来弥补iPET-CT,从而实现同步疾病监测和风险分层。
广义上,使用液体活检进行治疗中缓解评估有两种方法:固定时间的生物标志物分析或分析其行为随时间的变化,如表2所示。
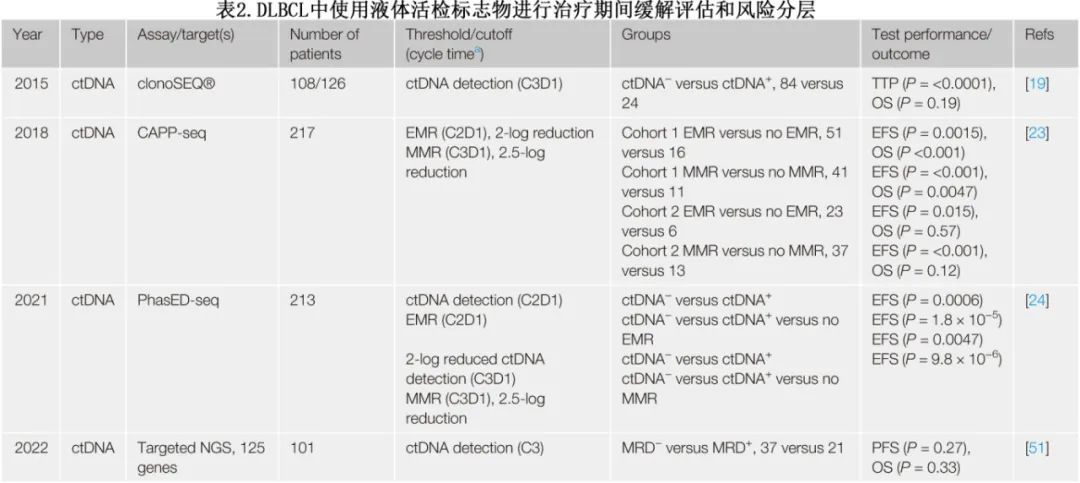
在一项回顾性研究中,126例患者中的108例在治疗两个周期后使用 IgHTS 测量ctDNA,可检测到 ctDNA 的患者进展时间 (TTP)劣于 ctDNA 无法检测的患者,但 OS 无显著差异。另一项研究应用靶向panel测序确定了101例患者中的58例在3个周期治疗后的 MRD 状态,结果MRD 状态与 PFS 或 OS 均无显著相关性。随着时间的推移,ctDNA的行为也可能提供一些信息,因为它捕获治疗开始后 ctDNA 浓度的变化。在一项具有里程碑意义的研究中,用 CAPP-seq 测量治疗前和治疗中的 ctDNA 浓度,其中早期分子学反应 (EMR) 和主要分子学反应 (MMR) 定义为1个和2个治疗周期后 ctDNA 浓度分别降低2个对数和2.5个对数;EMR和 MMR 与 EFS 和 OS 显著相关,且不受IPI 和 iPET-CT影响。基于分阶段变异检测的 PhasED-seq可提高分析灵敏度,并能够检测低于百万分之一的 ctDNA 水平,从而进一步增加了灵敏度。为了最大化风险分层性能,开发了包含治疗前和治疗中信息的基于贝叶斯方法的模型,称为“连续个体化风险指数”(continuous individualized risk index,CIRI)。该模型可通过输出2年 PFS率进行纵向风险评估,可能有助于临床采用。简而言之,治疗中风险分层(结合液体活检样本的纵向治疗反应信息)优于治疗前分析。接下来需要前瞻性验证这些技术,并确定干预性试验的可接受临界值。
EOT反应监测和治疗后疾病监测
MRD 检测是多种肿瘤的有效临床终点,对于及时进行治疗干预至关重要。MRD阳性淋巴瘤患者的早期干预可能改善结局,但必须在 RCT 中进行探索。尽管 EOT PET-CT 的 NPV 较高,但高达10-15%的原发性 DLBCL 患者在阴性后复发,因此需要更敏感的监测方法。FDG的非特异性摄取(通常由感染、治疗或其他因素引起的炎症引起)导致PPV仅有中度(约45%)。因此,患者经常需要额外的、沉重的诊断程序,例如活检用于确认 PET 阳性病灶。大多数国际指南不推荐用影像学进行常规监测,主要是因为常规扫描没有显示出改善临床结局,甚至可能增加重复辐射暴露导致的继发性肿瘤风险。大多数复发是在缓解后前2年内发生,而达到2年 PFS 的患者的预期寿命与性别和年龄匹配的一般人群相当。鉴于这些考虑,基于无辐射的血液MRD 检测为缓解评估和疾病监测提供了一种有吸引力的策略。
用于缓解评估和疾病监测的 MRD 检测的性能各不相同,如表3所示。

在一项回顾性研究中,在初次缓解后的107/126例患者中应用 IgHTS 进行治疗后疾病监测,显示高灵敏度(PPV为88.2%)和特异性(NPV为97.8%),临床复发前的中位前置时间为3.5个月。第一项评估clonoSEQ MRD检测用于PET 阴性完全缓解患者的前瞻性研究(NCT02633111)正在进行中,其中期分析证实clonoSEQ检测在91%的复发中检测到肿瘤特异性克隆型,但在复发时或复发前仅在56%的病例中检测到阳性,仅26%的病例的前置时间>3个月。期待其最终分析,该中期报告强调,clonoSEQ用于早期检测复发仅在前瞻性背景下获得了适量的前置时间。
靶向panel测序也可用于治疗后缓解评估和疾病监测。采用靶向panel测序作为 MRD 检测分析71份 EOT 血浆样本,并与 PET-CT 分析进行比较;EOT MRD检测可预测 PFS 和OS,优于EOT PET-CT。对于放射学缓解后的早期复发检测,亦可采用 MRD 检测。一项研究在11例患者的38份样本中比较了 IgHTS 和 CAPP-seq 作为 MRD 检测复发的性能,结果CAPP-seq在临床复发前检测到的患者是 IgHTS 的2倍,中位前置时间>2个月。治疗后 MRD 阳性也与 PFS 较差相关,但与 OS 无关。有研究在达到 EOT PET 阴性缓解的19例患者中比较了 CAPP-seq 和 PhasED-seq 的性能,其中5例出现疾病进展;PhasED-seq鉴定出5/5(100%) 的疾病进展患者,且优于CAPP-seq,后者仅鉴定出2/5的病例。在研究新药的5项前瞻性研究的93份 EOT 血液样本中进一步证实了 PhasED-seq 的性能,其中所有23例发生 PFS 的患者的 MRD 检测结果均为阳性。在相同的特异性条件下,PhasED-seq的灵敏度为100%,高于EOT PET-CT(50%),并且可以预测PFS。这些研究强调,ctDNA 检测具有超越 EOT PET-CT 局限性的潜力,如果通过前瞻性验证,可以将 MRD 确立为可信的临床终点和监测工具。
液体活检标志物纳入干预性临床试验
尽管预计R-CHOP 和 pola-R-CHP仍可作为多数新诊断 DLBCL 患者的标准一线治疗,但迅速识别对其反应不佳的高危患者至关重要。图2显示了 DLBCL 管理的现状,以及未来的生物标志物驱动的风险调适治疗策略。
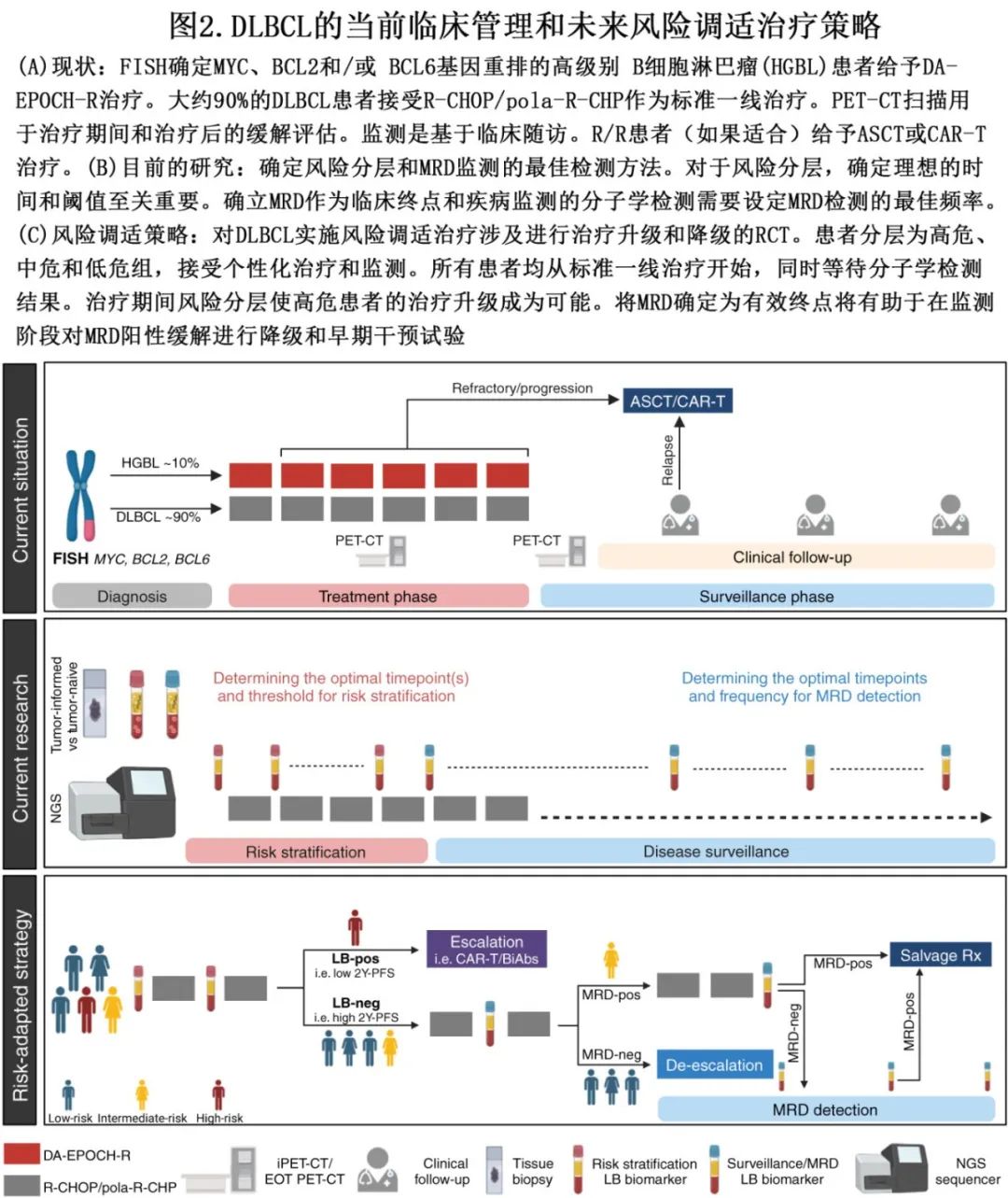
目前治疗强化仅限于约10%的高级别 B 细胞淋巴瘤 (HGBL) 患者,而一线治疗的治愈率约为75%,这一事实证实,需要在所有 DLBCL中探索早期准确风险分层的生物标志物。制定风险分层标准和就临床终点达成共识至关重要。例如,预测达到2年 PFS 的几率较低(例如<25%)可确定治疗升级的临床试验的高危患者,而治疗期间 MRD 阴性则预计达到2年 PFS 的几率较高(例如>75%),可确定参加治疗降级试验的患者。高 PPV的检测手段适用于治疗升级,而高 NPV的检测手段适用于治疗降级。理想情况下,应在下一个治疗周期前获得检查结果,而基于 NGS 的检测周转时间相对较长,可能会延迟治疗决策。目前,正在进行的 II 期开放标签试验 (NCT04980222) 采用一种策略,即所有患者均接受2个周期的一线治疗,基于液体活检测量基线与1个周期治疗后的 ctDNA 水平变化,从第3周期开始干预。另外,最近的一项研究探索了在肺癌中使用 Nanopore 测序进行床旁 cfDNA 分析的潜力,该策略获得结果的时间大幅减少。我们对液体活检如何影响 DLBCL 临床管理的认识正在迅速扩展。然而,在广泛的临床实施之前,必须解决多个挑战(参见突出问题)。
突出问题
多少比例的循环核酸来自肿瘤和非肿瘤细胞,治疗开始后该比值如何变化?
肿瘤源性和非肿瘤源性信号对生物标志物的预测和预后价值贡献有多大?使用分析多个信号而非关注单一类型信号的检测是否更可取?
确保准确和早期风险分层的最佳采血量和最佳采血时间点是什么?此外,获得初始缓解后,MRD检测的持续时间和频率应该是多少?
哪些检测性能指标对于早期风险分层很重要,哪些指标对于 MRD 检测至关重要?单次检测是否可以满足所有要求,或者是否需要就每个临床需求进行不同检测?
靶向panel测序提供了高灵敏度,但涉及增加成本和后勤复杂性,而 WGS 更具成本效益和标准化,但灵敏度较低。这些方法如何比较?
可以采用什么策略来评估治疗期间早期发现高危患者和随后的 MRD 检测(导致早期干预)是否可以改善临床结局?
如何解决靶向panel测序等复杂诊断检测的后勤和分析挑战,以确保其广泛和易于实现?
一旦前瞻性验证,生物标志物应该如何纳入临床试验,以证明其临床效用和成本效益?
在未来的 RCT 中,适当的临床终点和患者分层的阈值如何构成?
结论性意见和未来展望
尽管 R-CHOP/pola-R-CHP 可治愈多数原发性 DLBCL 患者,但 R/R 患者的预后仍较差。新药的快速开发强调了迫切需要用于临床试验的稳健生物标志物。液体活检可跟踪肿瘤随时间的推移,已成为风险分层和疾病监测的一种有前景的工具。目前在 DLBCL 中评估的液体活检工具主要包括通过靶向测序进行基于突变的 ctDNA 检测。除了突变,cfDNA的甲基化和片段化模式可能会增加液体活检检测的灵敏度。此外,转录组生物标志物(如 cfRNA 和 EVs)的探索也势头正猛,可以进一步加深对肿瘤行为及其与周围环境相互作用的理解。这些生物标志物可以增强肿瘤信号检测,并提供对肿瘤及其微环境功能状态的认识。最后,联合多种生物标志物不仅可以提高检测性能,还可以识别有风险特异性毒性的患者。大多数 cfDNA 和 cfRNA 由造血细胞释放到血液中,这些循环核酸的起源细胞可以从测序数据中去卷积,并且可以揭示液体活检中各种免疫细胞对这一分子群贡献的变化。除了区分肿瘤爆发(flare-up)和进展外,免疫去卷积预测免疫治疗和/或细胞治疗反应的潜力仍有待确定。
为了在 DLBCL 管理中有效地利用液体活检生物标志物,定义具体的临床问题并确定所需的分析性能指标非常重要。对于DLBCL患者,建议最终目标是开发一种生物标志物驱动、风险调适的治疗策略。结合 ctDNA 分析的首个干预性临床试验目前正在招募中。可以预计,液体活检生物标志物将显著影响未来干预性试验的设计和侵袭性淋巴瘤风险调适治疗策略的开发。
参考文献
Wang S,et al.Turning the tide in aggressive lymphoma: liquid biopsy for risk-adapted treatment strategies.Trends Mol Med . 2024 May 1:S1471-4914(24)00093-5. doi: 10.1016/j.molmed.2024.04.005.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#弥漫性大B细胞淋巴瘤# #液体活检# #侵袭性淋巴瘤#
8