
新型治疗靶点
伊马替尼(Imatinib)
伊马替尼是一种酪氨酸激酶抑制剂,是首个在PAH患者中进行测试的此类药物,为研究具有显著抗增殖特性的药物(与血管扩张特性相对)以逆转血管病理提供了契机。伊马替尼选择性抑制几种酪氨酸激酶,包括融合蛋白BCR–ABL(促进白细胞增殖)、KIT以及PDGF受体(PDGFR)(图3)。伊马替尼于2001年获得批准,用于治疗慢性髓性白血病。
PDGF(血小板源性生长因子)已被证明是一种强效的增殖因子和趋化因子,对平滑肌细胞和成纤维细胞有显著作用,并且是平滑肌收缩活动的强效诱导因子。KIT是骨髓来源的造血干细胞的标志物。鉴于肺血管重塑与PAH患者中PDGF活性上调和KIT表达增加相关,伊马替尼作为PAH治疗的潜在再利用药物受到了广泛关注。
在已经确立肺血管疾病(PVD)的动物模型中,伊马替尼治疗与小型肺动脉显著的“逆转重塑”效应相关,这与其抗增殖特性一致。在随后的一项病例报告中,口服伊马替尼治疗一名尽管接受了三联治疗但已经进展到右心衰竭的终末期肺动脉高压(PAH)患者后,6分钟步行距离(6MWD)、肺血管阻力(PVR)和世界卫生组织功能等级均有所改善。这些效果在治疗6个月后得以维持且没有明显的不良反应。继几篇类似病例报告发表后,一项针对PAH患者的II期随机对照24周研究显示,与安慰剂相比,伊马替尼治疗显著降低了PVR,并且6MWD有所增加(尽管统计学上不显著)。随后的III期IMPRES试验显示,与接受安慰剂加常规PAH治疗的患者相比,接受伊马替尼治疗的患者在6MWD、PVR和心输出量方面显著改善。不幸的是,伊马替尼组的不良事件(如硬膜下血肿)和研究药物中断的发生率高于安慰剂组,FDA要求提供进一步的安全数据。尽管如此,伊马替尼在PAH中的使用仍然受到广泛关注。在一项I期试验中,干粉吸入制剂伊马替尼(AV-101)在健康志愿者中耐受性良好,相比于口服伊马替尼,其系统性暴露减少。当前正在进行的II-III期试验将评估AV-101与安慰剂的安全性和有效性,其中II期部分的主要终点是24周PVR的变化,III期部分的主要终点是24周内6MWD的变化。此外,正在进行一项开放标签单臂I-II期临床研究,旨在确定口服伊马替尼在PAH患者中的最佳耐受剂量,以建立该剂量的疗效并评估患者基因型对药物反应的影响。
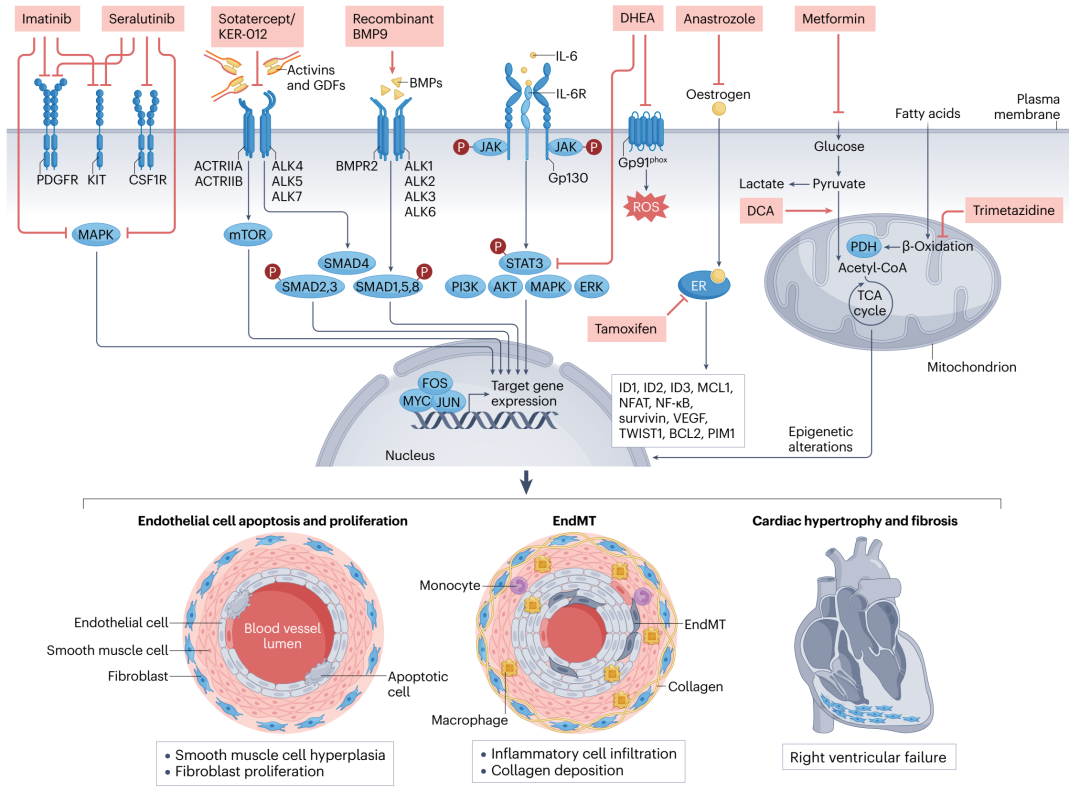
图 3:肺血管疾病的关键研究治疗方案和新靶点
酪氨酸激酶抑制剂伊马替尼是首个主要非扩血管药物,在肺动脉高压(PAH)患者中进行测试。吸入式伊马替尼和另一种酪氨酸激酶抑制剂(Seralutinib)正在进行 II 期和 III 期临床试验。激活素受体 IIA(ACTRIIA)配体捕捉剂(Sotatercept)于 2024 年在美国获批使用;ACTRIIB 配体捕捉剂 KER-012 的 II 期试验正在进行中。与性激素相关的治疗(来曲唑、他莫昔芬和脱氢表雄酮(DHEA))以及靶向代谢的药物(如二甲双胍和曲美他嗪)也在研究中。重组骨形态发生蛋白 9(BMP9)也正在开发作为 PAH 的潜在治疗方案,但 BMP9 在 PAH 中的作用尚不明确。ALK,激活素受体样激酶;BMPR,骨形态发生蛋白受体;CoA,辅酶 A;CSF1R,集落刺激因子 1 受体;DCA,二氯乙酸;EndMT,内皮细胞向间充质细胞转变;ER,雌激素受体;GDFs,生长和分化因子;ID,DNA 结合蛋白抑制因子 ID;IL-6R,IL-6 受体;NF-κB,核因子-κB;NFAT,激活 T 细胞的核因子;PDGFR,PDGF 受体;PDH,丙酮酸脱氢酶;ROS,活性氧;TCA,三羧酸循环;VEGF,血管内皮生长因子。
Seralutinib
酪氨酸激酶抑制剂seralutinib通过吸入给药,靶向PDGFRα、PDGFRβ、集落刺激因子1受体和KIT。在两种PAH的啮齿动物模型中,吸入seralutinib改善了心肺血流动力学,并减少了肺动脉和右心室的重塑。II期随机双盲安慰剂对照TORREY试验中,接受标准背景治疗的PAH患者使用吸入seralutinib与安慰剂相比,在24周时显著降低了PVR,达到了研究的主要终点。seralutinib耐受性良好,两组中最常见的不良事件是轻度到中度咳嗽。这些结果表明,吸入给药允许在肺循环中发挥足够的作用,且安全性良好。正在进行的III期试验将评估吸入seralutinib与安慰剂的安全性和有效性,主要终点是24周内6MWD的变化。
Sotatercept
Sotatercept是一种首创的融合蛋白,由人类激活素受体IIA(ACTRIIA)的细胞外结构域和人类免疫球蛋白G1的Fc结构域组成。Sotatercept作为配体捕获剂,结合了TGFβ超家族的成员,恢复了促增殖ACTRIIA途径与抗增殖BMPR2途径之间的平衡。PAH患者的肺小动脉中ACTRIIA配体activin、8型生长分化因子(GDF8)和GDF11的表达水平高于健康对照。在前期研究中,ACTRIIA-Fc融合蛋白促进了BMP9信号传导,并阻断了GDF11和activin在肺血管细胞中的促增殖效应。ACTRIIA-Fc融合蛋白还在两种PAH小鼠模型中预防和逆转了PVD和右心室功能障碍。在一项II期随机安慰剂对照试验中,皮下sotatercept显著降低了接受稳定背景治疗的PAH患者在24周时的PVR。sotatercept治疗引起的PVR下降主要是由于平均肺动脉压(mPAP)的降低,因为心输出量变化很小。在该试验的18-24个月延长期中,所有参与者都接受了sotatercept治疗,结果显示,相较于安慰剂组,切换到sotatercept组的患者在疗效终点上有所改善,且原sotatercept组患者的效果维持。最后,在一项III期随机试验中,皮下sotatercept与安慰剂在接受稳定背景治疗的PAH患者中进行了比较。大多数患者(61.6%)接受了三联背景治疗。sotatercept组在6MWD(主要终点)上显示出显著改善,并且在包括PVR、血浆NT-proBNP水平、WHO功能等级、死亡或临床恶化时间、法国风险评分和患者报告结果等次要终点上也显著改善。与II期试验一样,心输出量变化很小。
尽管疗效数据令人印象深刻,但新出现的安全性讨论。在II期试验中,sotatercept组的血小板减少症和血红蛋白水平增加,但在安慰剂组中没有观察到这种现象。在II期试验的长期延续中,有11名参与者(10.6%)报告了毛细血管扩张作为不良事件。在III期试验中,与安慰剂组相比,sotatercept治疗组的轻微出血事件、鼻出血、牙龈出血、头晕和血压升高发生得更频繁。尽管未报告sotatercept治疗患者出现危险的动静脉畸形,但毛细血管扩张的报告提示可能存在靶外的系统性血管效应,需要进一步研究。值得注意的是,ALK1的变异与遗传性出血性毛细血管扩张相关。尽管PVR和mPAP有所改善,但sotatercept治疗患者心输出量未见显著有益变化,这可能令人担忧,因为前期数据表明sotatercept类似药物可能对心脏有不利影响。然而,研究参与者接受了已确立的PAH治疗,并且基线时心脏指数正常,这可能部分解释了心脏指数未进一步增加的原因。安全性发现的长期影响尚待确定。正在进行一项开放标签的随访研究,以评估sotatercept在PAH患者中的长期安全性、耐受性和疗效。此外,目前还有另外两个III期试验正在评估sotatercept在高死亡风险(WHO功能等级III或IV)的PAH患者中的效果,以及在新诊断的中高风险疾病进展的PAH患者中的效果。
重组BMP9
BMP9的变异与PAH相关,有些患者即使在没有这些变异的情况下也表现出BMP9表达减少。MGX292是一种与原BMP9相比具有降低成骨活性但类似内皮信号传导活性的BMP9重组变体,在严重闭塞性PAH的大鼠模型中逆转了肺血管重塑,并被开发为潜在的PAH治疗药物。然而,BMP9作为PAH治疗靶点的角色仍然存在争议。BMP9的给药已被证明可以在严重闭塞性PAH的啮齿动物模型中逆转PVD,并在伴有肺纤维化的PVD模型中减轻PVD特征。然而,其他研究则显示BMP9的缺失或抑制可以减少PVD。这些发现可以通过BMP9受体ALK1和共同受体endoglin的基因变异与遗传性出血性毛细血管扩张的关联来解释;BMP9的缺失或抑制可能导致类似于出血性毛细血管扩张的血管舒张,这可能对PVD的发展有保护作用。此外,BMP9和BMP10在小鼠中的细胞类型特异性遗传失活已经显示出减弱血管平滑肌细胞的收缩性并降低血压。相反,BMP10的过表达则增加了血管收缩性和血压。总的来说,考虑到前期的混合数据,BMP9在PAH中的角色仍然不确定。
性激素相关治疗
在肺动脉高压的动物模型中,雌二醇对肺血管的作用存在不一致的研究结果,但这种激素已被证明对右心室功能和适应有保护作用。在两种肺动脉高压的啮齿动物模型中,使用芳香化酶抑制剂安曲唑抑制雌二醇合成仅在雌性啮齿动物中减缓了PVD的发展。在一项小型的随机对照试验中,安曲唑在接受稳定背景治疗的男性和绝经后女性PAH患者中耐受性良好,并且与安慰剂相比提高了6MWD,但在右心室参数(通过超声心动图评估)、循环生物标志物、功能等级或与健康相关的生活质量上没有观察到改善。对于相似患者队列的大规模随机对照II期试验的结果仍在等待中。
雌激素受体拮抗剂他莫昔芬在PAH中的作用也已被探索。在遗传性PAH的前临床模型(Bmpr2突变小鼠)中,他莫昔芬部分逆转了PVD。尽管使用安曲唑和福维司坦的组合进行更强力的雌激素抑制似乎在小鼠模型中对PAH治疗更有效,但他莫昔芬可能在绝经前女性PAH患者中更为有用,因为其引发绝经的风险较低。关于他莫昔芬在接受稳定背景治疗的男性和女性(包括绝经前和绝经后女性)PAH患者中的小型随机对照II期临床试验的结果仍在等待中。
最后,脱氢表雄酮(DHEA)作为雌激素和睾酮的前体,在严重闭塞性PAH的大鼠模型中已被证明能减少肺血管重塑。在一项未受控的试点试验中,DHEA在与慢性阻塞性肺疾病相关的肺动脉高压患者中显示出6MWD和肺血流动力学的改善,且没有出现气体交换恶化的证据。当前正在进行一项评估DHEA在接受稳定背景治疗的PAH患者中的效果的II期试验。
代谢
PAH与代谢功能障碍相关,抗糖尿病药物二甲双胍被证明对PAH具有保护作用,这可能与其血管扩张和抗增殖特性有关。二甲双胍在由缺氧或MCT引起的肺动脉高压大鼠模型中对肺血管重塑具有保护作用,并且在由缺氧结合SU5416(血管内皮生长因子受体1和2的抑制剂)引起的严重闭塞性PAH的雌性大鼠中有效,但对雄性大鼠无效。在一项随机对照的试点试验中,二甲双胍与博来霉素的联合治疗在PAH伴有先天性心脏缺陷的患者中相比于博来霉素单药治疗更显著改善了6MWD和PVR指数。目前正在进行一项评估二甲双胍治疗稳定背景治疗的PAH患者的II期随机对照试验。
沃伯格效应
PAH的发生与细胞代谢从葡萄糖氧化转向糖酵解有关。二氯乙酸通过抑制丙酮酸脱氢酶激酶促进葡萄糖氧化。在PVD的啮齿动物模型中,二氯乙酸通过恢复电压门控钾通道的表达和功能、减少肺动脉细胞增殖并促进凋亡,预防和逆转了疾病。通过PVD的回归以及二氯乙酸对右心室的直接作用,右心室功能得到改善。在严重闭塞性PAH的大鼠模型中,二氯乙酸预防了但没有逆转新内膜病变的形成。接受开放标签二氯乙酸治疗4个月的特发性PAH患者整体上在mPAP、PVR和功能能力上有改善,但一部分具有sirtuin 3和解偶联蛋白2功能缺失多态性的患者未见响应,且在接受最高剂量的患者中发生了剂量限制毒性(2级外周神经病)。鉴于这种剂量限制的神经病风险和药物代谢的个体差异,二氯乙酸可能不是PAH的理想治疗候选药物。然而,这些研究结果表明,针对PAH的细胞代谢改变的可行性以及个体化治疗的重要性。通过使用如曲美他嗪等脂肪酸氧化抑制剂,间接促进葡萄糖氧化也是可能的。在接受肺动脉束缚的老鼠中,曲美他嗪预防了右心室肥厚的发展,并改善了心脏指数和运动表现。一项II期随机对照试验显示,曲美他嗪与安慰剂相比,在右心室重塑上有小但显著的改善,并且6MWD显著增加。
血清素途径
PAH患者的血清素水平高于健康志愿者,且食欲抑制剂(如芬氟拉明,能增加血清素的可用性)与PAH的风险增加相关。然而,一个在疾病中改变的信号途径不一定是治疗该疾病的适当靶点。多种靶向血清素途径的药物(包括受体拮抗剂、受体激动剂和转运蛋白再摄取抑制剂)作为PAH的潜在治疗药物进行了研究,但在临床试验中未取得成功。一项针对PAH患者的IIb期试验中,血清素合成抑制剂rodatristat ethyl未能达到24周PVR变化的主要终点。根据这些早期研究结果及安全性数据的分析,rodatristat ethyl的后续研究已被中止。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肺动脉高压#
80