JOH:香港中文大学王昭春团队表明剪接的外显子9 ADRM1通过选择性降解肿瘤抑制因子FBXW7促进肝脏致癌性!
8小时前 iNature iNature 发表于陕西省
该研究表明剪接的外显子9 ADRM1通过选择性降解肿瘤抑制因子FBXW7促进肝脏致癌性。
泛素受体ADRM1/Rpn13控制真核生物蛋白质降解的特异性。
2025年1月9日,香港中文大学王昭春(Nathalie Wong)团队在Journal of Hepatology在线发表题为“Spliced exon9 ADRM1 promotes liver oncogenicity via selective degradation of tumor suppressor FBXW7”的研究论文,该研究表明剪接的外显子9 ADRM1通过选择性降解肿瘤抑制因子FBXW7促进肝脏致癌性。
ADRM1-ΔEx9,而不是它的全长对应物,赋予了人类肝脏器官样细胞存活优势和在流体动力转染的鼠模型中更深刻的肿瘤形成。功能性敲除导致细胞系和患者来源的类器官的自发凋亡,突出了ADRM1-ΔEx9在HCC致癌性中的关键作用。从机理上讲,ADRM1-ΔEx9的缩短的C-末端标志着特定的去泛素化酶配偶体BAP1和导航蛋白酶体特异性。ADRM1-ΔEx9中新的外显子8-10融合产生了与肿瘤抑制蛋白FBXW7的从头结合,导致其选择性蛋白酶体介导的降解。表达ADRM1-ΔEx9的肿瘤中FBXW7蛋白的缺失强调了它们对PARP抑制剂Olaparib的敏感性。值得注意的是,在原发性HCC肿瘤中ADRM1-ΔEx9的发现表明,通过其与奥拉帕尼的合成致死性相关,ADRM1-ΔEx9在低存活率和治疗机会窗口的患者亚群中过度表达。总之,ADRM1-ΔEx9重定向泛素蛋白酶体特异性,选择性降解肿瘤抑制蛋白FBXW7。这促进了HCC肿瘤的形成,并为PARPi疗法提供了合成的致死方案。

泛素蛋白酶体系统(UPS)是控制80-90%真核细胞蛋白质降解的主要蛋白水解机制。在UPS中,ADRM1(也称为Rpn13)在协调底物募集过程中发挥着重要的“校对”作用。ADRM1于2008年首次被确定为泛素受体,此后, 大量研究已经确定了其在UPS系统导航中的功能和作用模式。ADRM1通过其N-末端的泛素样pleckstrin受体(PRU)结构域识别泛素结合蛋白,该结构域以高亲和力结合K48连接的泛素。ADRM1的C-末端结构域(CTD)结合并激活去泛素酶泛素C末端水解酶37 (Uch37,也称为UCHL5),并通过释放泛素化较差的底物进行蛋白酶体降解来共同提供校对。据报道,在各种癌症类型中,包括肺癌、结肠癌、肝癌、肾癌和卵巢癌,以及急性白血病和多发性骨髓瘤,ADRM1 mRNA水平均有所增加。
选择性剪接(AS)是一种主要的转录后调节机制,负责结构转录变异和蛋白质组多样性。研究表明,肿瘤比正常组织多30%的选择性剪接事件,导致大量但基本上未探索的肿瘤相关蛋白谱。使用捕获全长转录物的长阅读RNA SMRT测序,研究人员先前描绘了人类肝细胞癌(HCC)的AS景观,并确定了ADRM1的新剪接变体,这在任何公共储存库中都没有注释。 ADRM1新变体的mRNA结构显示外显子9的跳跃(Ex9),这导致蛋白质的Cterminus改变。虽然规范的ADRM1全长(FL)已被充分研究,但ADRM1-ΔEx9亚型的区别特征,特别是在肿瘤发生中,仍然未知。
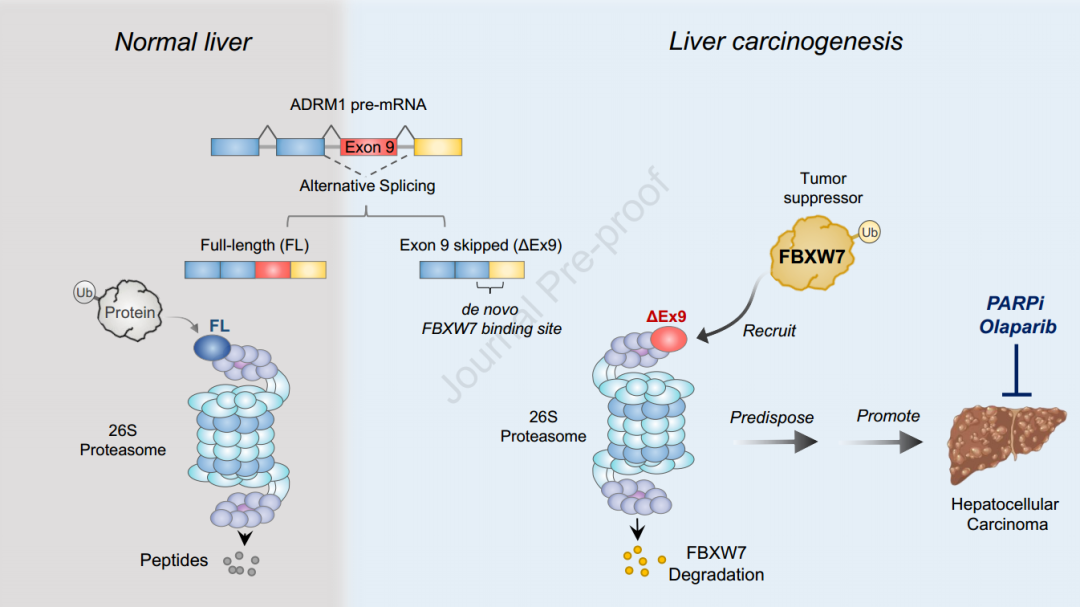
机理模式图(图源自Journal of Hepatology)
在这项研究中,研究人员报告了ADRM1-ΔEx9和ADRM1-FL之间不同的机制作用,以及ADRM1-ΔEx9在促进肝脏肿瘤发生中的可能功能。ADRM1-ΔEx9被揭示为驱动早期肝癌发生并赋予影响肿瘤发生的促肿瘤发生特征的致病变体。ADRM1-ΔEx9的功能结果重新定向HCC中的UPS特异性,以选择性降解一种有效的肿瘤抑制蛋白F-box和含WD重复结构域的-7 (FBXW7)。值得注意的是,ADRM1-ΔEx9的存在增强了HCC细胞对PARP抑制剂Olaparib的敏感性,突出了这种变体在治疗干预中的临床相关性。
参考消息:
https://www.journal-of-hepatology.eu/article/S0168-8278(24)02828-9/fulltext
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#FBXW7# #肝脏致癌性#
5