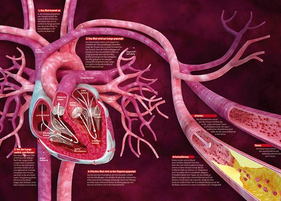
启明医疗瓣膜首次登陆欧洲 全球临床试验启动
本次亮相欧洲的“Venus P 经导管肺动脉瓣膜”是由杭州启明医疗器械有限公司研发的。开启了国产经导管肺动脉瓣膜进入欧美发达国家市场的征程。
杭州启明医疗器械有限公司 - 法洛四联症,心血管,肺动脉瓣,美通社 - 2016-09-18
Hypertension:高血压临床试验中的心力衰竭事件
SPRINT的主要结果并非由心力衰竭事件减少所致。此外,该事后分析支持对高危高血压患者采用更强化的治疗策略。
MedSci原创 - 高血压,心力衰竭 - 2021-09-23
NAT MED:AML的精准医疗:Beat AML Master 临床试验
在最近的一项研究中,未治疗的AML≥60岁的患者被前瞻性地纳入正在进行的Beat AML试验(ClinicalTrials.gov NCT03013998)
MedSci原创 - 急性髓系白血病,精准医疗 - 2020-11-07
阿尔茨海默病药物临床试验中国专家共识
为进一步帮助和促进我国 AD 药物临床试验规范化开展,中国AD药物临床试验专家组经过充分讨论形成本共识。
中华脑科疾病与康复杂志(电子版) - 阿尔茨海默病 - 2022-12-12
《肿瘤临床试验运用核心患者报告结局行业指南(草案)》解读
本文对该指南核心PRO的系统评估及运用进行解读,帮助新药临床试验从业者进一步了解PRO,对PRO在新药临床试验中的运用起到良好的促进作用。
中国新药杂志 - 肿瘤临床试验 - 2023-04-28
2024 FDA指南:癌症临床试验资格标准:表现状态
本指南是一系列指南之一,这些指南就受CDER和CBER监管的用于治疗癌症的研究药物的临床试验的资格标准提出了建议。具体而言,本指南包括有关扩大资格标准以包括具有更广泛体能状态的患者的建议。
FDA官网 - 临床试验 - 2024-05-01
晚期前列腺癌临床试验终点技术指导原则
为指导我国前列腺癌领域抗肿瘤药物的临床研发,提供可参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《晚期前列腺癌临床试验终点技术指导原则》。根据《国家药监局综合司关于印发药品技术指导原
国家药品监督管理局药品审评中心 - 晚期前列腺癌 - 2023-03-19
FDA指导原则:癌症临床试验中核心患者报告结局(草案)
本指南为申办者提供了在癌症临床试验中收集一组核心患者报告临床结果的建议,以及仪器选择和试验设计的相关考虑因素。虽然本指南侧重于患者报告的结果 (PRO) 措施,但其中一些建议可能与癌症临床试验中的其他
FDA - 患者报告结局 - 2021-10-22
FDA指导原则:临床试验中种族和民族数据的收集
本指南的目的是提供 FDA 对在美国和国外进行的 FDA 监管医疗产品临床试验提交中使用标准化方法收集和报告种族和民族数据的期望和建议。使用年龄、性别、性别、种族和民族的标准术语有助于确保一致地收集亚
FDA - 临床试验 - 2021-10-22
2011 ISHEN共识声明:肝性脑病临床试验的设计
Aliment Pharmacol Ther. 2011 Apr;33(7):739-47. - 2011-02-09
非劣效设计临床试验指导原则(征求意见稿)
《非劣效设计临床试验指导原则(征求意见稿)》起草说明一、背景和目的非劣效设计的实际应用较多,面临的技术问题也相对复杂,我国于2016年发布的《药物临床试验的生物统计学指导原则》虽然对非劣效设计进行了描述为了让临床试验各相关方正确地认识、实施和评价非劣效试验,有必要针对该设计专门制定指导原则。《非劣效设计临床试验指导原则》没有赘述其它指导原则(如ICH发布的相关指导原则和
非劣效 - 2019-10-31
新冠肺炎疫情期间药物临床试验管理指导原则(试行)
为规范我国新冠肺炎疫情期间的药物临床试验,提供有效的安全管理措施,在国家药品监督管理局的部署下,药审中心组织制定了《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》(见附件)。根据《国家药监局综合司
CDE - 新冠肺炎 - 2021-06-27
为您找到相关结果约500个