美FDA掌门人出炉在即
在5个月的延迟后,美国参议院终于要为领导该国食品药品监督管理局(FDA)的候选人——心脏病学家、临床试验专家Robert Califf进行投票了。这一程序性策略为本周进行的将决定Califf是否领导FDA的最终投票作好了准备。 去年9月,总统巴拉克·奥巴马提名了Califf,但一些立法者出于对去年11月FDA将审批转基因三文鱼是否用
中国科学报 - 食品药品监督管理局,FDA - 2016-02-26
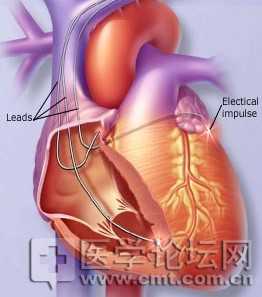
FDA扩美敦力CRT适应证
近日,美国食品与药物管理局(FDA)批准了10种美敦力双心室起搏器用于治疗伴有不太严重收缩期心衰和需右室置入起搏器的房室传导阻滞患者。
医学论坛网 - FDA,美敦力,CRT - 2014-04-15
美临床试验专家或接手FDA
2月5日,美国食品药品监督管理局(FDA)局长Margaret Hamburg宣布将于3月离开该机构。于是,有谣言称,刚被任命为FDA副局长的Califf,将接手Hamburg的职位。
中国科学报 - FDA,临床试验 - 2015-02-17
百时美向FDA提交丙肝新药NDA
百时美施贵宝(BMS)4月7日宣布,已向FDA提交了实验性丙肝药物daclatasvir(DCV)和asunaprevir(ASV)的新药申请(NDA),daclatasvir是一种实验性NS5A复制复合物抑制剂
生物谷 - 新药,FDA - 2014-04-08
白血病新药Mylotarg终获美FDA认可
辉瑞(Pfizer)公司宣布,其新药Mylotarg(gemtuzumab ozogamicin)得到了美国FDA的批准,用于治疗表达CD33抗原的新诊断急性骨髓性白血病(AML)的成人患者。FDA同时也批准该药物用于治疗2岁及以上的CD33阳性AML患者,这些患者经历复发或对初始治疗没有响应。
健康时报网 - 白血病,Mylotarg,FDA - 2017-09-03
美FDA发布德美研发的新冠疫苗分析报告:符合紧急使用授权标准
美国食品和药物管理局(FDA)8日发布一份分析报告称,临床研究结果显示,德国生物新技术公司和美国辉瑞制药有限公司合作开发的新冠疫苗符合FDA规定的紧急使用授权的标准。
中国新闻网 - FDA,新冠疫苗,授权标准 - 2020-12-09
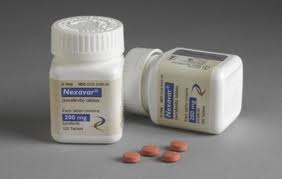
FDA授予拜耳多吉美(Nexavar)sNDA优先审查资格
拜耳(Bayer)和Onyx制药8月27日宣布,FDA已授予多吉美(Nexaver,通用名:sorafenib,索拉非尼)补充新药申请(sNDA)优先审查资格,用于治疗局部晚期或转移性放射性碘(RAI)
生物谷 - 新药,FDA - 2013-08-28
美FDA新掌门人:要对移动健康应用大松绑
6月15日,FDA官网称即将实施一项计划,进一步明晰健康应用的监管层次,并且针对如何使用“上市”后数据对健康应用进行监管给出了一系列建议。
健康点 - FDA,健康应用 - 2017-06-19
抗凝药物解毒剂Andexxa获美FDA加速批准
5月3日,美国Portola制药公司宣布,美国FDA已批准Andexxa作为首个及唯一一个凝血因子Xa抑制剂的解毒药物,用于当出现危及生命或无控制出血后的抗凝的逆转。Andexxa的本次批准基于FDA加速批准,加速批准认定则是基于健康志愿者抗Xa因子活性的基线变化数据而获得,同时该药物获得了FDA的突破性疗法及孤儿药资格认定。该适应症的完全批准
新浪医药 - 抗凝药,解毒剂 - 2018-05-05
百时美及辉瑞艾乐妥(Eliquis) sNDA获FDA批准
百时美施贵宝(BMS)和辉瑞(Pfizer)3月14日宣布,抗凝剂Eliquis(apixaban,阿哌沙班)补充新药申请(sNDA)获FDA批准,用于接受髋关节或膝关节置换术的成人患者,预防深静脉血栓
生物谷 - 新药,FDA - 2014-03-17
美消费者团体向FDA施压 要求下架武田痛风药物
2017年11月,美国FDA向公众通报了武田制药治疗高尿酸痛风症的药物Uloric(febuxostat,非布索坦)的安全临床试验初步结果。但上市前临床试验结果显示,Uloric所致的心脏相关性不良反应的发病率高于别嘌醇,因此FDA在其说
新浪医药新闻 - 痛风 - 2018-06-26
FDA接受百时美施贵宝及辉瑞Eliquis补充新药申请(sNDA)
2013年7月15日讯 /生物谷BIOON/ --百时美施贵宝(BMS)和辉瑞(Pfizer)7月11日宣布,FDA已接受有关Eliquis的补充新药申请(sNDA)。目前,这2家公司正寻求FDA批准Eliquis用于已开展髋关节或膝关节置换术的成人患者,预防深层静脉血栓(DVT)的形成。DVT可能会导致致死性的肺栓塞(PE)。FDA预计将在2014年3月15日作出最终审查决定。 Eliqu
生物谷 - 新药,FDA - 2013-07-17
FDA批准达拉菲尼-曲美替尼组合治疗甲状腺癌
美国食品和药物管理局已批准将Tafinlar(达拉菲尼)和Mekinist(曲美替尼)一起使用,用于治疗无法通过手术切除或已扩散至身体其他部位(转移性)的甲状腺未分化癌(ATC),并且这些患者具有一种异常基因
MedSci原创 - 达拉菲尼,曲美替尼,甲状腺癌 - 2018-05-11
Gabapentin口服液仿制药新药申请获得美FDA批准
Acella医药公司Gabapentin口服液仿制药申请(ANDA)获得美国食品药监局(FDA)批准。 FDA发现Acella仿制药申请的生物等效性上和治疗效果,和推荐药的是一样的。
中国医药123网 - 新药,FDA,Gabapentin - 2012-05-06
百时美丙肝新药Daklinza获FDA批准
百时美施贵宝(BMS)在研PD-1免疫疗法Opdivo(nivolumab)在欧洲监管方面如日中天,该药在一个月内,接连收获晚期黑色素瘤和鳞状非小细胞肺癌(SQ-NSCLC)适应症。
生物谷 - 丙肝 - 2015-07-27
为您找到相关结果约500个