医疗器械应急审批程序 2021
为有效预防、及时控制和消除突发公共卫生事件的危害,确保突发公共卫生事件应急所需医疗器械尽快完成审批,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与备案管理办法》(市场监管总局令第
CDE - 应急审批 - 2022-01-24
药监局:创新医疗器械特别审查程序正式发布
11月2日,国家药品监督管理局发布了关于发布创新医疗器械特别审查程序的公告(2018年第83号),旨在鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,推动医疗器械产业高质量发展。
药监局 - 创新医疗器械,特别审查程序 - 2018-11-06
总局调整部分药品和医疗器械行政审批事项审批程序
为优化药品和医疗器械审评审批流程,提高审评审批效率,日前,食品药品监管总局发布总局令31号《国家食品药品监督管理总局关于调整部分药品行政审批事项审批程序的决定》和总局令32号《国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定》,对食品药品监管总局负责的临床试验审批事项、再注册和延续注册审批事项、注册变更审批事项等药品和医疗器械行政审批事项的审批程序进行调整。
CFDA中国食品药品监管 - 中国食品药品监管,药品,医疗器械 - 2017-04-06
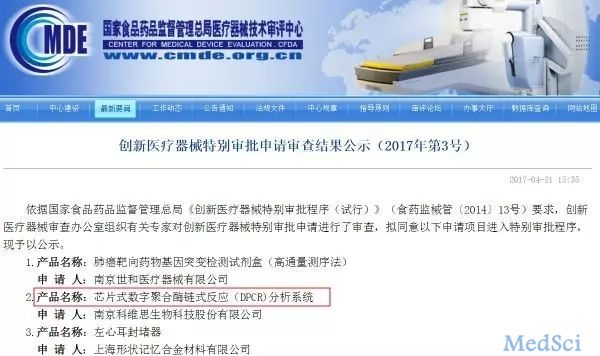
数字PCR获创新医疗器械特别审批,助力肿瘤液体活检
近期,生物探索在国家食品药品监督管理总局医疗器审评中心(CMDE)官网注意到“芯片式数字聚合酶链式反应(DPCR)分析系统”进入创新医疗器械特别审批程序。
生物探索 - 数字PCR - 2017-06-05
中国发明专利、技术国内首创的医疗器械可进入特别审批通道
国家药品监督管理局医疗器械注册管理司药品稽查专员江德元在8月1日举行的国务院政策例行吹风会上说,具有我国发明专利,在技术上属于国内首创,而且在国际领先、具有显着临床应用价值的医疗器械进入特别审批通道,进行优先审批江德元说,国家药监局已制定并实施创新医疗器械特别审批程序,加快创新器械的注册速度。实施这项措施以来,进入这个通道注册的产品比同类其他产品的时限减少83天。根据统计数据显示,从2014年实
新华社 - 发明专利,医疗器械,审批 - 2019-08-02
CFDA将对临床试验审评审批程序与方式作调整
12月14日,食品药品监管总局办公厅发布公告称,为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的要求,食品药品监管总局组织起草了《关于调整药物临床试验审评审批的公告
CFDA - CFDA,临床试验审评审批程序 - 2017-12-15
CFDA发布《创新医疗器械特别审批程序(试行)》
为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,国家食品药品监督管理总局(CFDA)组织制定了《创新医疗器械特别审批程序(试行)》,并于2月7日公布文件,文件全文如下: 创新医疗器械特别审批程序(试行) 第一条为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,
CFDA - CFDA,创新医疗器械,特别审批程序 - 2014-02-12
食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知
食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知食药监械管〔2014〕13号 各省、自治区、直辖市食品药品监督管理局: 为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,总局组织制定了《创新医疗器械特别审批程序(试行)》,现印发给你们,请遵照执行。
MedSci原创 - 食品药品监管总局,医疗器械 - 2014-02-09
ceritinib 与ramucirumab审批程序解析
在2014 年4 月,在肿瘤领域,FDA意料之中地批准了Zykadia(ceritinib,LDK378)和Cyramza(ramucirumab,IMC-1121B)两个重要产品上市。 Ceritinib 是诺华公司研发的新一代ALK酪氨酸激酶抑制剂,是继2011年辉瑞公司获批上市的克唑替尼之后第2个ALK抑制剂。Ceritinib 被批准用于既往克唑替尼治疗失败或不能耐受的ALK 阳性晚期N
临床肿瘤学论坛 - FDA,药监局,肿瘤,预后 - 2014-06-12
CDE发布了《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见
本周五,CDE发布关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知,对突破性治疗药物工作程序和优先审评审批工作程序做了说明。突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序是为我国鼓励创新和满足临床急需而设立的四个加快通道。其中,突破性治疗药物程序定位于药品临床试验研制阶段;优先审评审批程序定位于药品上市注册阶段。 这让人不禁联想到美国FDA的四种加快
网络 - CDE,突破性治疗药物 - 2019-11-09
青海简化医疗机构审批程序 鼓励社会办医连锁化
青海省卫计委综合监督局局长宋海成介绍,为继续推动医改由打好基础转向提升质量,由单项突破向系统集成和综合推进,相关部门研究出台了包括取消事项5项、简化程序事项2项、合并事项2项、新要求5项的14项具体措施
新华网 - 青海,简化医疗 - 2017-11-13
药品附条件批准上市申请审评审批工作程序(征求意见稿)
为配合新修订《药品注册管理办法》的贯彻实施,我中心组织起草了《药品附条件批准上市申请审评审批工作程序(征求意见稿)》,现在中心网站予以公示
CDE - 新药审评,药品审评 - 2021-06-27
为您找到相关结果约500个