《柳叶刀》:生存率仅为3%的这种癌,迎来一线治疗突破性方案!
2023-09-15 医学新视点 医学新视点 发表于上海
研究指出,NALIRIFOX方案或可作为转移性胰腺导管癌患者的全新一线标准治疗方案。
▎药明康德内容团队编辑
作为致死率最高的恶性肿瘤之一,胰腺癌素来有着“癌症之王”的称号。以胰腺导管癌(胰腺癌最常见病理类型)为例,转移性胰腺导管癌患者5年生存率仅为3%。
目前胰腺导管癌的一线标准治疗方案有FOLFIRINOX方案(伊立替康、氟尿嘧啶、亚叶酸钙联合奥沙利铂)、双联方案(吉西他滨+白蛋白结合型紫杉醇)等,但是这些方案的治疗效果相对有限。尽管近几十年来临床科研人员对胰腺导管癌发病机制的了解有了很大的提高,但胰腺导管癌临床治疗方面尚缺乏突破性进展。
近日,《柳叶刀》(THE LANCET)发表重磅研究论文。研究指出,NALIRIFOX方案(伊立替康脂质体、氟尿嘧啶、亚叶酸钙联合奥沙利铂)或可作为转移性胰腺导管癌患者的全新一线标准治疗方案。论文强调,NAPOLI 3试验是“在全球社区和学术中心范围内、头对头比较两种联合化疗方案一线治疗胰腺导管癌患者的首个3期试验”。

截图来源:THE LANCET
论文指出,伊立替康是一种拓扑异构酶Ⅰ抑制剂,主要通过其活性代谢产物SN-38发挥作用。伊立替康脂质体是一种脂质体制剂(即将伊立替康包裹在脂质体中),该种剂型有助于伊立替康在转化为SN-38之前在血液循环中滞留更长的时间,形成长循环效应(病灶内伊立替康和SN-38水平更高、持续存在时间更长)。
3期NAPOLI 1试验的结果表明,与氟尿嘧啶联合亚叶酸钙方案相比,伊立替康脂质体联合氟尿嘧啶和亚叶酸钙方案显著延长了转移性胰腺导管癌患者的总生存期(OS);另外一项1/2期试验的结果表明,伊立替康脂质体联合氟尿嘧啶、亚叶酸钙和奥沙利铂方案(NALIRIFOX)在转移性胰腺导管腺癌初治患者中具有良好的抗肿瘤活性。患者的中位无进展生存期(PFS)为9.2个月,OS为12.6个月。
基于上述这些结果,研究人员开展了3期NAPOLI 3研究。
NAPOLI 3是一项随机、开放标签、3期研究,旨在比较NALIRIFOX方案与双联方案(吉西他滨+白蛋白结合型紫杉醇)在转移性胰腺导管癌一线治疗中的疗效和安全性差异。研究在全球18个国家的187个社区和学术中心开展。入组患者以1:1的比例被分配接受NALIRIFOX方案(NALIRIFOX治疗组)或双联方案治疗(双联治疗组)。研究主要终点为意向治疗(ITT)人群的OS。
整体而言,2020年2月19日至2021年8月17日,共有770例患者被随机分配至NALIRIFOX治疗组(n=383)和双联治疗组(n=387)。
中位随访16.1个月的分析结果显示,NALIRIFOX治疗组的中位OS为11.1个月,而双联治疗组的中位OS为9.2个月(HR=0.83;95%CI 0.70~0.99;p=0.036)。与双联治疗组相比,NALIRIFOX治疗组患者的死亡风险降低17%。
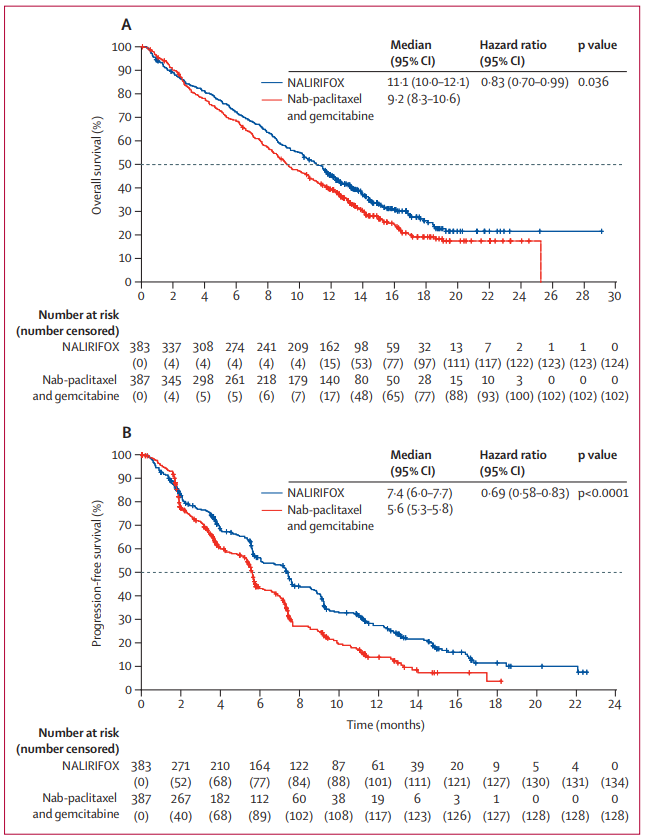
▲NALIRIFOX治疗组和双联治疗组的OS和PFS分析数据(图片来源:参考资料[1])
安全性方面,NALIRIFOX治疗组和双联治疗组分别有322例(87%)和326例(86%)患者发生≥3级治疗相关不良事件(TEAE)。此外,NALIRIFOX治疗组和双联治疗组分别有6例(2%)患者和8例(2%)患者发生治疗相关死亡。
总体而言,NAPOLI 3试验的分析结果表明,与双联方案(吉西他滨+白蛋白结合型紫杉醇)相比,NALIRIFOX方案一线治疗可为转移性胰腺导管癌患者的OS和PFS带来统计学显著且有临床意义的改善。
论文强调,胰腺导管癌是预后极差的恶性实体肿瘤,且大多数胰腺导管癌患者可选择的治疗方案很少,临床上这部分患者亟需有效且耐受性良好的新型治疗方案。伊立替康脂质体的应用有望进一步增强化疗药物方案带来的临床获益,当前研究结果支持使用NALIRIFOX方案作为转移性胰腺导管癌患者一线治疗的参考方案。
参考资料
[1] Zev A Wainberg et al, NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. THE LANCET. DOI: 10.1016/S0140-6736(23)01366-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













学习
48