学术前沿|J Hepatol:治疗性乙肝疫苗启动阶段免疫应答成功的关键因素
2023-09-30 临床肝胆病杂志 临床肝胆病杂志 发表于陕西省
慢性乙型肝炎(CHB)患者的免疫应答通常缺乏中和抗体,缺乏病毒特异性T淋巴细胞或其部分功能失调,最终导致HBV特异性免疫耐受。
持续性HBV感染的特征是适应性免疫应答较弱,这是由于在乙型肝炎病毒(HBV)急性感染早期CD4 T淋巴细胞启动效率低下,随后发生无效的CD8 T淋巴细胞反应。因此,慢性乙型肝炎(CHB)患者的免疫应答通常缺乏中和抗体,缺乏病毒特异性T淋巴细胞或其部分功能失调,最终导致HBV特异性免疫耐受。
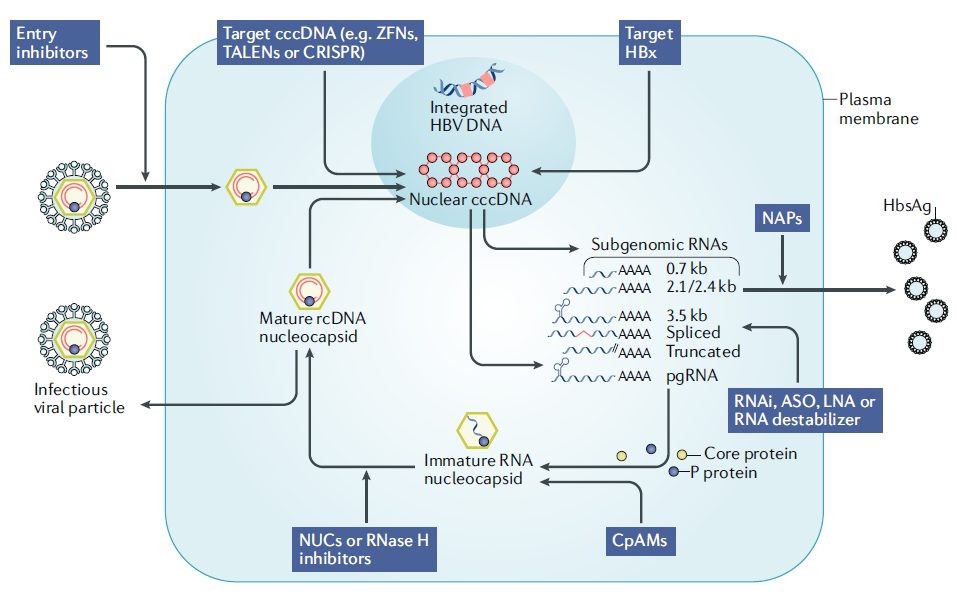
治疗性疫苗是通过某种途径来弥补或“唤醒”机体的免疫反应,从而达到清除病毒目的的一种新型治疗手段,接种治疗性疫苗如果能够将慢性HBV感染者的免疫状态恢复到类似于自然消退者的状态,则有望实现慢性HBV感染的治愈。迄今为止已有多项治疗性乙肝疫苗进行了临床试验,但遗憾的是,现有的治疗性疫苗所显现出的临床疗效是非常有限的,这表明需要采取更为复杂的方法来克服免疫耐受并诱导功能性免疫应答以对抗CHB患者中的HBV。基于此,该团队开发了一种临床候选治疗性乙肝疫苗(TherVacB)。
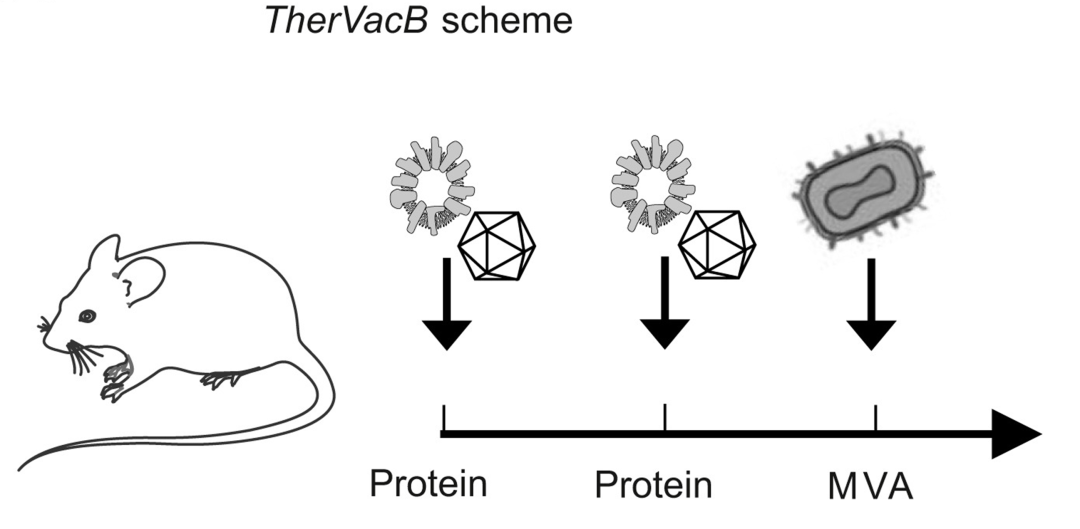
TherVacB是CHB的一种潜在治愈性治疗选择,是一种新型的异源引物增强型治疗性乙肝疫苗。在TherVacB中,蛋白质被用以驱动宿主机体的免疫反应,使机体获得更强和更为持久的免疫力。但如何使疫苗在最大程度上发挥作用并对疫苗的使用策略做出相应调整需要进一步明确疫苗各类组分分别通过激活宿主机体哪种免疫细胞起效。2023年4月,慕尼黑技术大学病毒学研究所Jinpeng Su团队在Journal of Hepatology上发表了题为“Activation of CD4 T cells during prime immunization determines the success of a therapeutic hepatitis B vaccine in HBV-carrier mouse models”的文章,该文章通过研究治疗性乙型肝炎疫苗接种在两个临床前HBV携带小鼠模型中不同条件下的作用,揭示了CD4 T淋巴细胞对TherVacB发挥抗病毒效能的关键作用。研究结果表明,应用激活CD4 T淋巴细胞和CD8 T淋巴细胞的HBV抗原的最佳制剂为治疗性疫苗接种的抗病毒作用提供了基础,而CD4 T淋巴细胞的耗竭导致疫苗诱导的抗病毒效力的完全丧失。此外,CD8 T淋巴细胞作用的增强在小鼠模型中对于控制HBV同样具有重要作用。该项研究结果为合理设计CHB的治疗性疫苗提供了重要见解。
基于蛋白质的疫苗通常需要佐剂来充分刺激和形成免疫反应。将几种单独的免疫刺激性化合物组合成单一制剂已被证明可以提高免疫原性。考虑到在长期慢性HBV感染期间产生的强烈的病毒特异性免疫耐受,研究者们推断在TherVacB中使用优化的组合佐剂将增强HBV特异性免疫反应。重组乙型肝炎表面和核心抗原(HBsAg和HBcAg)颗粒是由不同的脂质体或水包油乳液复合佐剂配制的,该佐剂含有皂苷QS21和单磷酰脂质A。本研究通过将皂苷QS 21和合成MPL结合作为免疫刺激剂、将乳液或脂质体作为递送系统的新型佐剂,和基于核苷酸的佐剂c-di-AMP进行比较,在持续复制的HBV野生型小鼠和HBV携带小鼠中评估蛋白抗原制剂的免疫原性和抗病毒作用。
结果显示,联合佐剂制剂可以使HBsAg和HBcAg的完整性保持≥12周,促进人和小鼠树突状细胞的活化,并在TherVacB中的野生型和HBV携带小鼠中引发HBV特异性抗体和T淋巴细胞反应。引发HBV特异性1型和2型T辅助反应的联合佐剂诱导了高滴度抗-HBs、细胞毒性T淋巴细胞反应和HBV的长期控制。在选择性CD8 T淋巴细胞耗竭后,HBsAg仍然下降,但HBV复制没有得到控制。TherVacB启动阶段的选择性CD4 T淋巴细胞耗竭导致疫苗诱导的免疫应答及其在小鼠中的治疗性抗病毒作用的完全丧失。
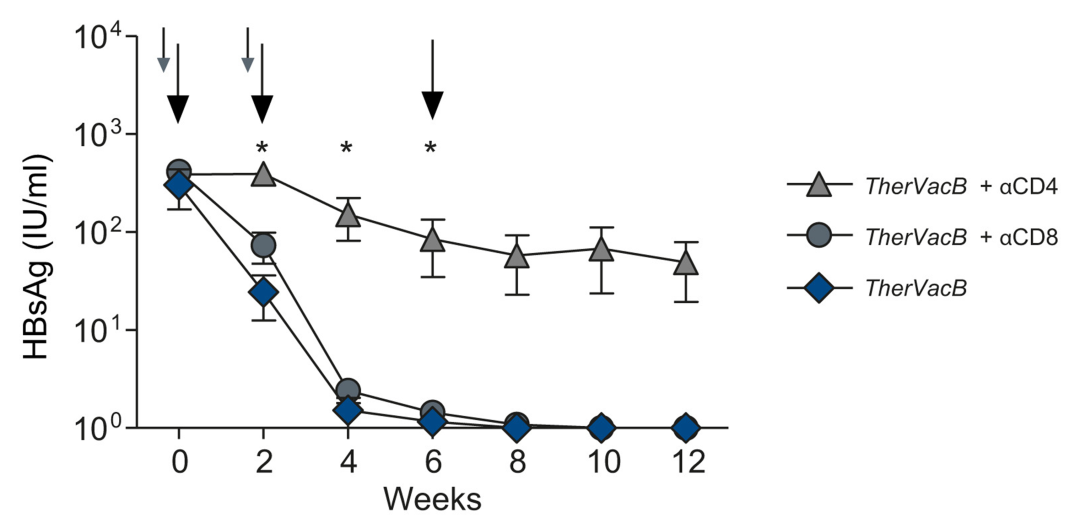
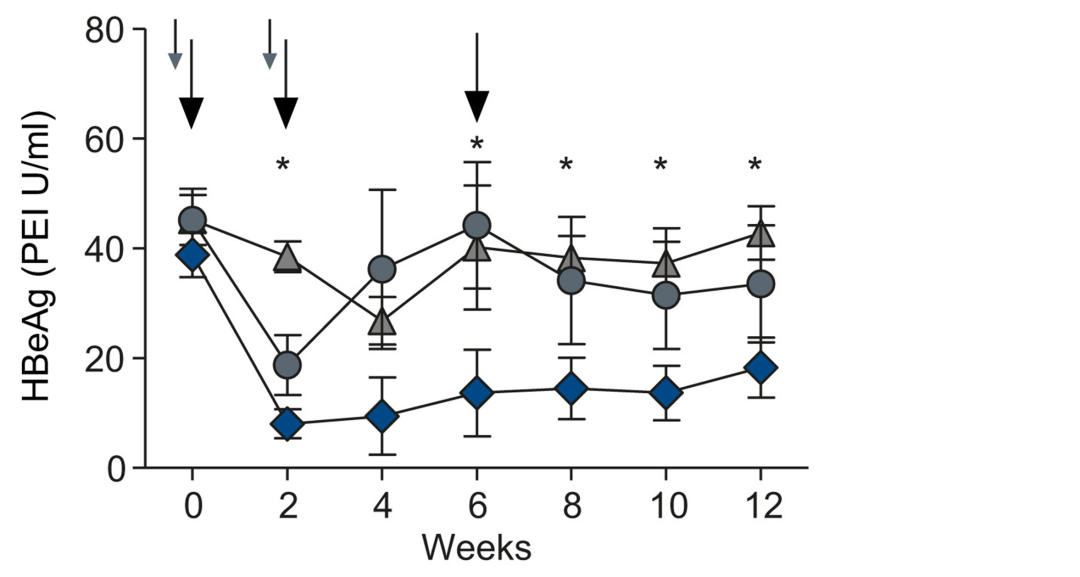
在初免疫苗接种期间,CD4 T淋巴细胞的活化是打破免疫耐受和控制HBV的关键。病毒特异性CD8 T淋巴细胞代表了在急性感染期间负责HBV清除的关键细胞效应子。然而,有效HBV特异性CD8 T淋巴细胞反应的诱导依赖于CD4 T淋巴细胞的早期引发,因此,HBV特异性CD4 T淋巴细胞应答不足可能导致在CHB期间观察到的病毒特异性T淋巴细胞免疫功能障碍。该研究证明,在TherVacB的启动阶段,CD4 T淋巴细胞的耗竭导致疫苗介导的抗HBV功效完全丧失,这提供了直接证据,证明有效启动HBV特异性CD4 T淋巴细胞对于成功的治疗性疫苗接种和在小鼠持续感染HBV期间打破病毒特异性免疫耐受至关重要。当CD4 T淋巴细胞在初免疫苗接种期间耗尽时,抗病毒功效丧失。虽然辅助T淋巴细胞的选择性耗竭是不可能的,但在引发CD4 T淋巴细胞中起独特作用的cDC 2的共耗竭证实了此项观察。研究还证明,MVA载体介导的T淋巴细胞免疫增强,对于TherVacB在小鼠中的抗病毒作用是不可或缺的,并且在引发阶段CD8 T淋巴细胞的消耗导致抗病毒效力和HBV控制的丧失。这有力地支持了使用异源引发-加强方案进行治疗性疫苗接种。
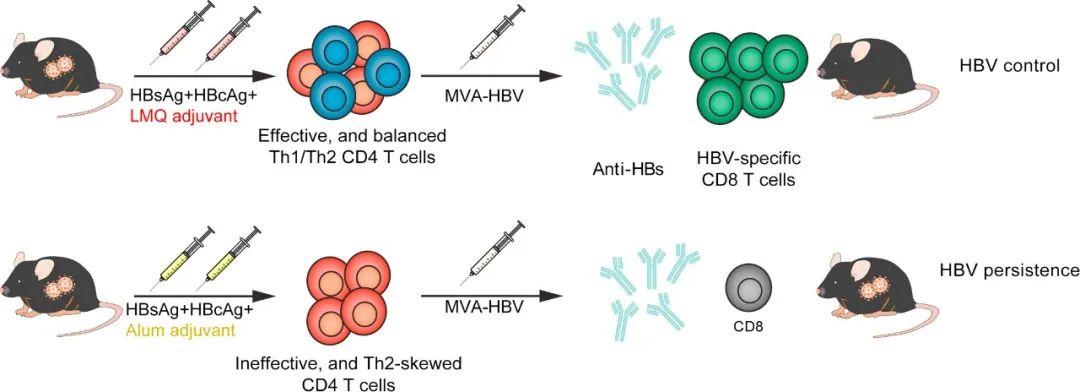
该研究还发现,特别是在接种疫苗后,未感染和HBV携带小鼠之间的核心特异性T细胞反应存在显著差异,表明诱导核心特异性免疫以实现HBV治愈的重要性。在CHB患者中观察到的HBV特异性B淋巴细胞和T淋巴细胞耐受可能是由于缺乏关键免疫细胞如DC的活化。因此,成功的针对CHB的免疫治疗方法不仅应克服对HBV的适应性免疫耐受,还应克服先天性免疫耐受以产生有效的抗病毒免疫应答。
综上所述,在TherVacB的启动阶段,CD4 T淋巴细胞的活化是HBV特异性抗体和CD8 T淋巴细胞应答的关键决定因素。
摘译自Jinpeng Su, Livia Brunner, Anna D Kosinska, et al. Activation of CD4 T cells during prime immunization determines the success of a therapeutic hepatitis B vaccine in HBV-carrier mouse models. J Hepatol. 2023 04;78 (4), 717-730.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言