靶向PD-1/PD-L1小分子药物的研究进展
2024-07-23 小药说药 小药说药 发表于上海
介绍癌症免疫治疗中小分子药物的优势,阐述靶向 PD-1/PD-L1 小分子的设计、作用机制及临床研究进展,指出其前景广阔。
前言
利用免疫途径治疗癌症的免疫疗法正在迅速成为继手术、化疗和放疗之后的一种公认的癌症治疗方法。其中利用针对细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性死亡受体1(PD-1)或程序性死亡配体1(PD-L1)的单克隆抗体进行检查点阻断,在癌症免疫治疗方面取得了显著突破。
然而,尽管免疫疗法有其优点,但它只在一小部分患者中获得成功,而广泛预测其疗效的生物标志物仍有待确定。此外,治疗期间还可能发生严重的治疗相关毒性,称为免疫相关不良事件(irAE),主要是由于免疫系统平衡失调。

因此,小分子药物又回到人们的视野,因为这类药物相比单抗有许多优点。特别是,较短半衰期的小分子有利于急性和可逆的作用,并可能减少持久的全身副作用。与抗体不同的是,小分子通常以细胞内蛋白质为靶点,并具有不同的毒性特征,使其成为适用联合治疗的候选者。此外,与抗体相比,它们可以以更低的成本生产,并且通常可以口服给药。因此,需要基于免疫学和肿瘤学过程的分子洞察力的新策略来提高小分子在免疫治疗中的潜力,重点是小分子有望提高检查点阻断对癌症治疗的成功率。
靶向PD-1/PD-L1小分子的设计
PD-1/PD-L1受体-配体相互作用是蛋白质-蛋白质相互作用(PPI)的经典例子;因此,为这些相互作用设计抑制剂是极具挑战性的。这主要是因为(a)相互作用的大范围接触面积(1500–3000Å),(b)存在平坦的界面,没有深而明确的结合口袋,适合以高亲和力结合配体,(c)缺乏内源性小分子配体作为参考标准。
在分析PD-1:PD-L1和PD-1:PD-L2复合物的晶体结构的进展方面,人们发现了几个潜在热点区域。基于PD-1:PD-L1晶体结构在PD-L1上鉴定的三个主要热区包括(1)由Tyr56、Glu58、Arg113、Met115和Tyr123的侧链组成的疏水口袋;(2) 由Met115、Ala121和Tyr123组成的疏水位点附近的第二口袋;和(3)由Asp122、Tyr123、Lys124和Arg125的主链和侧链组成的延伸槽。这些区域被认为是使用常规小分子结合PD-L1的理想区域。
目前,主要有两类不同的靶向PD-L1的小分子抑制剂,即(a)基于联苯支架的化合物;以及(b)在功能测定中鉴定的模仿受体-配体界面的氨基酸启发的小分子。
联苯衍生物
BMS的科学家基于PD-1:PD-L1相互作用的机制,开发了一系列联苯衍生物。
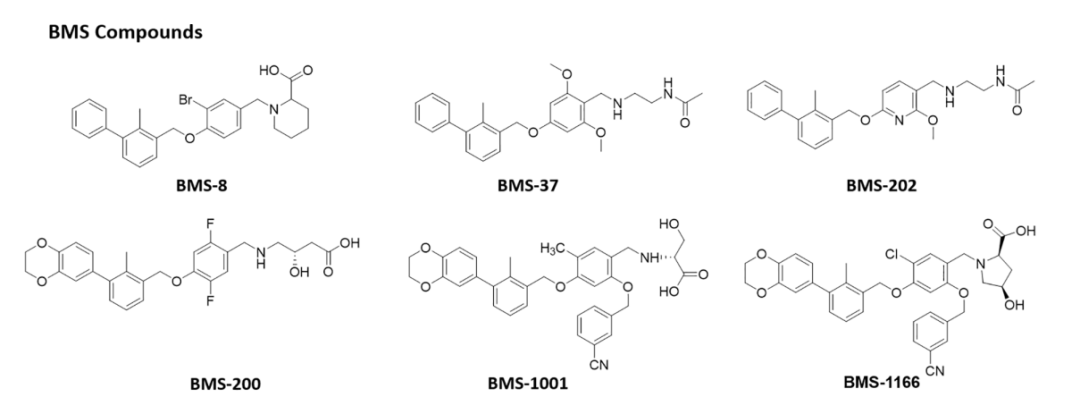
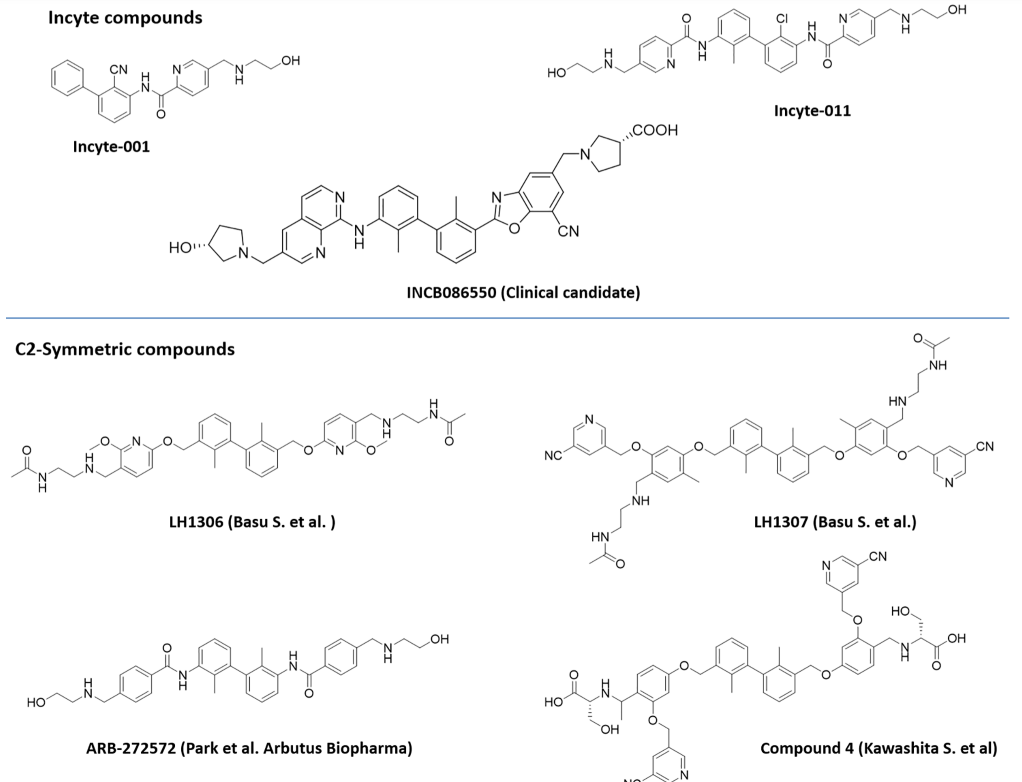
此外,过去6年来,包括Incyte Corporation、Arising International Inc.、Chemocentryx Inc.、Polaris Pharmaceuticals和Guangzhou Maxinovel Pharmaceeticals Co.在内的多家公司已经发现了一系列基于联苯核心的小分子PD-L1抑制剂。在新的改性联苯支架中,具有C2对称性或含有极性基团的假对称性的化合物比不对称结构获得了很多关注。
多肽
检查点蛋白是膜蛋白,其中大多数来自B7家族。B7家族的大多数成员及其配体属于免疫球蛋白超家族(IgSF)。IgSF蛋白的受体-配体相互作用通过环、链或环和链介导。基于这些相互作用界面的多肽设计是PPI抑制剂设计的一种行之有效的策略。
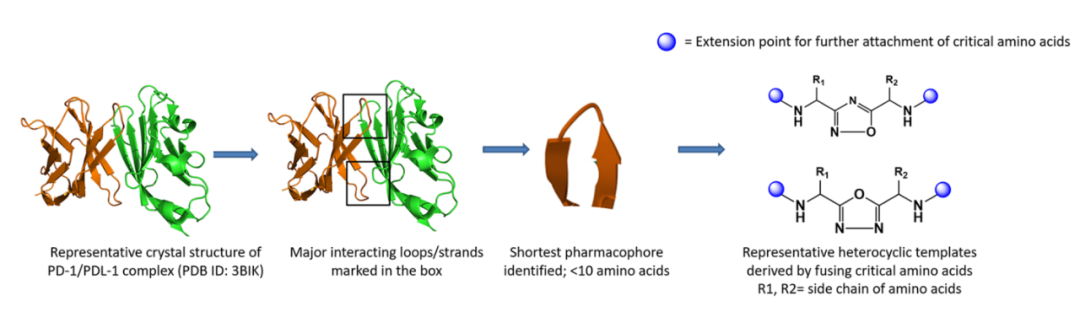
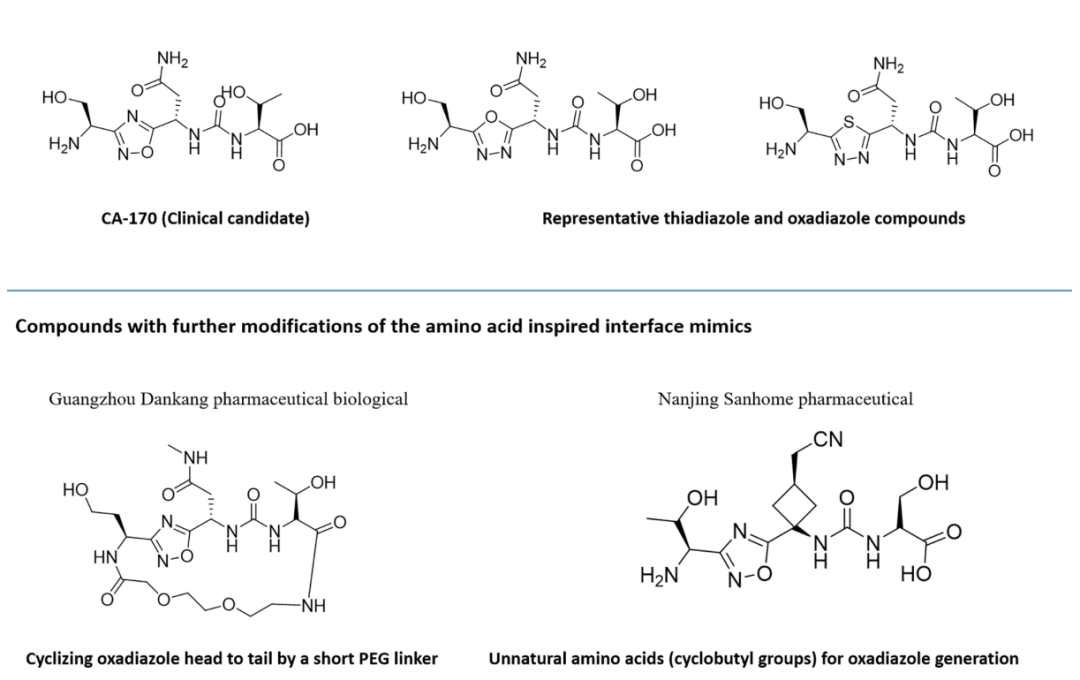
利用上述设计原理,已经开发出了了几种拟肽分子。
靶向PD-1/PD-L1小分子的作用机制
尽管多数分子设计来自于能够与PD-1:PD-L1复合物中的一个结合并阻止相互作用,但新出现的数据表明,一些化合物拮抗PD-1信号传导具有额外的复杂性。
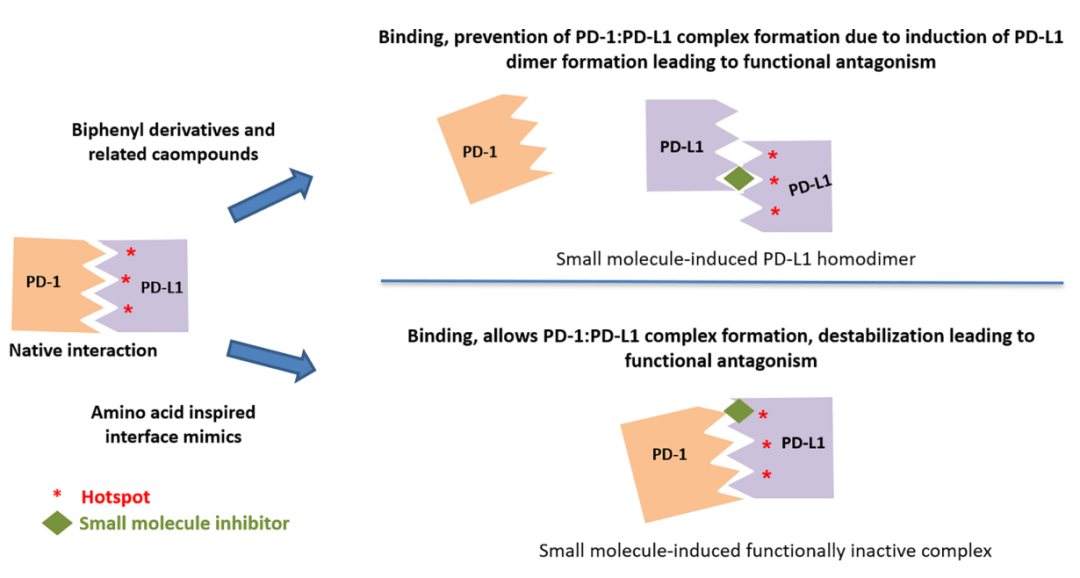
诱导PD-L1二聚并抑制PD-1:PD-L1相互作用
通过晶体结构研究,一些化合物被证明通过诱导PD-L1二聚化来抑制PD-1:PD-L1相互作用。例如BMS的小分子抑制剂倾向于首先与一种PD-L1单体相互作用,然后形成二聚体,以获得稳定性优势。而Incyte和Arbutus还利用了PD-L1二聚体中固有的C2对称性,通过对称化其分子来获得更大的效力。
阻断PD-L1从内质网向高尔基体输出
PD-L1胞外结构域中存在的四个N-糖基化位点(Asn35、Asn192、Asn 200和Asn 219)对配体蛋白的稳定性是必需的,除Asn35外,所有其他糖基化位置对其与受体的相互作用都非常关键。BMS-1166特异性抑制部分PD-L1的糖基化,并通过阻断PD-L1从内质网向高尔基体的输出而使其功能失活。
诱导PD-L1二聚和内化
化合物ARB-272572通过顺式相互作用的同源二聚体诱导细胞表面PD-L1二聚来抑制PD-1/PD-L1轴,这种同源二聚物通过快速内化到胞质中触发细胞表面PD-L1的快速丢失,从而防止与表达PD-1的细胞发生进一步相互作用。
与PD-L1结合而不干扰PD1:PD-L1复合物的形成
与基于联苯的小分子抑制剂相比,CA-170是高度极性的,在细胞环境中观察到的PD-L1信号传导的功能拮抗作用,而其与PD-L1的直接结合却不破坏PD1:PD-L1复合物导致形成有缺陷的三元复合物。CA-170的这种作用模式类似于两种已报道的抗PD-1抗体的作用模式,它们在不干扰PD-1:PD-L1复合物形成的情况下拮抗PD-1信号传导。
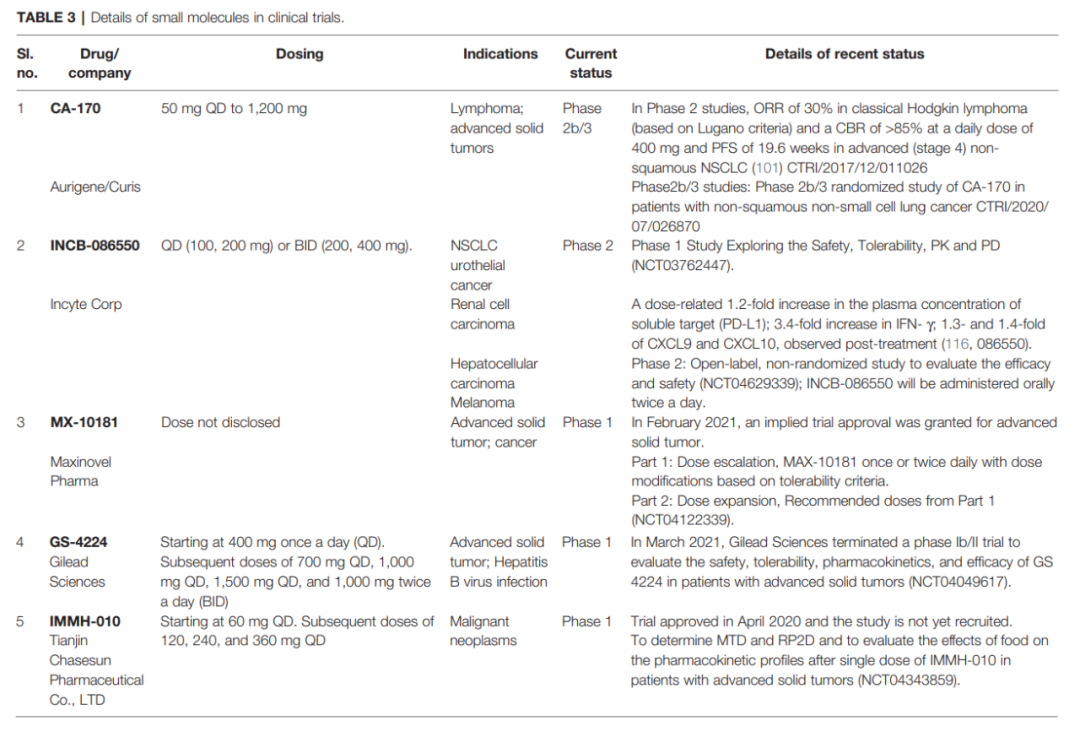
靶向PD-1/PD-L1小分子的临床研究进展
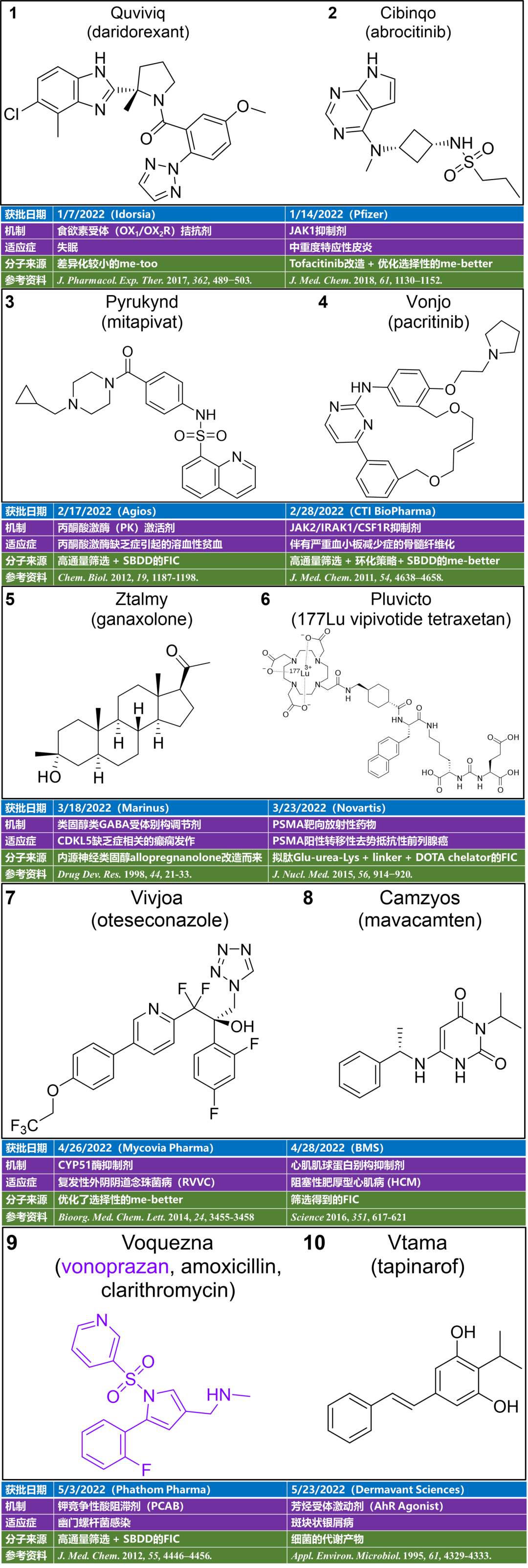
CA-170是第一个于2016年进入临床试验的口服小分子PD-L1抑制剂,目前正在进行2b/3期试验(由Curis和Aurigene共同开发)。Incyte化合物INCB-086550的临床试验于2018年启动,第一阶段预计将于2022年完成。下表综合了临床上所有小分子抑制剂的最新发现。
小结
自首个PD-1——Opdivo单抗于2014年获FDA批准上市后,截止目前,中国也已有10款PD-1抑制剂、5款PD-L1抑制剂上市。PD-1/L1抗体可以说是目前癌症靶向药物研发中的“超热”赛道。然而,单抗存在诸多固有缺点,包括口服生物利用度差、延长的组织滞留时间和半衰期、较差的膜通透性、运输储存等方面的弊端,另外,抗体药物成本较高也是不可忽视的问题。因此,越来越多的研究人员在探索小分子药物作为PD-1/L1抑制剂以规避治疗性抗体的缺点。
另外,与PD-1/L1抗体相比,口服小分子药物可以很容易地渗透到组织中,因此可以针对细胞外和细胞内的目标来促进抗肿瘤免疫,实现对肿瘤微环境的调节,甚至有望将“冷”肿瘤转为“热”肿瘤。而且它们的半衰期通常很短,降低了产生不良影响的机会。基于这些特点,在癌症免疫治疗领域开发基于小分子的策略引起了广泛的兴趣,其未来的前景仍然广阔而令人兴奋。
参考文献:
1.Immune-checkpoint inhibitors: long-termimplications of toxicity. Nat Rev Clin Oncol. 2022 Jan 26 : 1–14.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#小分子药物# #癌症免疫治疗# #PD-1/PD-L1#
80