【论著】长链非编码核糖核酸肺腺癌转移相关转录本1和核旁斑组装转录本1在低氧预适应小鼠海马神经保护中的作用研究
2024-09-28 中国脑血管病杂志 中国脑血管病杂志 发表于上海
本研究拟通过分析MALAT1和NEAT1在HPC小鼠海马细胞中的表达,探讨其与NR2B的表达及缺血缺氧后神经保护的关系,为进一步明确低氧或HPC的神经保护分子机制提供理论依据。
摘要:目的探索长链非编码核糖核酸(lncRNA)肺腺癌转移相关转录本1(MALAT1)和核旁斑组装转录本1(NEAT1)在低氧预适应(HPC)小鼠海马细胞中的表达及其与神经保护的关系。方法(1)将36只雄性美国癌症研究所(ICR)小鼠按照随机数字表法完全随机分为3组:对照组、低氧组和低氧预处理组,每组12只。对照组小鼠不进行低氧暴露,低氧组小鼠低氧暴露1次,低氧预处理组小鼠低氧暴露4次。低氧处理结束后立即将所有小鼠脱颈椎处死并分离海马组织分组保存。(2)将HT22细胞培养于含10%胎牛血清和100U/ml青霉素-链霉素的培养基,细胞汇合率大于90%时将其转移至24孔板中培养后分2批进行处理。通过转染试剂将6pmol的乱序小干扰核糖核酸(siRNA)、MALAT1siRNA(siMALAT1)、siNEAT1、siMALAT1 + siNEAT1分别一一对应转染至第一批HT22细胞的阴性对照组、siMALAT1组、siNEAT1组、siMALAT1 + siNEAT1组细胞中,空白组不做任何处理;然后在正常条件下(5%CO2和95%空气)培养48h;第二批HT22细胞中,利用转染试剂分别将6pmol的乱序siRNA、乱序siRNA、siMALAT1、siMALAT1、siNEAT1、siNEAT1分别一一对应转染至阴性对照组、阴性对照+氧糖剥夺-再灌注(OGD/R)组、siMALAT1组、siMALAT1 + OGD/R组、siNEAT1组、siNEAT1 + OGD/R组的HT22细胞中,转染后48h将阴性对照组、siMALAT1组、siNEAT1组HT22细胞在正常条件下(5%CO2和95%空气)继续培养,将阴性对照+OGD/R组、siMALAT1 + OGD/R组、siNEAT1 + OGD/R组细胞进行OGD/R处理,即低氧条件下(1%O2+5%CO2+94%N2)暴露8h,之后再进行正常条件下培养16h。(3)通过实时荧光定量聚合酶链反应(PCR)及蛋白免疫印迹法测定各组小鼠海马组织中MALAT1、NEAT1、N-甲基-D-天冬氨酸受体亚基2B(NR2B)信使核糖核酸(mRNA)、NR2B蛋白水平的相对表达量和各组HT22细胞转染处理后NR2B mRNA、NR2B蛋白水平的相对表达量及各组HT22细胞转染和OGD/R后的血影蛋白分解产物、活化半胱氨酸蛋白酶蛋白3的相对表达量,并计算各组HT22细胞存活率。结果(1)3组小鼠海马中MALAT1(F=43.92)、NEAT1(F= 506.40)、NR2B mRNA (F= 50.64)及NR2B蛋白(F=41.24)的相对表达量差异均有统计学意义(均P<0.05)。与对照组相比,低氧组MALAT1[(1.68 ± 0.06)比(1.00±0.08)]、NR2B mRNA [(1.26 ± 0.06)比(1.00 ± 0.01)]及NR2B蛋白[(1.47 ± 0.05)比(1.00 ± 0.01)]的相对表达量均增加(均P<0.05),而NEAT1[(1.02 ± 0.10)比(1.00±0.03)]的相对表达量组间差异无统计学意义(P>0.05),低氧预处理组中MALAT1[(1.12±0.13)比(1.00±0.08)]和NEAT1[(2.88±0.10)比(1.00±0.03)]的相对表达量增加;与低氧组比较,低氧预处理组NR2B mRNA[(0.54 ± 0.07)比(1.26 ± 0.06)]及NR2B蛋白[(1.17 ± 0.07)比(1.47 ± 0.05)]的相对表达量均降低(均P< 0.05)。(2)5组HT22细胞转染后NR2B mRNA(F=36.92)及NR2B蛋白(F=56.98)的相对表达量差异均有统计学意义(均P<0.05)。与阴性对照组相比,siMALAT1组[NR2B mRNA:(2.04 ± 0.08)比(0.94 ± 0.04),NR2B蛋白:(1.72 ± 0.13)比(0.93 ± 0.02)]、siNEAT1组[NR2B mRNA:(2.15 ± 0.13)比(0.94 ± 0.04),NR2B蛋白:(1.87 ± 0.46)比(0.93 ± 0.02)]、siMALAT1 + siNEAT1组[NR2B mRNA:(2.09 ± 0.16)比(0.94 ± 0.04),NR2B蛋白:(2.07 ± 0.30)比(0.93 ± 0.02)]的NR2B mRNA及NR2B蛋白的相对表达量均增加(均P<0.05)。(3)6组HT22细胞转染及OGD/R处理后血影蛋白分解产物(145/150 kDa蛋白;F= 12.43)、血影蛋白分解产物(120 kDa蛋白;F= 7.15)、活化的半胱氨酸蛋白酶蛋白3蛋白(F=6.61)的相对表达量差异均有统计学意义(均P<0.05)。与siMALAT1组比较,siMALAT1 + OGD/R组的145/150 kDa [(1.42 ± 0.48)比(0.85 ± 0.34)]、120 kDa[(1.33 ± 0.37)比(0.52 ± 0.19)]的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白[(2.43±0.35)比(1.15±0.24)]相对表达量均增加(均P<0.05);与阴性对照 + OGD/R组比较,siMALAT1 + OGD/R组的145/150 kDa[(1.42 ± 0.48)比(1.23 ± 0.17)]、120 kDa[(1.33 ± 0.37)比(0.80 ± 0.21)]的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白[(2.43 ± 0.35)比(1.46 ± 0.39)]相对表达量均增加(均P<0.05);与siNEAT1组比较,siNEAT1 + OGD/R组的145/150 kDa [(1.28 ± 0.44)比(0.87 ± 0.32)]、120 kDa [(0.81 ± 0.36)比(0.63 ± 0.16)]的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白[(1.51±0.45)比(1.01±0.27)]相对表达量均增加(均P<0.05)。(4)6组HT22细胞存活率差异有统计学意义(F=5.54,P<0.05)。与阴性对照组比较,siMALAT1组、siNEAT1组、siMALAT1 + OGD/R组及siNEAT1 + OGD/R组HT22细胞存活率均降低[(0.65 ± 0.40)、(0.76 ± 0.35)、(0.24 ± 0.17)、(0.23 ± 0.16)比(0.84 ± 0.04),均P< 0.05];与siMALAT1组比较,siMALAT1 + OGD/R组细胞存活率降低[(0.24±0.17)比(0.65±0.40),P<0.05];与siNEAT1组比较,siNEAT1 + OGD/R组细胞存活率降低[(0.23±0.16)比(0.76±0.35),P<0.05]。结论HPC增加了小鼠海马组织中MALAT1和NEAT1的表达,MALAT1和NEAT1可能通过影响NR2B的表达参与小鼠缺血缺氧后的神经保护作用。
卒中和低氧-缺血性脑病等多种疾病可造成神经系统低氧或缺血性损伤。低氧预适应(hypoxia preconditioning, HPC)是一种内源性保护机制,可提高细胞、组织、器官或机体对低氧或缺血性损伤的耐受性,是一种低氧或缺血性神经系统疾病的潜在治疗策略,但其确切分子机制尚不清楚,可能涉及基因转录表达调控。长链非编码核糖核酸(long non-coding ribonucleic acid, lncRNA)是一类内源性分子,在基因表达和转录后调控中发挥重要作用。研究显示,部分lncRNA参与了脑低氧或缺血神经损伤过程。肺腺癌转移相关转录本1(metastasis - associated lung adenocarcinoma transcript1, MALAT1)和核旁斑组装转录本1(nuclear paraspeckle assembly transcript1, NEAT1)位于同一基因组位点,并为同一初级转录本的不同剪切产物。MALAT1和NEAT1均对低氧敏感,研究显示,NEAT1和MALAT1是体外培养细胞在低氧环境中表达变化比较显著的lncRNA,低氧条件下MALAT1和NEAT1的表达上调,可能在卒中病理学中起到神经保护作用。
N-甲基-D-天冬氨酸受体2B亚基(N-methyl-D-aspartate receptor 2B, NR2B)是大脑神经细胞N-甲基-D-天冬氨酸受体的主要亚基,易受缺血或低氧的影响,并且在缺血或低氧后神经细胞死亡和突触可塑性中发挥着关键作用。大脑中NR2B表达受到多种分子机制的影响。研究显示,MALAT1和NEAT1可能作为基因表达调节因子参与大脑中的基因转录调控。NEAT1调节的基因涉及突触形成和轴突生长方向,可以影响突触可塑性,同时通过转录表达调控方式控制突触形成和维持突触的形状。NEAT1的敲低会抑制轴突伸长,而其过度表达则会促进这一过程。MALAT1和NEAT1是否通过参与NR2B表达调控来调节突触可塑性尚未见报道。本研究拟通过分析MALAT1和NEAT1在HPC小鼠海马细胞中的表达,探讨其与NR2B的表达及缺血缺氧后神经保护的关系,为进一步明确低氧或HPC的神经保护分子机制提供理论依据。
1 材料与方法
1.1 实验动物
雄性成年美国癌症研究所(Institute for Cancer Research,ICR)小鼠36只,平均体质量(20.3±2.2)g,均购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2020-0002,动物伦理号:BTMC2021-011。饲养条件:温度20~26℃、湿度为50%~60%,光照12h/d,自由取食和饮水。
1.2 细胞系
小鼠海马细胞系HT22购于中国医学科学院北京协和医学院细胞库。
1.3 主要试剂与仪器
1.3.1 主要试剂:总RNA抽提(total RNA extraction reagent, TRIzol)试剂(批号:391303)购于赛默飞世尔科技有限公司(美国),三氯甲烷(纯度≥99%,批号:20220402)、异丙醇(纯度≥99.7%,批号:20220710)购于上海凌峰化学试剂有限公司(中国),超敏化学发光底物(批号:4AD122421F)购于四正柏生物科技有限公司(中国),反转录试剂盒(批号:AN71036A)购于宝日医生物技术(北京)有限公司,实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)预混体系(批号:22361828)购于白鲨生物科技有限公司(中国),二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量测定试剂盒(批号:MA0082-2-nov-02I)购于大连博格林生物科技有限公司,谷氨酸受体2B抗体(批号:00125468)、血影蛋白抗体(批号:00130462)、活化的半胱氨酸蛋白酶蛋白3抗体(批号:00119399)、β-肌动蛋白(beta-actin,β-actin)抗体(批号:00104840)、辣根过氧化物酶标记山羊抗小鼠或兔二抗(批号:10027049)均购于武汉三鹰生物技术有限公司,聚偏二氟乙烯微孔膜(批号:69290400)购于罗氏诊断产品(上海)有限公司,高糖培养基(批号:GP22050210073)、磷酸盐缓冲液(批号:092222230120)、青霉素-链霉素双抗混合溶液(批号:KDHKT11)、细胞裂解液(批号:12B132)、绿色荧光染料(批号:XL0839461)、5%脱脂牛奶(批号:106873346)均购于上海碧云天生物技术有限公司,转染试剂(批号:2292261)购于美国生命技术有限公司(美国),十二烷基硫酸钠粉末(批号:J822BA0010)、甘氨酸(批号:J302BA0006)、30%聚丙烯酰胺(批号:J717KA0174)、过硫酸铵(批号:J624TA0183)均购于上海生工生物工程股份有限公司(中国),四甲基乙二胺(批号:C12293301)购于上海麦克林生化科技有限公司。
1.3.2 主要仪器:本研究中使用的主要仪器包括实时荧光定量PCR扩增仪(SLAN-96P;上海宏石医疗科技有限公司,中国)、125ml广口瓶(泰州市思齐教学仪器有限公司,中国)、眼科手术器械包(宿迁科沃医疗器械有限公司,中国)、Tanon化学发光仪(上海天能科技有限公司,中国)、倒置显微镜(TS2;尼康公司,日本)、小型蛋白电泳转印系统(1658001;BIO-RAD公司,美国)、细胞高内涵筛选系统成像设备(CellInsight CX7;赛默飞世尔科技有限公司,美国)。
1.4 方法
1.4.1 小鼠HPC模型的制作方法:将36只雄性ICR小鼠按照随机数字表法完全随机分为3组:对照组、低氧组和低氧预处理组,每组12只。将小鼠放入装有含21%O2空气、容量为125ml的广口瓶中,用橡皮塞密封;一旦出现喘式呼吸则打开橡皮塞,将小鼠从广口瓶转移至第2个装有含21%O2空气的广口瓶中,并立即再次密封。小鼠每次放入广口瓶密封至打开该广口瓶橡皮塞为1次低氧暴露。对照组小鼠不进行低氧暴露,低氧组小鼠低氧暴露1次,低氧预处理组小鼠低氧暴露4次。低氧处理结束后立即脱颈椎处死小鼠。将所有小鼠置于冰上利用眼科手术器械将小鼠的头皮剪开暴露头部,直镊拨开小鼠颅骨,暴露大脑皮质,直镊拨开大脑皮质,暴露海马组织,分针将海马组织与大脑皮质及周围的脑组织分开,小心地将海马组织分离后放置于冻存管中,分别进行标号后置于-80℃分组保存。本研究得到包头医学院动物实验伦理委员会审核批准(审批号:BTMC2021-011)。
1.4.2 HT22细胞培养、转染及氧糖剥夺-再灌注(oxygen - glucose deprived/ reoxygen,OGD/R):将HT22细胞培养于含10%胎牛血清和100U/ml青霉素-链霉素的培养基,细胞汇合率大于90%时将其转移至24孔板中培养后分2批进行处理。首先将第一批HT22细胞分为5组,分别为空白组、转染乱序小干扰核糖核酸(small interfering ribonucleic acid, siRNA)的阴性对照组、敲低MALAT1siRNA组(siMALAT1组)、敲低NEAT1siRNA组(siNEAT1组)、同时敲低MALAT1和NEAT1siRNA组(siMALAT1 + siNEAT1组),均为细胞汇合率大于70%时进行转染。空白组不做任何处理,siMALAT1组、siNEAT1组、siMALAT1 + siNEAT1组和阴性对照组则利用转染试剂分别将6pmol的siMALAT1、siNEAT1、siMALAT1 + siNEAT1和乱序siRNA分别一一对应转染至剩余4组细胞中。然后在正常条件下((5%CO2和95%空气)培养48h后收集细胞保存于-20℃以备进行后续实验。
将第2批HT22细胞分为6组,分别为阴性对照组、阴性对照+OGD/R组、siMALAT1组、siMALAT1+OGD/R组、siNEAT1组、siNEAT1+OGD/R组,当细胞汇合率大于70%时进行转染,利用转染试剂分别将6pmol的乱序siRNA、乱序siRNA、siMALAT1、siMALAT1、siNEAT1、siNEAT1一一对应转染至阴性对照组、阴性对照+OGD/R组、siMALAT1组、siMALAT1+OGD/R组、siNEAT1组、siNEAT1+OGD/R组的HT22细胞中,转染后48h将阴性对照组、siMALAT1组、siNEAT1组HT22细胞在正常条件下(5%CO2和95%空气)继续培养,将阴性对照+OGD/R组、siMALAT1 + OGD/R组、siNEAT1 + OGD/R组细胞进行OGD/R处理:换无血清、无糖培养基,并在低氧条件下(1%O2 + (5%CO2 + 94%N2)暴露8h,之后再进行正常条件下培养16h。然后同一时间收集6组处理细胞以备后续实验。
1.4.3 实时荧光定量PCR:将按照“1.4.2”部分描述处理后的两批HT22细胞,共11组细胞,每组取3×104个HT22细胞分别放入不同离心管中;将按照“1.4.1”部分描述处理后得到的3组小鼠(每组鼠数为6只)海马组织每组取50mg分别放入不同离心管中。采用TRIzol法提取各组细胞及海马组织的RNA,并使用反转录试剂盒按照说明书进行互补DNA合成。MALAT1、NEAT1、NR2B及细胞内参照物β-actin引物序列见表1,采用实时荧光定量PCR扩增仪通过SYBR绿色I核苷酸胶体染料(SYB RGreen I)法[21]进行实时荧光定量基因扩增,以β-actin作为参照物,采用2(-ΔΔCt)法分别计算各组大鼠MALAT1、NEAT1和NR2B的信使RNA(messenger RNA, mRNA)相对表达量。
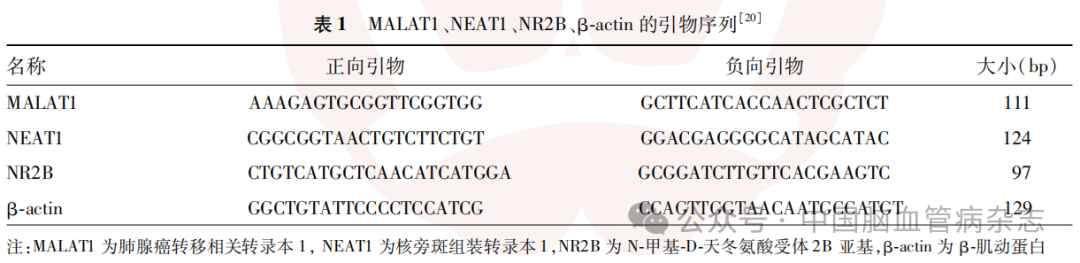
1.4.4 蛋白免疫印迹分析:将按照“1.4.2”部分描述处理后的两批HT22细胞,共11组细胞,每组取3×104个细胞分别放入不同离心管中;将按照“1.4.1”部分处理后得到的3组小鼠(每组鼠数为6只)海马组织每组取50mg分别放入不同离心管中。每个离心管中均加入300μl蛋白裂解液进行总蛋白分离,4℃条件下离心15min(12000r/min,离心半径10cm)后取上清液,采用BCA蛋白定量测定试剂盒测定蛋白质浓度并定量。取蛋白样品经10%浓度聚丙烯酰胺凝胶在30mA下分离蛋白质2.5h,然后将蛋白用湿转法转移至0.22μm聚偏二氟乙烯微孔膜上。在5%脱脂奶粉封闭清洗缓冲液中将膜分别与NR2B抗体(1∶1000)、血影蛋白抗体(1∶1000)、活化的半胱氨酸蛋白酶蛋白3抗体(1∶1000)、β-actin抗体(1∶1000)4℃孵育过夜,然后与辣根过氧化物酶标记山羊抗小鼠或兔二抗在(1∶10000)室温下孵育1h。然后使用超灵敏发光溶液进行蛋白显影,使用Tanon自动化学发光成像系统检测目的条带印迹。以上实验步骤重复进行6次,细胞为同一种细胞进行多次相同处理后所得,小鼠海马组织每次从按照“1.4.1”部分描述处理后的3组小鼠海马组织中随机不重复取不同小鼠的海马组织进行实验。
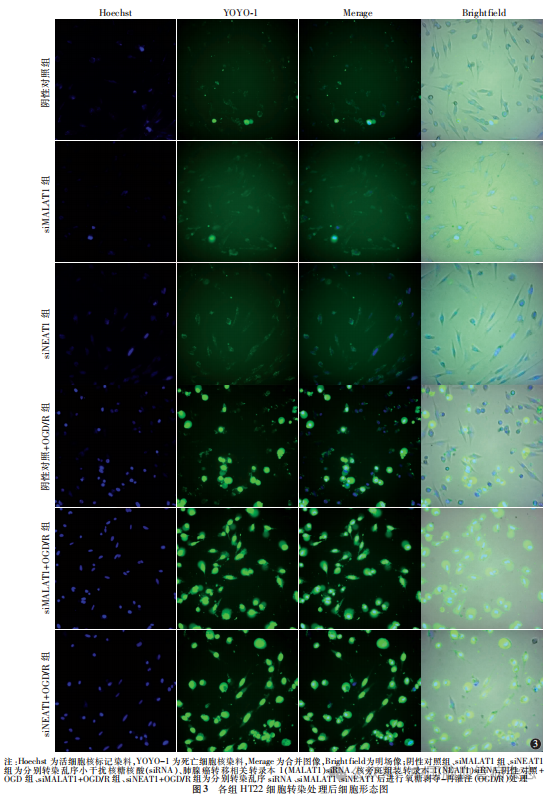
1.4.5 细胞存活率测定:使用细胞高内涵CellInsight CX7系统测量细胞存活率。将按照“1.4.2”部分描述处理的第二批HT22细胞,即阴性对照组、阴性对照+OGD/R组、siMALAT1组、siMALAT1 + OGD/R组、siNEAT1组、siNEAT1 + OGD/R组HT22细胞,通过20倍物镜获取图像,并从每个孔随机取9个视野图像,通过观察荧光染料穿过细胞膜的细胞染色情况,hoechst为活细胞核标记染料,显示为蓝色荧光,YOYO-1为死亡细胞核染料,显示为绿色荧光。细胞存活率=1-(死亡细胞数量/总细胞数量)。
1.5 统计学分析
采用SPSS25.0软件对所有实验数据进行统计学分析,采用Shapro-Wilk法对所有数据进行正态性分布检验,符合正态分布的计量资料以x-±s表示,组间比较采用双边t检验,多组间比较采用单因素方差分析,组间两两比较采用最小显著差异法(post least significant difference, LSD)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠MALAT1、NEAT1、NR2B的实时荧光定量PCR及蛋白免疫印迹检测结果
检测结果显示,3组小鼠海马中MALAT1(F=43.92)、NEAT1(F= 506.40)、NR2B mRNA(F=50.64)及NR2B蛋白(F=41.24)的相对表达量差异均有统计学意义(均P<0.05)。见表2。
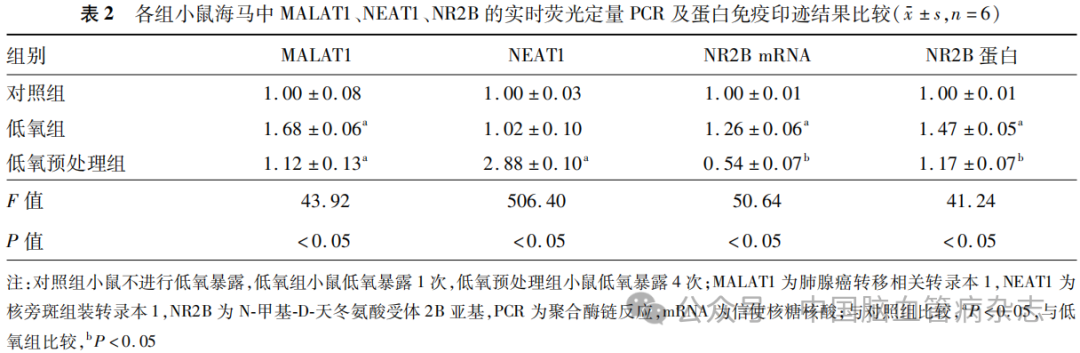
与对照组相比,低氧组MALAT1、NR2BmRNA及NR2B蛋白的相对表达量均增加(均P<0.05),而NEAT1的相对表达量组间差异无统计学意义(P>0.05);与对照组相比,低氧预处理组中MALAT1和NEAT1的相对表达量增加(均P<0.05)。与低氧组相比,低氧预处理组NR2B mRNA及NR2B蛋白的相对表达量降低(均P<0.05)。见表2。
2.2 各组HT22细胞转染处理后NR2B的实时荧光定量PCR及蛋白免疫印迹检测结果
检测结果显示,5组HT22细胞转染后NR2B mRNA(F=36.92)及NR2B蛋白(F=56.98)的相对表达量差异均有统计学意义(均P<0.05)。见表3,图1。
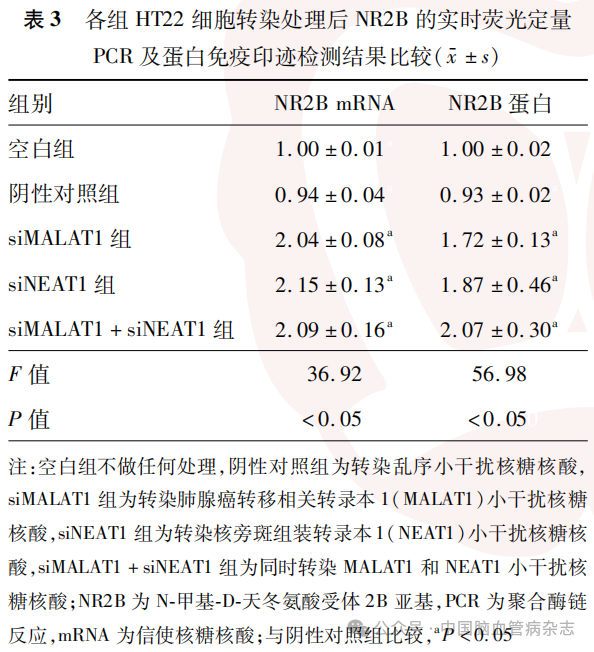
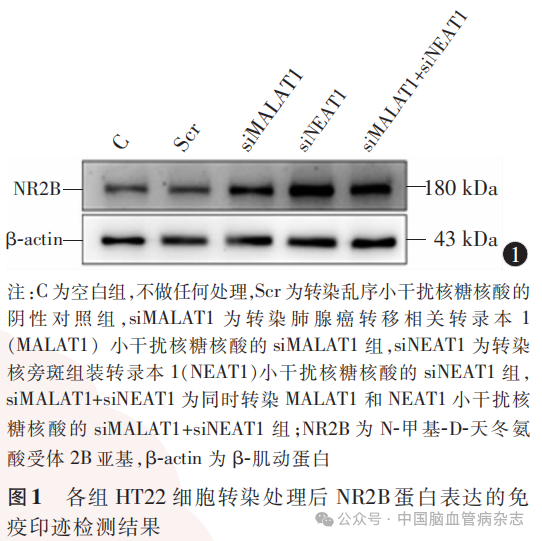
与阴性对照组相比,siMALAT1组、siNEAT1组、siMALAT1+siNEAT1组的NR2B mRNA及NR2B蛋白的相对表达量均增加(均P<0.05)。见表3,图1。
2.3 各组HT22细胞转染以及OGD/R后的血影蛋白、活化的半胱氨酸蛋白酶蛋白3蛋白表达的免疫印迹检测结果
检测结果显示,6组HT22细胞转染及OGD/R处理后血影蛋白分解产物(145/150 kDa蛋白;F=12.43)、血影蛋白分解产物(120 kDa蛋白;F=7.15)、活化的半胱氨酸蛋白酶蛋白3蛋白(F=6.61)的相对表达量差异均有统计学意义(均P<0.05)。见表4,图2。
与siMALAT1组比较,siMALAT1 + OGD/R组的145/150kDa、120kDa的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白相对表达量均增加(均P<0.05);与阴性对照+OGD/R组比较,siMALAT1 + OGD/R组的145/150kDa、120kDa的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白相对表达量均增加(均P<0.05);与siNEAT1组比较,siNEAT1 + OGD/R组的145/150kDa、120kDa的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白相对表达量均增加(均P<0.05)。见表4,图2。
2.4 各组HT22细胞转染处理后存活率检测结果
检测结果显示,6组HT22细胞存活率差异有统计学意义(F=5.54,P<0.05)。见表5。
与阴性对照组比较,siMALAT1组、siNEAT1组、siMALAT1 + OGD/R组及siNEAT1+OGD/R组HT22细胞存活率均降低(均P<0.05);与siMALAT1组比较,siMALAT1+OGD/R组细胞存活率降低(P<0.05);与siNEAT1组比较,siNEAT1 + OGD/R组细胞存活率降低(P<0.05)。见表5,图3。
3 讨论
HPC是通过将大脑反复短暂暴露于低氧或缺血条件下使大脑对随后的低氧或缺血性损伤具有一定耐受能力,HPC的神经保护机制涉及多种低氧或缺血耐受的分子过程,在此调节过程中自由基等有害的神经化学物质可被下调,而腺苷等有益的神经化学物质可被上调。既往研究表明,NEAT1和MALAT1是缺氧刺激后表达变化较为显著的2种lncRNA。Stone等的研究发现一种新的位于MALAT1和NEAT1的增强子核糖核酸,在乳腺癌细胞系中可上调MALAT1和NEAT1以应对缺氧缺血刺激。MALAT1和NEAT1可通过转录和转录后加工修饰等参与基因表达变化,同时MALAT1和NEAT1有助于神经细胞突触形成。NR2B在整个小鼠大脑中广泛表达,注射药物阻断NR2B的表达后,以五分制评估大鼠的神经功能缺损情况,结果显示,小鼠中脑动脉栓塞后的神经功能损伤可减轻。此外,研究显示,NR2B的表达受到多种分子的调节,例如脑源性神经营养因子、糖基化终末产物受体等。
本研究构建了小鼠的HPC模型,通过实时荧光定量PCR和蛋白免疫印迹法检测HPC处理后小鼠海马中MALAT1、NEAT1、NR2B的表达,结果显示,与对照组比较,低氧预处理组小鼠海马中MALAT1和NEAT1的相对表达量均明显上升(均P<0.05),表明对小鼠进行HPC可以提高其机体内MALAT1和NEAT1的表达以应对缺血缺氧刺激。与对照组相比,低氧组NR2B的mRNA及蛋白水平的相对表达量均增高(均P<0.05),而与低氧组比较,低氧预处理组NR2B的相对表达量有明显下降(P<0.05),表明HPC能够有效下调NR2B的表达。
既往研究表明,NR2B、MALAT1和NEAT1均参与了神经细胞突触可塑性[32],且在mRNA水平的基因表达调控中发挥关键调节作用[33-34]。此外,MALAT1和NEAT1都对低氧敏感,在低氧环境下可影响NR2B的表达[26]。本研究通过细胞转染处理敲低HT22细胞的MALAT1和NEAT1,NR2B的实时荧光定量PCR和蛋白免疫印迹法检测结果显示,与阴性对照组相比,siMALAT1组、siNEAT1组、siMALAT1+siNEAT1组的NR2B mRNA及NR2B蛋白的相对表达量均增加(均P<0.05),表明在HT22细胞中,NR2B的表达受到MALAT1和NEAT1的调控,且MALAT1和NEAT1表达可以抑制NR2B的表达,提示在HPC小鼠模型中观察到的NR2B水平下降可能与神经保护有关,并且可能与MALAT1和NEAT1表达的增加有关。
Heydari等对多种非编码RNA在缺血性卒中后神经保护的作用进行综述,认为近些年通过RNA-seq、深度测序和芯片等新技术,在缺血性卒中患者或缺血损伤动物模型中筛选出了多种异常表达的lncRNA,如细胞周期激酶抑制因子4、MALAT1、牛磺酸上调基因1等在脑缺血动物或氧糖剥夺细胞中的表达均有所增加,表明lncRNA与低氧或缺血条件下的神经保护密切相关。MALAT1可能通过调节血管生成分子来减轻缺血性脑损伤,沉默MALAT1会导致缺血性损伤的小鼠大脑中促细胞凋亡因子和促炎细胞因子上调从而加剧脑损伤。MALAT1启动子下有3个低氧反应元件,其中低氧诱导因子1α可以与MALAT1启动子结合,导致低氧条件下MALAT1的转录激活。Choudhry等研究表明,乳腺癌细胞系中NEAT1主要受低氧诱导因子2调节,NEAT1可减少OGD/R后的神经细胞凋亡。本研究中,HT22细胞通过转染敲低NEAT1和MALAT1,并构建了OGD/R模型,对血影蛋白、活化的半胱氨酸蛋白酶蛋白3蛋白进行实时荧光定量PCR和蛋白免疫印迹检测,结果显示,与siMALAT1组比较,siMALAT1 + OGD/R组的145/150 kDa、120 kDa的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白相对表达量均增加(均P<0.05);与阴性对照+OGD/R组比较,siMALAT1 + OGD/R组的145/150kDa、120kDa的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白相对表达量均增加(均P<0.05);与siNEAT1组比较,siNEAT1 + OGD/R组的145/150kDa、120kDa的血影蛋白分解产物及活化的半胱氨酸蛋白酶蛋白3蛋白相对表达量均增加(均P<0.05),提示HT22细胞OGD/R增加了细胞损伤。而细胞存活率检测结果显示,与siMALAT1组比较,siMALAT1 + OGD/R组细胞存活率降低(P<0.05);与siNEAT1组比较,siNEAT1 + OGD/R组细胞存活率降低(P<0.05),提示敲低MALAT1、NEAT1的HT22细胞在OGD/R后死亡增加,以上研究结果表明,MALAT1和NEAT1的上调可能是HPC诱导的内源机制调节的一部分,参与了OGD/R后神经保护。
综上所述,本研究结果表明,HPC增加了小鼠海马组织中MALAT1和NEAT1的表达,并降低了NR2B的表达。此外,MALAT1和NEAT1敲除降低了HT22细胞中NR2B的表达,提示MALAT1和NEAT1可能作为HPC诱导的关键分子通过下调NR2B来参与小鼠缺血缺氧后的神经保护作用。MALAT1和NEAT1调控NR2B的确切的分子机制尚不清楚,仍需要进一步深入研究阐明。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#神经保护# #长链非编码核糖核酸# #肺腺癌转移相关转录本1#
74