Lancet Haematol:NDMM中MRD驱动治疗的MASTER研究最终分析结果
2023-10-08 聊聊血液 聊聊血液 发表于上海
对于新诊断多发性骨髓瘤(NDMM)患者,与短期固定周期治疗相比,持续治疗直至进展或不耐受证实具有无进展生存期(PFS)和总生存期(OS)改善,已成为其管理的标准实践。
MRD驱动的NDMM治疗
对于新诊断多发性骨髓瘤(NDMM)患者,与短期固定周期治疗相比,持续治疗直至进展或不耐受证实具有无进展生存期(PFS)和总生存期(OS)改善,已成为其管理的标准实践。然而治疗的发展对所有NDMM患者均普遍使用来那度胺维持治疗直至疾病进展的理念提出了挑战,尤其是适合更强化治疗(包括自体HSCT)的患者;蛋白酶体抑制剂、免疫调节剂和地塞米松的三联诱导治疗改善了总体结局,且在三联方案中加入抗 CD38 单抗可增加PFS。在CASSIOPEIA 研究中,达雷妥尤单抗维持治疗2年也使既往未接受过达雷妥尤单抗治疗的患者的复发或死亡风险降低了近70%,但对接受达雷妥尤单抗过诱导和巩固治疗的患者无明显影响;该观察结果不仅强调了接受四联诱导和巩固治疗但无维持治疗的患者可获得有利结局,还说明维持治疗的效果受到诱导和巩固治疗的影响。
对于NDMM患者,治疗后达到微小残留病 (MRD) 阴性与预后改善相关,三联或四联治疗和自体 HSCT 后达到 MRD 阴性的患者即使未接受无限期维持治疗,结局也极佳;然而使用 MRD 驱动治疗方面仍存在不确定性。近日《The Lancet Haematology》报道了达雷妥尤单抗、卡非佐米、来那度胺和地塞米松 (Dara-KRd) 治疗NDMM患者的 MASTER研究的最终分析,其中 MRD 状态用于调整治疗持续时间和停药。

研究方法
MASTER 研究是在美国5家中心开展的一项多中心、单臂、2期研究,纳入≥18岁NDMM患者(通过血清或尿蛋白电泳或血清游离轻链可测量),预期寿命至少12个月,东部肿瘤协作组体能状态(ECOG PS)为0-2,既往未接受过多发性骨髓瘤治疗(但最多1个周期的含硼替佐米、环磷酰胺和地塞米松的治疗除外)。该研究富集了高危细胞遗传学异常 (HRCA)患者。
诱导治疗期患者接受4个周期(即1-4周期,每个周期28天)的 Dara-KRd 治疗,每个周期包括达雷妥尤单抗(第1、8、15和22天 16 mg/kg 静脉给药)、卡非佐米(第1、8和15天56 mg/m²静脉给药)、来那度胺(第1-21天 25 mg 口服给药)和地塞米松(第1、8、15和22天 40 mg 口服或静脉给药);诱导后进行自体造血干细胞移植,并给予Dara-KRd 进行两轮巩固治疗(每轮为4疗程,即5-8和9-12周期)。
每个治疗阶段之后或期间使用clonoSEQ通过二代测序(NGS)评估MRD,主要终点为达到 MRD 阴性 (<10-5);分别在诱导治疗后(自体移植前)、自体移植后60~80天、两轮巩固治疗的第二疗程后(即第6周期和第10周期)分别检测MRD。在两个连续治疗阶段后或期间达到 MRD 阴性的患者停止治疗并开始 MRD 监测(MRD-SURE组);而未达到两个连续 MRD 阴性结果的患者接受来那度胺维持治疗。次要终点包括PFS和进展的累积发生率。
研究结果
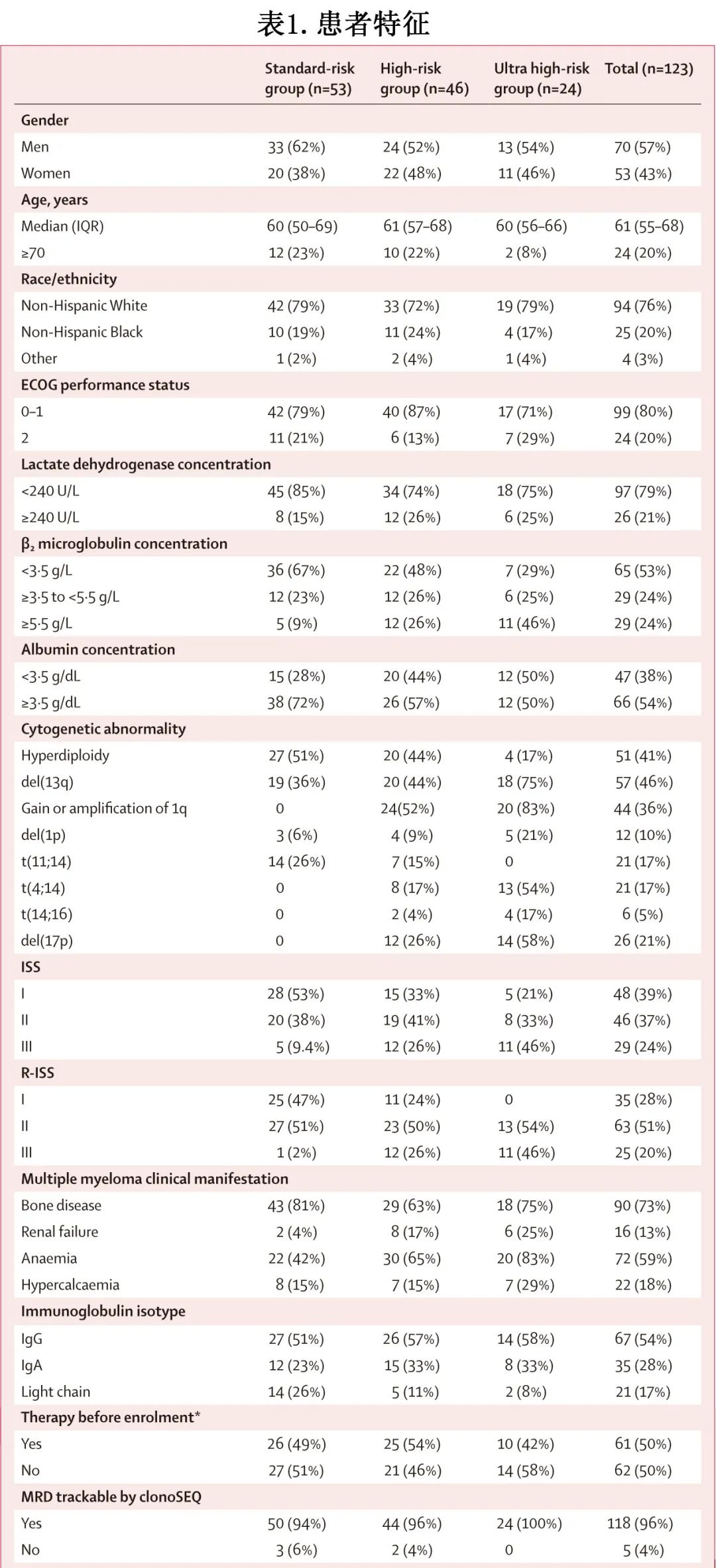
123例患者接受治疗,其中70例 (57%) 为男性,53例 (43%) 为女性,94例 (76%) 为非西班牙裔白人,25例 (20%) 为非西班牙裔黑人,4例 (3%) 为其他人种或种族。中位年龄为61岁,24例 (20%) 的年龄≥70岁(表1)。中位随访42.2个月。123例患者中53例 (43%) 无HRCA(标危),46例 (37%) 有1个HRCA(高危),24例 (20%) 有≥2个HRCA(超高危)。其中118例 (96%) 患者可clonoSEQ评估MRD,其中96例 (81%) 在治疗期间的任何时间点达到MRD<10-5,包括50例标危患者中的39例 (78%)、44例高危患者中的38例 (86%) 和24例超高危患者中的19例 (79%)。
总体而言,118例患者中有85例 (72%) 达到完全缓解伴MRD<10-5,包括50例标危患者中的38例 (76%)、44例高危中的33例 (75%) 和24例超高危患者中的14例 (58%)。在118例可评估 MRD 的患者中,84例 (71%,62-79) 达到 MRD<10-6,包括50例标危中的34例 (68%)、44例高危患者中的35例 (80%) 和24例超高危中的15例 (63%)。
118例患者中有84例 (71%) 符合 MRD-SURE 标准并进入方案指导的观察和 MRD 监测,24例 (20%) 继续接受标准来那度胺维持治疗(图1);其余10例 (8%) 提前中止治疗:3例死亡,5例因疾病进展中止,2例因患者选择中止;无患者因毒性而中止治疗。MRD-SURE组包括50例标危患者中的33例 (66%)、44例高危患者中的36例 (82%) 和24例超高危患者中的15例(63%);分别有32例 (64%)、32例 (73%) 和11例 (46%) 观察到持续 MRD 阴性。
中位随访42.2个月:标危患者为43.7个月,高危患者为42.1个月,超高危为35.4个月 (26.1–43.4)。所有患者的中位治疗持续时间为11.6个月,符合 MRD-SURE 标准的患者为11.2个月。在连续2次 MRD 评估<10-5并转为 MRD-SURE 的84例患者中,完成治疗并进入 MRD-SURE 后的中位随访时间为32.7个月。
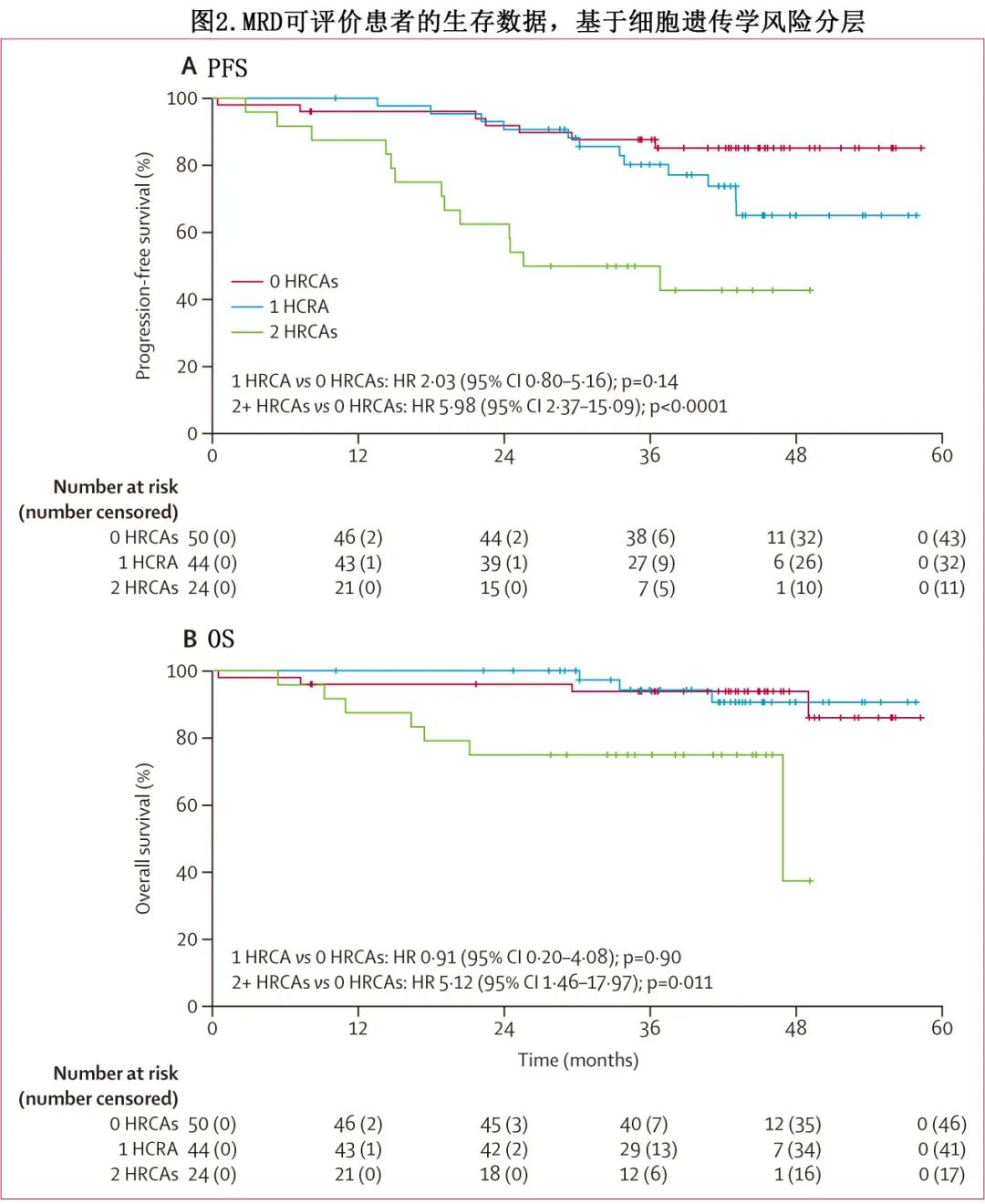
所有123例患者中记录了33例PFS事件(死亡或疾病进展)。标危患者的36个月PFS率为88%,高危患者为79%,超高危患者为50%。6例患者在接受方案指导治疗期间发生疾病进展:1例在诱导期间,1例在自体 HSCT 后和巩固前,4例在巩固期间;所有6例患者均携带1q gain或amplification,5例携带del(17p),5例有≥2个HRCA,均在初始进展后1.3个月至10.8个月死于疾病进展或后续治疗并发症。
123例患者中15例死亡,标危患者36个月OS率为94%,高危患者为92%,超高危患者为75%。3例患者在方案指导的治疗期间死亡(2例猝死,1例死于偏肺病毒性肺炎;均判定为与治疗无关),3例患者在治疗后和接受 MRD-SURE 期间死亡,无疾病进展(1例猝死,1例死于 COVID-19 肺炎,1例死于意外跌倒)。9例患者死于多发性骨髓瘤进展:6例在接受方案指导的治疗期间骨髓瘤进展,3例在治疗完成后疾病进展。
118例可评估 MRD 的患者中发生32例PFS事件。标危患者的36个月PFS率为88%,高危患者为80%,超高危为50%(图2A);记录了14例死亡, 36个月OS率分别为94%、94%和75%(图2B)。
大多数MRD相关的文献表明,对于接受相同治疗的患者队列,在特定里程碑(milestone)时间点未达到 MRD 阴性与PFS和OS较差相关。作者评估了在特定里程碑时未达到 MRD 阴性的患者中,是否可以通过使用 MRD 调整治疗和随后的强化治疗来改变相关结局。在诱导治疗结束时开始的里程碑分析发现,MRD阳性 (≥10-5) 的持续存在不影响PFS和OS,自体 HSCT 后的里程碑分析产生了相似的结果,且在10-6阈值下分析 MRD 时仍获得相似结果。
作者进行了事后探索性分析以研究持续 MRD 阴性对PFS的影响,118例患者中75例 (64%)达到持续 MRD 阴性,其36个月PFS率为89%,而43例 (36%) 未达到持续 MRD 阴性的患者为55%。多发性骨髓瘤中18个月内进展是预后的不良预测因素,相当于滤泡性淋巴瘤的POD24,作者在一项里程碑分析中纳入了入组后18个月时存活且无疾病进展的所有106例患者,持续 MRD 阴性患者的36个月PFS率为89%(n=75),而未持续 MRD 阴性患者为70%(n=31)。后续分析表明,持续 MRD 阴性<10-5的患者预后优于同时持续MRD<10-6的患者。
对于转入 MRD-SURE 的84例患者,标危、高危、超高危患者36个月PFS率分别为88%、85%和60%(图3A);36个月OS率分别为97%、93%和100%(图3B)。在从停止治疗开始的里程碑分析中,标危、高危、超高危患者24个月PFS率分别为88%、85%和53%(图3C);24个月OS率分别为97%、93%和100%(图3D)。
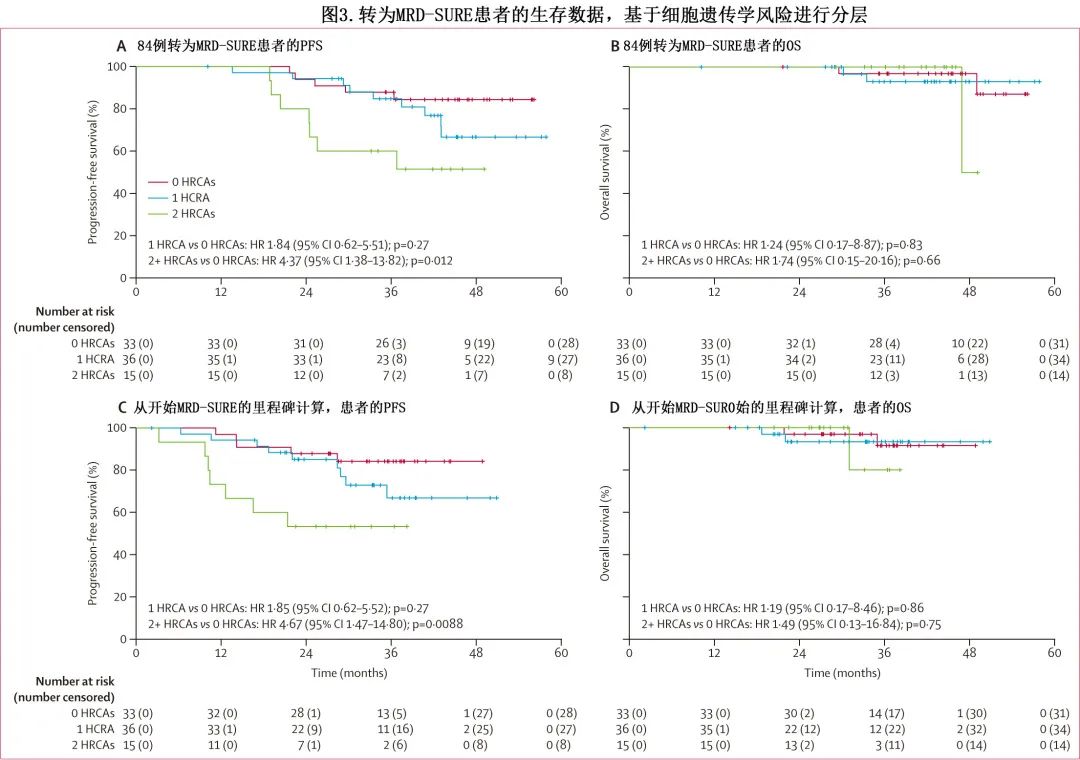
在转至 MRD-SURE 的84例患者中,23例 (27%) 由于 MRD 复发 (n=7) 或疾病进展(未发生 MRD 复发)(n=16) 而恢复治疗;61例患者(占 MRD 可评估的118例患者的52%,占转至 MRD-SURE 的84例患者的73%)未接受进一步抗骨髓瘤治疗。尤其值得注意的是,24个月时,标危患者的疾病进展或 MRD累积复发率(既往无疾病进展的死亡作为竞争事件处理)为9%,高危患者为14%,超高危患者为60%;累积进展率分别为9%、9%和47%。
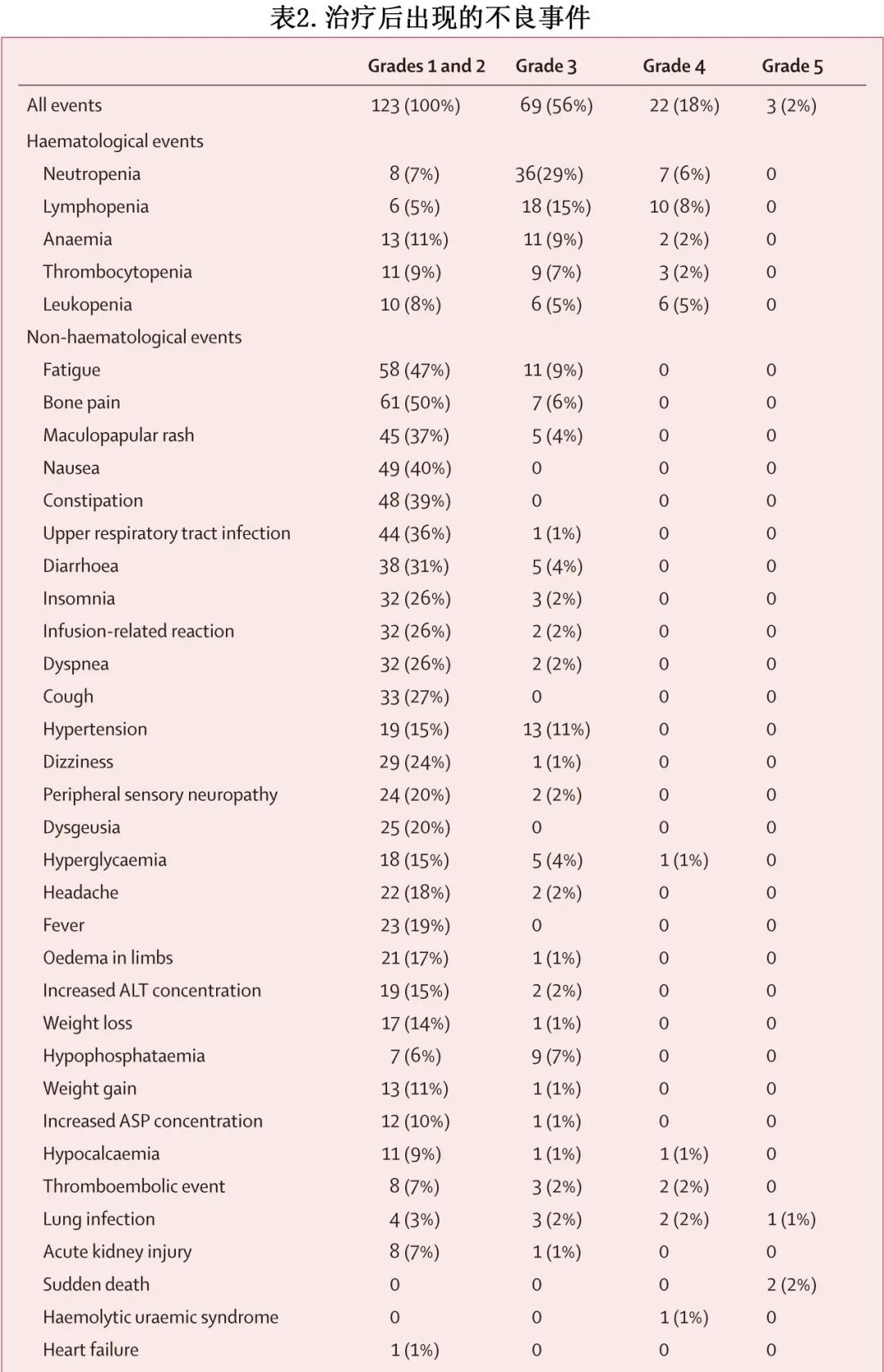
最常见的治疗后出现的不良事件为疲乏、骨痛、中性粒细胞减少和皮疹(表2)。最常见的治疗后出现的严重不良事件为肺炎 (n=8) 和血栓栓塞事件 (n=3)。1例患者在接受来那度胺维持治疗(非方案规定的治疗)期间发生转移性结肠腺癌。无其他患者发生继发性恶性肿瘤。
总结
本研究招募了123例患者,其中70例 (57%) 为男性,53例 (43%) 为女性,94例 (76%) 为非西班牙裔白人,25例 (20%) 为非西班牙裔黑人,4例 (3%) 为其他人种或种族。患者的中位年龄为61岁,24例 (20%) 年龄为≥70岁。中位随访42.2个月。在123例患者中,53例 (43%) 无HRCA(标危),46例 (37%) 有1个HRCA(高危),24例 (20%) 有≥2个HRCA(超高危)。123例患者中的118例 (96%)可通过二代测序评估MRD,其中96例 (81%) 达到MRD <10-5(包括50例标危患者中的39例 [78%]、44例高危患者中的38例 [86%] 和24例超高危患者中的19例 [79%])、84例(71%)达到 MRD-SURE 并停止治疗。在所有123例患者中,标危、高危、超高危患者的36个月PFS率分别为88%、79%、50%。对于达到 MRD-SURE 的84例患者,从停止治疗计算的24个月累积进展率,标危、高危、超高危患者分别为9%、9%、47%。截至末次随访,61例患者(包括118例 MRD 可评估患者中的52%及84例达到 MRD-SURE 的患者中的73%)仍无治疗且维持 MRD 阴性。最常见的3-4级不良事件为中性粒细胞减少(43例患者,35%)、淋巴细胞减少(28例患者,23%)和高血压(13例患者,11%)。记录了3例治疗后出现的死亡:2例猝死和1例由于病毒感染,均判定为与治疗无关。
MASTER研究是涉及MRD驱动治疗NDMM患者的首批多中心研究之一。该长期(中位随访时间为42.2个月,而最初发表的结果为23.8个月)和最终分析显示,在超过95%的患者中使用 NGS 的 MRD 信息调整治疗方案是可行的,并为特定患者亚组提供了长期结局。Dara-KRd 诱导治疗后进行自体HSCT、MRD引导的移植后巩固治疗和治疗停止,可使大多数NDMM患者达到无MRD、无治疗状态,且疾病进展风险较低,该研究为大多数NDMM患者提供了积极的结局和治疗停止的途径。但该方案对于超高危多发性骨髓瘤患者(定义为具有≥2个 HRCA)并非最佳,这些患者应该优先进行临床试验,探索早期引入 T 细胞重定向治疗和具有新作用机制的药物。
专家点评
杂志同期发表芝加哥大学Benjamin A Derman教授的点评,他认为二代测序 (NGS) 是多发性骨髓瘤患者 MRD 评估中最敏感的检测方法之一,检测限达到10-6(即每100万个分析细胞中有一个骨髓瘤细胞)。多发性骨髓瘤 MRD 检测的进展使我们能够对超出国际骨髓瘤工作组常规缓解标准的缓解进行分类,无论疾病背景、细胞遗传学风险、MRD检测或 MRD 敏感性阈值如何,MRD阴性均与更优的无进展生存期和总生存期相关。虽然达到完全缓解曾经是一个重要的有利预后因素,但当检测 MRD 时,根据常规缓解未观察到无进展生存期或总生存期的差异。高危疾病特征和 MRD 状态已被确定为多发性骨髓瘤的有力预后工具,但尚未证实可作为治疗决策的指导。
而MASTER研究将高危疾病、MRD和免疫治疗为基础的四联治疗的概念结合在一起,其目标是消除MRD,而非接受其存在。
Derman教授认为,MASTER 研究强调了关于 MRD 和 HRCA 的三点问题。首先,在四联治疗和自体 HSCT 时代,伴1个 HRCA多发性骨髓瘤的预后可能并非大家认为的那样差;GRIFFIN研究使用类似的四联方案(D-RVD)联合自体 HSCT 也证实了这一点。第二,对于无 HRCA 或1个 HRCA 的患者,此处使用的积极地、 MRD 驱动的降级策略可能是一种合理的方法,但似乎不适合有≥2个 HRCA 的患者。第三,对于持续性 MRD 阳性患者,延长治疗时间的 MRD 驱动治疗有助于克服不良预后,表现为按 MRD 状态分层时患者结局相似。总的来说,具有≥2个 HRCA 的超高危患者的治疗仍然是未满足的需求,尽管 OPTIMUM/MUKnine 研究(为该类患者分配了扩展治疗)的令人鼓舞的结果提供了一定希望。
在 MRD 监测中对患者进行长期随访,对于确定是否应建议快速停止治疗以及某些患者是否能够真正治愈多发性骨髓瘤至关重要。MRD 阴性可能是无疾病的指标,但本研究中部分 MRD 阴性患者仍出现复发,这令人困惑;原因可能是根据监管指南使用了比检测阈值高10倍的 MRD 决策阈值,间隔约4个月的连续2次MRD 阴性结果(阈值为10–5)触发治疗停止。此外,在确保持久缓解方面,持续 MRD 阴性(国际骨髓瘤工作组将其定义为至少间隔12个月的连续两次 MRD 阴性)比较短时间间隔内 MRD 阴性更为重要。MRD 检测的深度也很重要,因为 MRD 敏感性的对数倍数改善与无进展生存期改善和可能的总生存期改善相关;这一发现得到了 MASTER研究的支持,该研究发现,MRD持续阴性 (10–6) 与无进展生存期改善相关,但 MRD 持续阴性 (10–5) 与无进展生存期改善无关。MASTER 研究的结果表明,维持 MRD<10–6可能最适合作为治疗中止前后的目标,以确保持久缓解并创建治愈的路径。
参考文献
1. Costa LJ,et al.Minimal residual disease response-adapted therapy in newly diagnosed multiple myeloma (MASTER): final report of the multicentre, single-arm, phase 2 trial.Lancet Haematol . 2023 Sep 27:S2352-3026(23)00236-3. doi: 10.1016/S2352-3026(23)00236-3.
2. Derman BA,et al.MRD-guided treatment cessation in multiple myeloma.Lancet Haematol . 2023 Sep 27:S2352-3026(23)00240-5. doi: 10.1016/S2352-3026(23)00240-5.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言