恒定自然杀伤T(iNKT)细胞通过FcγRII (CD32)途径杀伤CD1d阴性的肿瘤细胞
2024-11-22 《基因启明》公众号 《基因启明》公众号 发表于上海
这篇研究揭示了单克隆抗体能够调节体内iNKT细胞活性,增强抗肿瘤功效,最终直接靶向并杀死多种类的肿瘤细胞。随着近年来iNKT细胞疗法的大热,相信在不久的将来,癌症必将不再无药可解!
亮点
1、iNKT细胞依赖自身分泌的抗体(Vα24-Jα18抗体)杀伤CD1d阴性的慢性髓系白血病细胞(K562):CD107a+ iNKT细胞数量增加近5倍,并产生大量细胞因子(如IFNγ和TNFα)杀伤CD1d阴性的肿瘤细胞,这一过程依赖FcγRII (CD32)的介导。
2、细胞培养基中添加6B11 mAb(Vα24-Jα18抗体)能够加强iNKT细胞对CD1d阴性的肿瘤细胞的杀伤能力;但是6B11 mAb结合后的iNKT细胞并不会杀伤FcγRII (CD32)高表达的正常细胞。
3、动物水平上,接受6B11 mAb注射的小鼠肿瘤生长得到抑制,平均肿瘤重量显著降低,说明6B11 mAb增强了iNKT细胞的抗肿瘤能力。
恒定自然杀伤T(iNKT)细胞属于异源性自然杀伤T (NKT) 细胞群,具有T细胞和自然杀伤 (NK) 细胞的特性,有助于衔接先天和适应性免疫反应。众所周知, iNKT细胞是CD1d限制性T淋巴细胞,可利用恒定的T细胞受体 (TCR,人类Vα24和Vβ11,小鼠Vα14、Vβ8.2、Vβ2和Vβ7)识别特定的脂质抗原,其细胞因子的产生有助于确定免疫反应的进程。iNKT细胞由于其强大的抗肿瘤功效,目前已成为免疫治疗的热点。
普遍研究认为,iNKT细胞能够识别和响应糖脂抗原α-半乳糖基神经酰胺(α-GalCer),产生大量细胞因子(如 IFNγ 和 TNFα),并产生颗粒酶和穿孔素,最终发挥细胞毒性。然而,iNKT 细胞是否能够直接识别并杀死肿瘤靶细胞仍未可知。
近期,一项题为Anti-Vα24Jα18 TCR antibody tunes iNKT cell updates responses to target and kill CD1d-negative tumors in an FcγRII (CD32)-dependent manner的研究表明,Vα24-Jα18 TCR抗体(6B11 mAb)可使iNKT细胞以CD32依赖性方式,对肿瘤细胞产生毒性;此外,6B11 mAb处理的iNKT细胞能够在体内抑制小鼠肿瘤生长、降低平均肿瘤重量。该单克隆抗体疗法有望为多种癌症疾病的治愈提供策略。

首先,研究人员选取了白血病细胞系K562(细胞表面不表达CD1d),发现在不存在CD1d的情况下,iNKT细胞仍可对肿瘤细胞产生毒性。那么,iNKT细胞对肿瘤的直接杀伤作用究竟是因何而起的呢?他们分离了iNKT细胞培养上清液,以除去iNKT细胞产生的可溶性因子,随后将细胞在新鲜培养基中再次培养2天。
令人惊讶的是,与未换培养基的对照组相比,实验组CD107a+细胞数量急剧减少(CD107a的表达可以直接反映NK细胞脱颗粒过程,从而反映其杀伤功能),细胞毒性更低;当研究人员将具有可溶性因子的上清液再次与iNKT细胞共培养后,CD107+ iNKT细胞数量竟增加至53%(对照组仅为11.5%),说明iNKT细胞恢复了较高的脱颗粒活性。
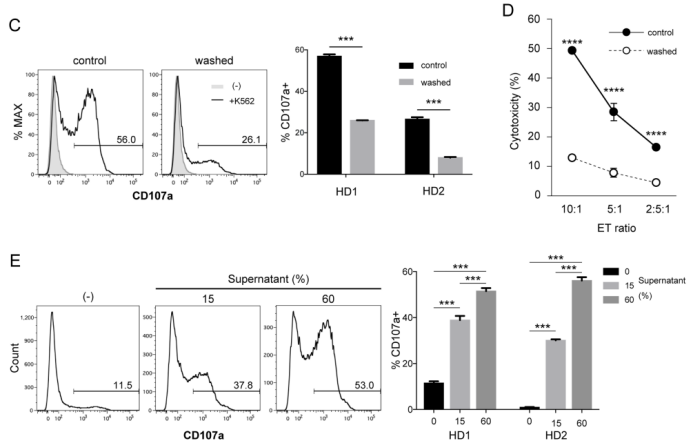
iNKT细胞培养物中的可溶性因子介导iNKT细胞的杀伤力
那么,上清液中的可溶性因子是什么呢?
研究人员发现当上清液中缺失Vα24 mAb时,iNKT细胞失去了对K562细胞脱颗粒的能力,而当可识别Vα24的抗体(6B11 mAb)被再次补加入培养基后,CD107a在iNKT细胞表面的表达以剂量依赖性方式增加,iNKT细胞表现出很强的细胞毒性,并产生了大量针对K562细胞的抗肿瘤因子IFNγ和TNFα。有趣的是,6B11 mAb介导的细胞毒性并不仅针对于K562,其他肿瘤细胞系的结果依旧证明了,iNKT细胞以抗体靶向TCR复合物的方式杀伤肿瘤。
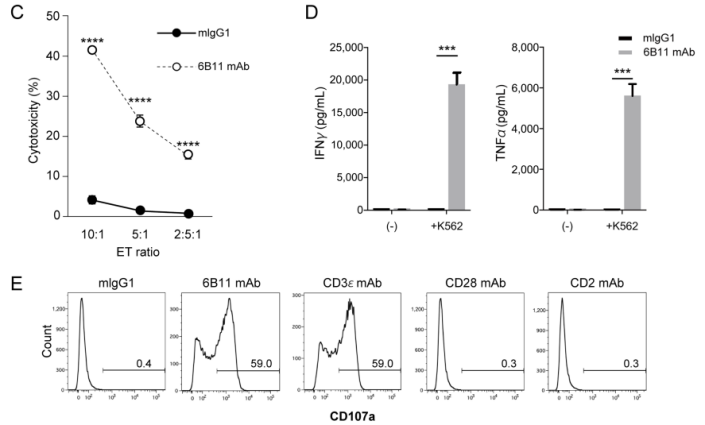
6B11 mAb可诱导iNKT细胞对K562细胞的脱颗粒
接下来一个疑问产生了,6B11 mAb诱导的iNKT细胞毒性机制是什么呢?
他们发现K562细胞的FC受体CD32是iNKT细胞发挥作用的关键。当iNKT细胞在抗CD32 mAb存在下与K562细胞共培养时,CD107a+ iNKT细胞数量从52.8% 显著下降到1.8%,表明iNKT细胞的脱颗粒依赖于CD32;除此之外,NK细胞激活受体(如NKG2D、DNAM1和2B4)以及共刺激分子LFA-1和LFA-2也参与了这一过程。
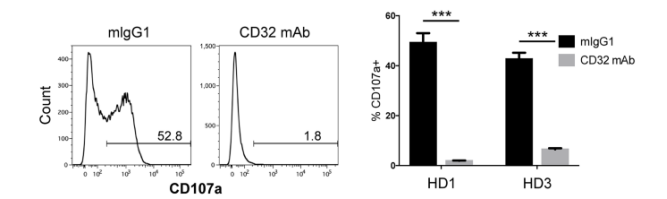
6B11 mAb处理以CD32依赖性方式诱导iNKT细胞对K562细胞的脱颗粒
巧合的是,除原发性肿瘤细胞外,正常的免疫细胞也表达CD32。iNKT细胞是否会“无差别攻击”正常细胞呢?有趣的是,当6B11 mAb结合的iNKT细胞与单核细胞、B细胞和中性粒细胞共培养时,几乎检测不到CD107a+ iNKT细胞,这表明6B11 mAb处理下,iNKT细胞的脱靶效应极小,不会伤害正常细胞。
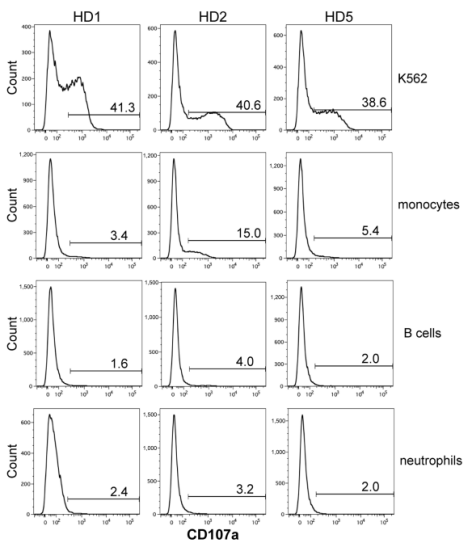
表达CD32的正常细胞不会引发iNKT细胞脱颗粒
俗话说“试验见真招”,研究人员采用hIL7 × hIL15 KI NSG小鼠(一种缺乏功能性免疫细胞的小鼠,对其持续供应人源IL7/IL15,从而使小鼠体内仅有iNKT细胞发挥免疫功能)以评估iNKT细胞对体内K562肿瘤细胞的直接影响。与对照组小鼠相比,接受6B11 mAb注射的小鼠肿瘤生长得到了抑制,平均肿瘤重量显著降低,表明6B11 mAb处理增强了iNKT细胞的抗肿瘤能力。
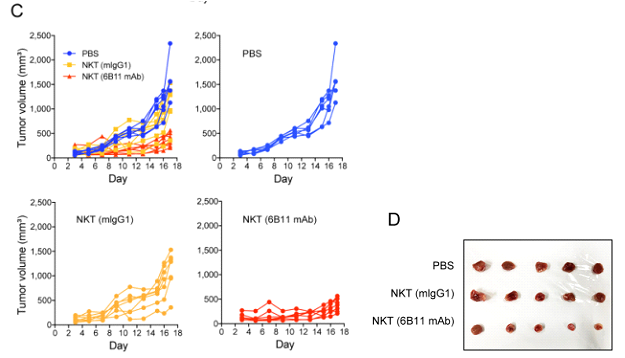
6B11 mAb增强了iNKT细胞的体内抗肿瘤能力
综上,这篇研究揭示了单克隆抗体能够调节体内iNKT细胞活性,增强抗肿瘤功效,最终直接靶向并杀死多种类的肿瘤细胞。随着近年来iNKT细胞疗法的大热,相信在不久的将来,癌症必将不再无药可解!
来源:
微信公众号: 基因启明
参考文献:
Takami M, Aoki T, Nishimura K, Tanaka H, Onodera A, Motohashi S. Anti-Vα24Jα18 TCR Antibody Tunes iNKT Cell Responses to Target and Kill CD1d-negative Tumors in an FcγRII (CD32)-dependent Manner. Cancer Res Commun. 2024 Feb 19;4(2):446-459. doi: 10.1158/2767-9764.CRC-23-0203. PMID: 38319156; PMCID: PMC10875981.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#iNKT细胞#
30