读书报告 | 低剂量放疗联合免疫治疗小细胞肺癌的临床前研究与II期临床试验
2024-10-22 iCombo iCombo 发表于上海
研究探讨低剂量放疗联合免疫治疗广泛期小细胞肺癌机制,包括临床前研究及临床试验,展示新治疗模式潜力。
导读
小细胞肺癌(SCLC)是一种具有高侵袭性和预后不良的恶性肿瘤,SCLC约占所有肺癌的15%,其中大约三分之二在诊断时已为广泛期(ES-SCLC)。SCLC的特点是高度侵袭性和预后差,现有的一线化疗联合免疫检查点抑制剂虽然取得了一定的成果,但对总体生存期的改善有限;另外ICIs在复发SCLC患者中的疗效也不佳。因此,研究人员迫切需要开发新的治疗策略,以提高SCLC患者的治疗效果和生存期。
放疗(RT)在许多实体瘤的治疗中扮演重要角色,但在ES-SCLC中,过去30年中这一治疗手段的地位相对较低,例如NCCN指南除了一线化疗后±辅助放疗外,没有对放疗作更多的推荐。然而目前随着免疫治疗的兴起,低剂量放疗(LDRT)被认为可以作为免疫佐剂,增强免疫疗法的效果,但其与ICIs的最佳联合剂量、分割方案和潜在机制在SCLC中尚不明确。
四川大学华西医院卢铀教授课题组从广泛期小细胞肺癌肿瘤微环境的角度出发探讨了低剂量放疗联合免疫治疗的机制,并利用一个II期单臂的临床试验对这一治疗策略在ES-SCLC应用的可行性及安全性进行了验证(Med. 2024 Jul 2:S2666-6340(24)00248-4.doi: 10.1016/j.medj.2024.06.002)。
研究设计
这篇文章总体分为两个部分,第一部分是临床前研究,通过荷瘤小鼠模型评估LDRT与ICIs联用的疗效,并从肿瘤微环境的角度,讨论LDRT联合ICIs的机制;第二部分是一项多中心二期前瞻性临床研究,评估同步胸部LDRT加化疗免疫疗法对未经治疗的ES-SCLC患者的疗效和安全性。主要终点是客观反应率(ORR),次要终点包括无进展生存期(PFS)和安全性。
太长不看版结果梳理(基础研究部分)
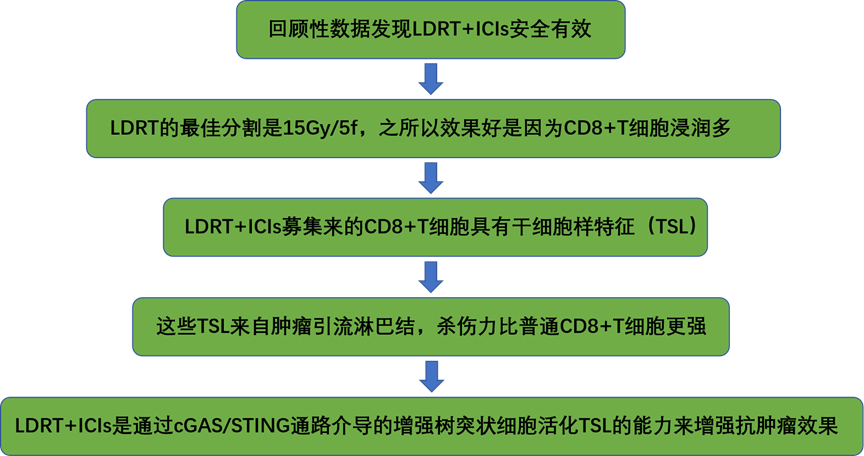
完整版结果
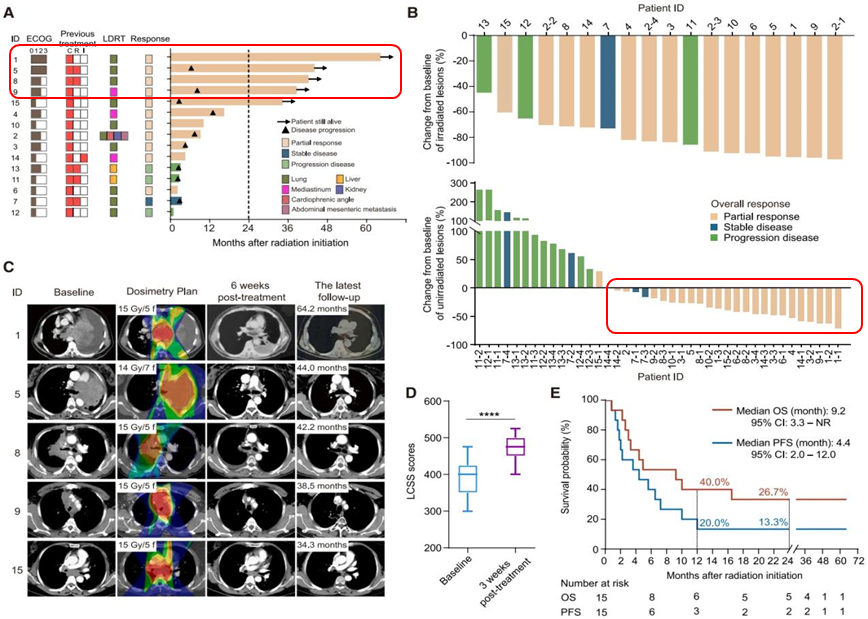
1. LDRT + ICI治疗难治性SCLC患者的初步探索
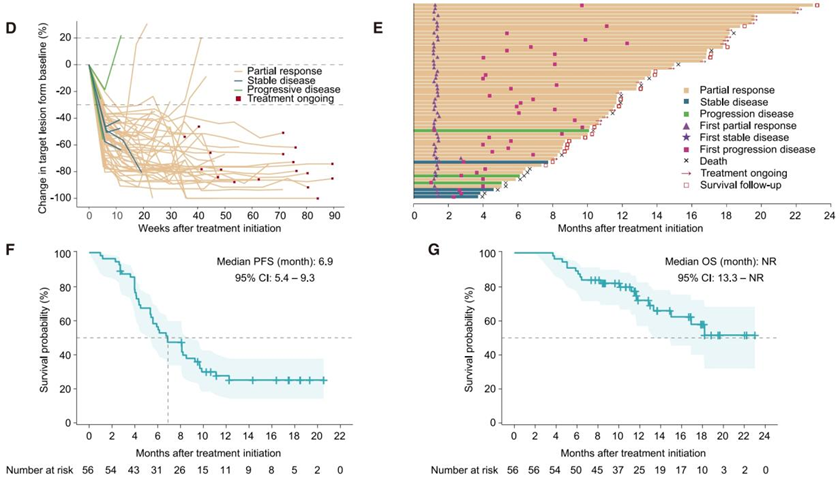
研究者首先从临床现象出发,通过分析15例LDRT + ICIs的数据,研究者发现有部分患者获得了长生存,尤其是其中还有数个ECOG 2~3分的病人,我们可以看到大部分病人既往都没接受过ICIs治疗,大部分患者都获得了PR,通过Figure 1B的瀑布图,我们可以看到每个患者的肿瘤负荷从基线变化的百分比,上面是射野内,下面是射野外病灶,射野外也有>50%的病灶退缩。Figure 1C提供了其中五位存活患者的代表性CT图像和辐射剂量分布。另外通过Figure 1D的肺癌症状量表,我们可以看到LDRT加ICI改善了患者的生活质量。最后,研究者还展示了所有患者的无进展生存期(PFS,蓝色)和总生存期(OS,红色)。
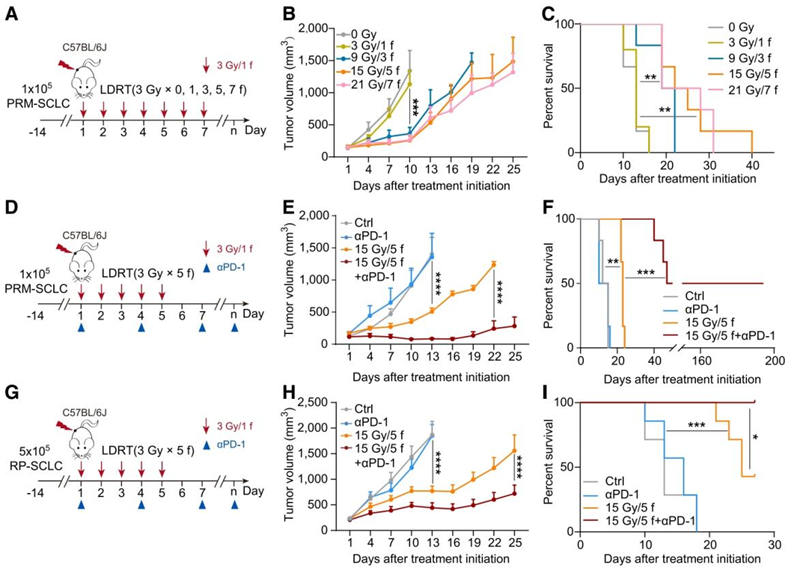
2. LDRT 15Gy/5f是最佳分割方式,与ICIs协同诱导小鼠免疫应答
A-C:研究者首先在荷瘤小鼠进行了剂量递增实验,观察到随着辐射剂量的增加,肿瘤生长得到了更好的控制,生存率也相应提高。特别是15 Gy/5次分割的方案,在小鼠模型中显示出了最佳的治疗效果。D-I:接着研究者在原发和复发肿瘤的小鼠模型中测试了LDRT与ICIs联合使用的效果。从肿瘤生长曲线和生存曲线清楚地表明,联合治疗组相比单独使用LDRT或ICIs的组别,展现出了显著的肿瘤控制和生存期延长。
然后研究者通过流式细胞术揭示了LDRT与ICIs联合治疗增加了肿瘤中的CD3+ CD8+ T细胞和CD8+ IFN-g+ 细胞毒性T细胞(CTLs)的比例,这些免疫细胞的增加与肿瘤的消退密切相关,并且无论在原发还是复发肿瘤中都存在这样的现象。
研究者进一步通过免疫荧光染色和单细胞RNA测序(scRNA-seq)进一步证实了LDRT与ICIs联合治疗在肿瘤微环境中诱导了免疫应答,特别是增加了CD8+ T细胞的比例,这些细胞在抗肿瘤免疫中起着关键作用。
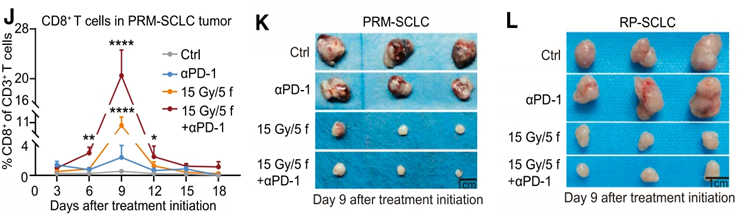
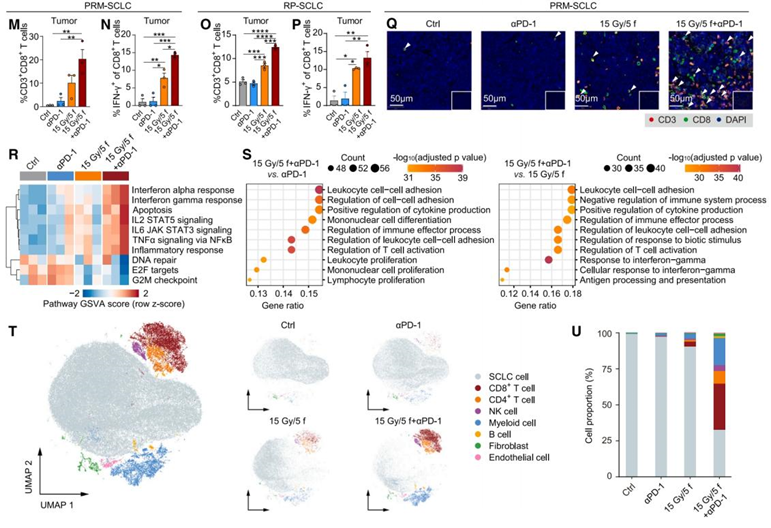
3. LDRT+ICIs募集TCF1+ PD-1+ CD8+干细胞样T细胞
于是作者接下来探讨了这些细胞的特性和功能。A-C:首先研究者通过单细胞RNA测序UMAP的图展示了CD8+ T细胞的亚群和与之相对应的mark基因表达情况。并展示了分析了不同治疗组中干细胞样T细胞的比例,结果显示LDRT和ICIs联合治疗显著增加TSL。接下来,研究者通过火山图展示了TSL与其他CD8+ T细胞之间的差异表达基因,这些基因涉及TSL的干性、耗竭状态和细胞毒性。基因集富集分析(GSEA)显示了TSL与其他CD8+ T细胞相比在先前报道的TSL特征上的显著相似性。研究者进一步对不同治疗模式下的TSL这群细胞进行评分,发现低剂量放疗联合免疫治疗组的TSL具有更高的干性特征得分,这提示这群细胞有很好的分化潜能。I-L:并且研究者还通过通过伪序分析和UMAP图进一步展示了CD8+ T细胞亚群的发育轨迹和状态变化。MN:最后,通过多重免疫荧光(mIF)染色,验证了TSL在肿瘤组织中的浸润情况,这与先前的scRNA-seq发现一致。
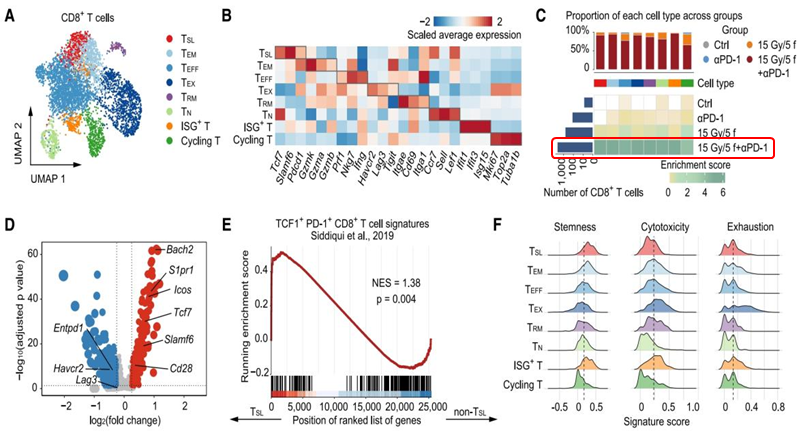
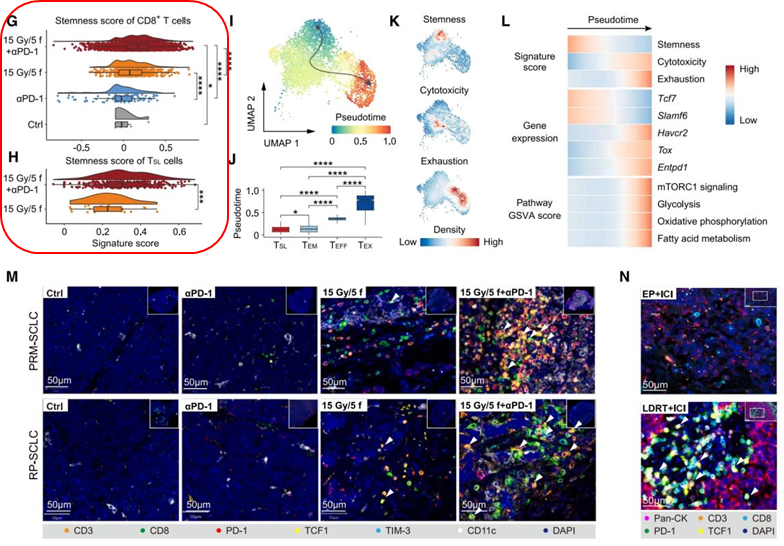
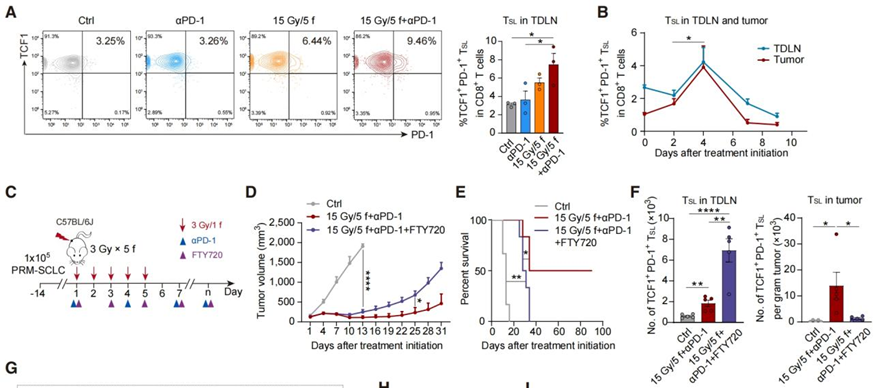
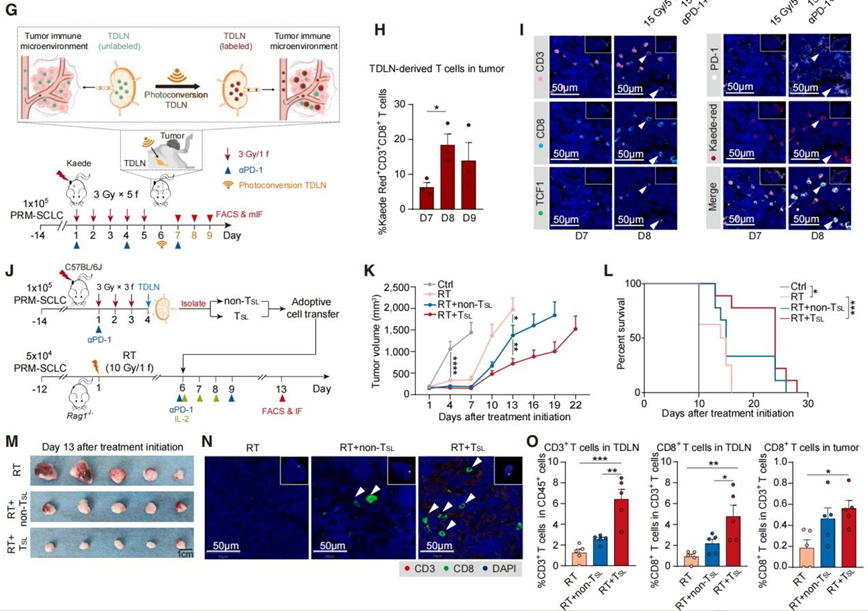
4. 干细胞样T细胞来源于肿瘤引流淋巴结
然后,研究者对TSL进行了溯源,他们先通过流式细胞术分析了不同治疗组中TDLNs里TSL的比例。结果表明,与单独使用LDRT或aPD-1相比,联合治疗显著增加了TSL的比例和增殖能力。Figure 4B进一步展示了LDRT15 Gy/5 f联合aPD-1治疗后,TSL在TDLNs和肿瘤中的动态变化,揭示了TSL在肿瘤免疫反应中的潜在作用。为了探究TSL是否从TDLNs迁移到肿瘤,研究者在Figure 4C-F中使用了FTY720实验,这是一种阻止T细胞从淋巴结排出的药物。实验结果表明,FTY720阻断减弱了联合治疗的抗肿瘤效果。接下来,研究者通过光转化技术追踪肿瘤引流淋巴结里面的TSL,对这些细胞的迁移进行跟踪,最终发现肿瘤内的TSL就是来自于肿瘤引流淋巴结。最后,研究者还进行了体外和体内实验来评估TSL的杀伤效应。结果显示,与普通的CD8+ T细胞相比,TSL在体内体外实验中都展示出良好的肿瘤控制能力。
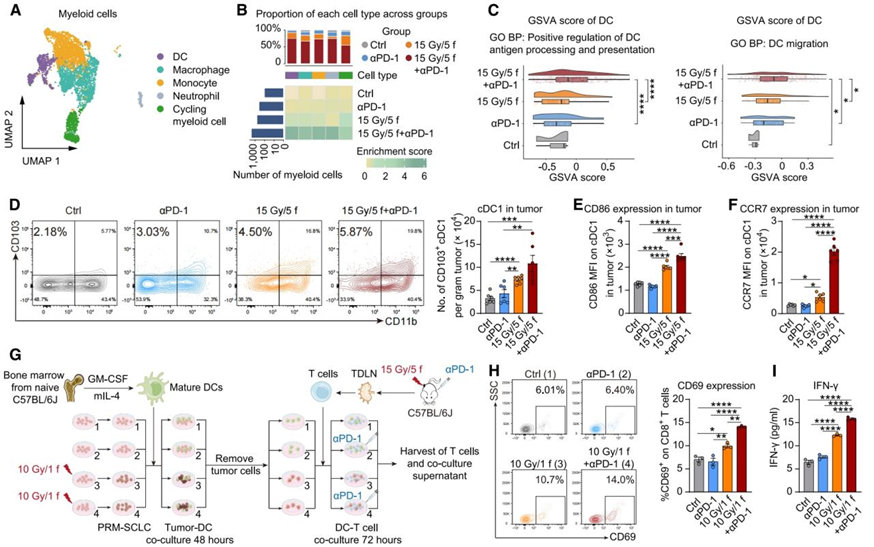
5. LDRT激活cGAS/STING通路,增强树突状细胞活化TSL的能力
对于肿瘤微环境的特征,研究者还进一步挖掘了LDRT+pd-1抗体如何增强DCs的抗原处理和呈递功能。A-C:首先研究者发现LDRT+pd-1抗体组有更多的DC细胞富集。D-F:通过流式细胞术研究者观察到LDRT和aPD-1联合治疗显著增加了肿瘤和TDLNs中常规1型DCs(cDC1s)的数量,并上调了cDC1s上的抗原呈递标记CD86和迁移标记CCR7的表达。G-I:然后研究者通过体外实验验证了LDRT和aPD-1联合治疗的肿瘤细胞如何促进DCs的成熟,并增强了它们激活T细胞的能力。
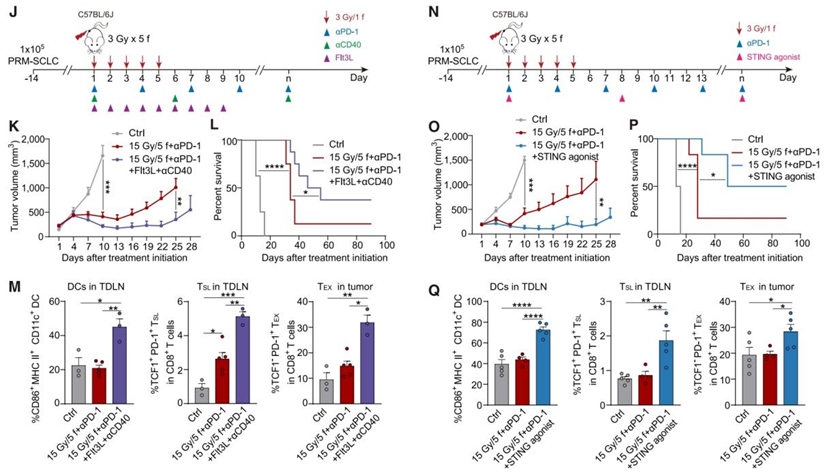
在Figure 5J-Q中,研究者好探索了通过进一步刺激DCs或cGAS/STING途径来增强LDRT和aPD-1联合治疗的抗肿瘤效果。实验结果表明,这种联合策略不仅增强了DCs和TSLs的比例和功能,还显著提高了肿瘤控制和生存期。
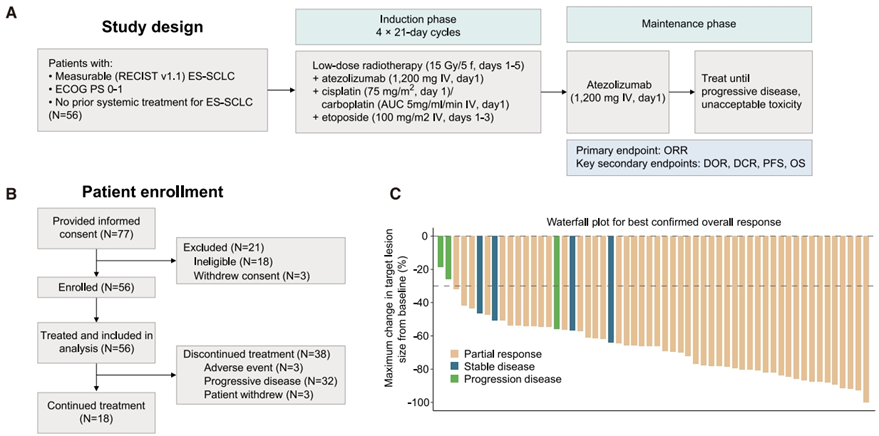
6. LDRT同步阿替利珠单抗+化疗作为ES-SCLC的一线治疗方法安全有效
接下来是本文章临床研究的部分,研究者向我们展示了MATCH试验的设计和入组流程图。治疗方案是在ES-SCLC一线标准化疗+免疫方案基础上(IMpower 133)同步联合低剂量放疗(15Gy/5f),研究者通过瀑布图和蜘蛛图展示了靶病灶的变化情况。研究共纳入56例ES-SCLC初治患者。至本次数据Cut-off时,全部患者的中位无进展生存期(mPFS)为6.9个月(95%CI:5.4个月-9.3个月),12个月PFS率为27.7%,且患者12个月OS率达到71.9%,中位总生存期(mOS)仍未达到。
小结
1.创新的治疗模式:将LDRT与ICIs和化疗相结合,为SCLC患者提供了一种新的治疗模式,克服了单一疗法的局限性。
2.免疫微环境的重要性:研究强调了通过LDRT重塑免疫微环境的重要性,这不仅促进了局部免疫反应,还可能增强了全身性的抗肿瘤免疫。
3.临床转化的潜力:从临床前模型到II期临床试验的转化,展示了这种联合疗法的临床应用潜力,为未来的III期临床试验和更广泛的患者群体提供了基础。
4.生物标志物的研究:通过scRNA-seq分析发现的TSL和其他免疫细胞亚群,为个性化医疗和精准治疗提供了新的生物标志物。
5.安全性和有效性的证据:II期临床试验的结果为这种联合疗法的安全性和有效性提供了初步证据,为进一步的研究和临床应用奠定了基础。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#小细胞肺癌# #低剂量放疗#
11