唐本忠院士AM:探索AIE材料在细菌研究中的应用进展
2024-09-12 BioMed科技 BioMed科技 发表于上海
本综述总结了AIE材料在细菌研究中的发展趋势,并预计将为推进细菌方法学的未来研究方向提供指。
细菌与人类有着长期且复杂的关系,它们在保护肠道健康和维持生态系统方面发挥作用,同时也可能导致传染病和抗生素抗性。具有聚集诱导发光(AIE)特性的发光材料已成为通过荧光可视化研究细菌的多功能工具箱。众多研究工作突显了AIE材料在这一领域的优越性。香港中文大学(深圳)唐本忠&香港科技大学Ryan T. K. Kwok郭子健将AIE材料在细菌研究中的近期进展被归类为四个领域:理解细菌相互作用、抗菌策略、多样化应用以及与细菌的协同应用。初步研究集中在可视化看不见的细菌,并发展到涉及静电力作用、两亲性AIE发光体(AIEgens)和各种AIE材料以增强细菌亲和力的策略。抗菌策略的最新进展包括使用光动力和光热疗法、细菌毒性研究以及联合疗法。从环境消毒到疾病治疗的多样化应用,利用AIE材料在抗菌涂层、细菌传感器、伤口愈合材料等方面的应用也得到了提供。最后,探索了将AIE材料与细菌结合以实现增强效果的协同应用。本综述总结了AIE材料在细菌研究中的发展趋势,并预计将为推进细菌方法学的未来研究方向提供指。该研究以题为“Expanding Our Horizons: AIE Materials in Bacterial Research”的论文发表在《Advanced Materials》上。

方案1展示了AIE材料在细菌研究中的关键发展里程碑,包括用于细菌成像和光诱导细菌灭活的阳离子两亲性AIEgens的荧光图像和示意图,AIE现象及其机制的说明,中性AIEgen对革兰氏阳性细菌的选择性靶向的共聚焦图像,使用AIEgens的荧光传感器阵列进行病原体鉴定的示意图,以及AIE生物缀合物引导噬菌体靶向细菌的示意图等。这些内容表明AIE材料在细菌可视化、分类和治疗方面具有广泛的应用潜力,特别是在开发新型抗菌策略和提高疾病诊断准确性方面。
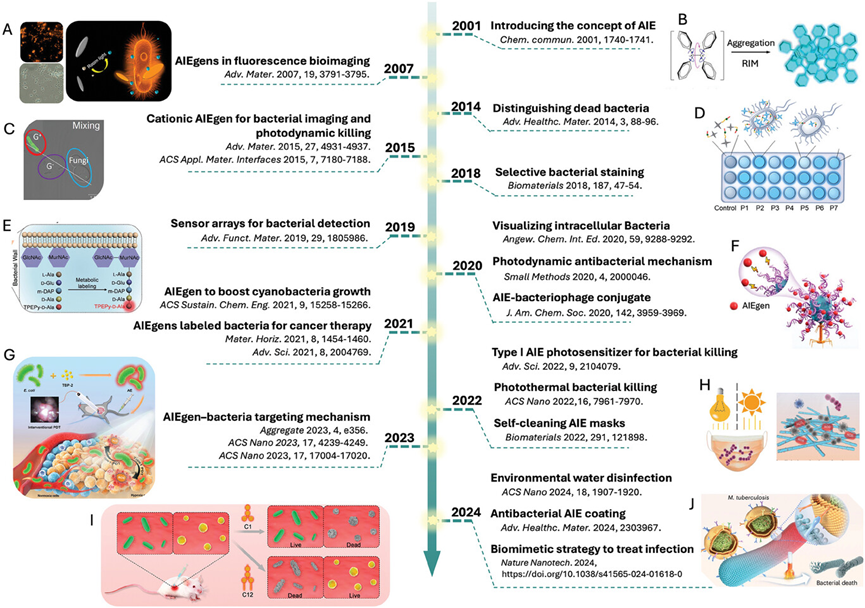
方案1.AIE材料在细菌研究中的关键里程碑时间线。
方案2通过图示和化学结构展示了阳离子两亲性AIEgens(如TPy, TPPy, TTPy, MeOTTPy, TPE-TTPy)与细菌的相互作用,以及这些AIEgens在不同细菌类型(革兰氏阳性和革兰氏阴性)中的荧光成像效果。研究结果表明,这些AIEgens能够通过静电和疏水相互作用与细菌细胞膜结合,从而实现对细菌的荧光标记。特别是,具有较长烷基链的AIEgens表现出对革兰氏阴性细菌更强的亲和力和标记能力,而较短烷基链的AIEgens则更倾向于与革兰氏阳性细菌结合。
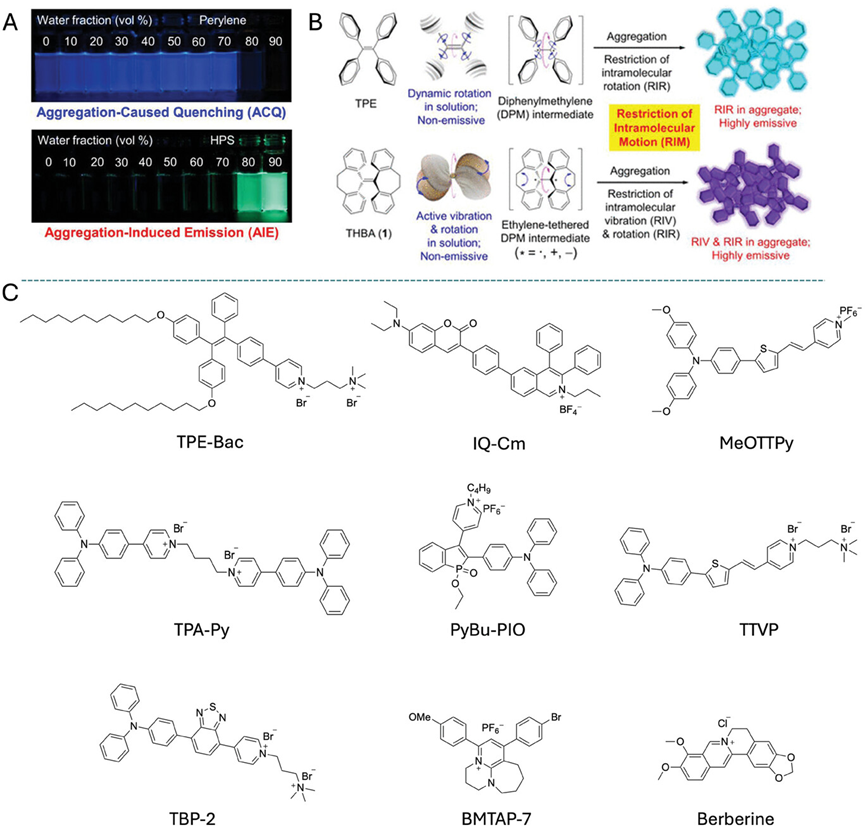
方案2.AIE现象和机制的示意图
【阳离子两亲性AIEgens】
图1展示了阳离子两亲性AIEgens(包括TPy、TPPy、TTPy、MeOTTPy和TPE-TTPy)的化学结构,并通过共聚焦成像技术揭示了这些AIEgens对革兰氏阳性细菌(如金黄色葡萄球菌、粪肠球菌、枯草杆菌和表皮葡萄球菌)的选择性靶向能力。研究结果表明,这些AIEgens通过静电作用与细菌细胞壁的负电荷相互作用,从而在无需额外靶向基团的情况下实现对革兰氏阳性细菌的特异性标记。此外,通过zeta电位分析和荧光强度测量,研究还发现这些AIEgens与革兰氏阳性细菌的结合效率和荧光信号强度与其分子结构中的疏水性有关,而对革兰氏阴性细菌的标记效果较弱,这可能是由于革兰氏阴性细菌外膜的存在阻碍了AIEgens的渗透。
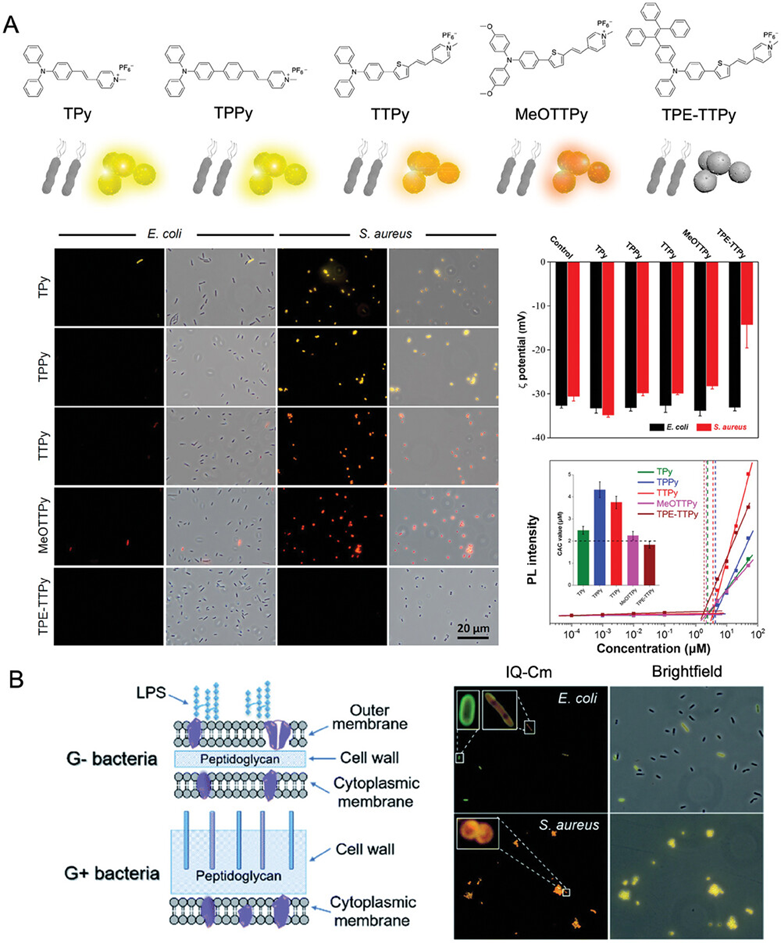
图1.阳离子两亲性 AIEgens
【磷脂模拟】
图2介绍了磷脂模拟的阳离子两亲性AIEgens,这些分子通过模仿细菌细胞膜的磷脂结构设计,以增强与细菌的亲和力。研究中,通过调节AIEgens分子中烷基链的长度,实现了对革兰氏阳性和革兰氏阴性细菌的选择性靶向。短烷基链的AIEgens倾向于与革兰氏阳性细菌的细胞膜结合,而长烷基链的AIEgens则更易与革兰氏阴性细菌的外膜相互作用,导致对后者的选择性标记和杀灭。
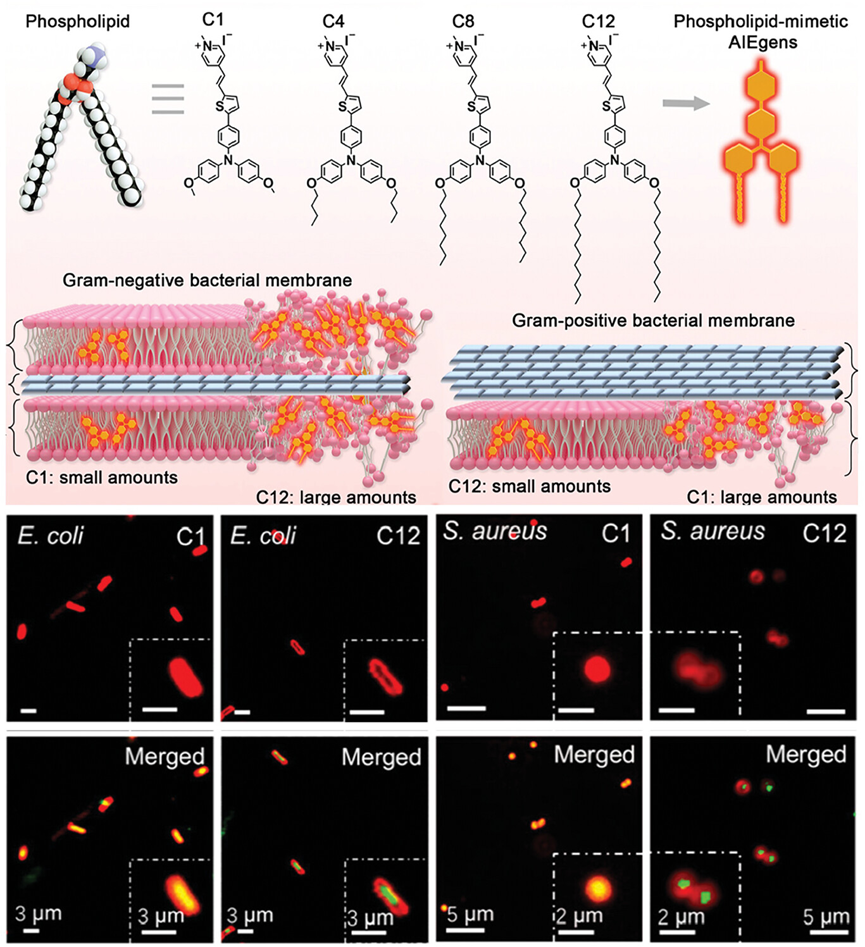
图2.磷脂模拟
【结构疏水性调整】
图3展示了阳离子两亲性AIEgens(如TTVP-Am, TTVP-Bu, TTVP-Tol, 和 TTVP-Nap)的化学结构、计算的对数值(Clog P)以及它们与革兰氏阳性细菌(S. aureus)和革兰氏阴性细菌(E. coli)相互作用的共聚焦图像。研究结果表明,这些AIEgens的疏水性可以通过改变分子结构中的烷基链长度来调节,从而影响它们与细菌的亲和力和标记效率。具体来说,随着AIEgens疏水性的增加,它们与革兰氏阳性细菌的结合能力增强,但同时也可能导致细菌聚集和荧光染料聚集体的形成。对于革兰氏阴性细菌,虽然低浓度下这些AIEgens的标记效果不佳,但在较高浓度下,即使是疏水性较低的AIEgens也能实现有效的标记。
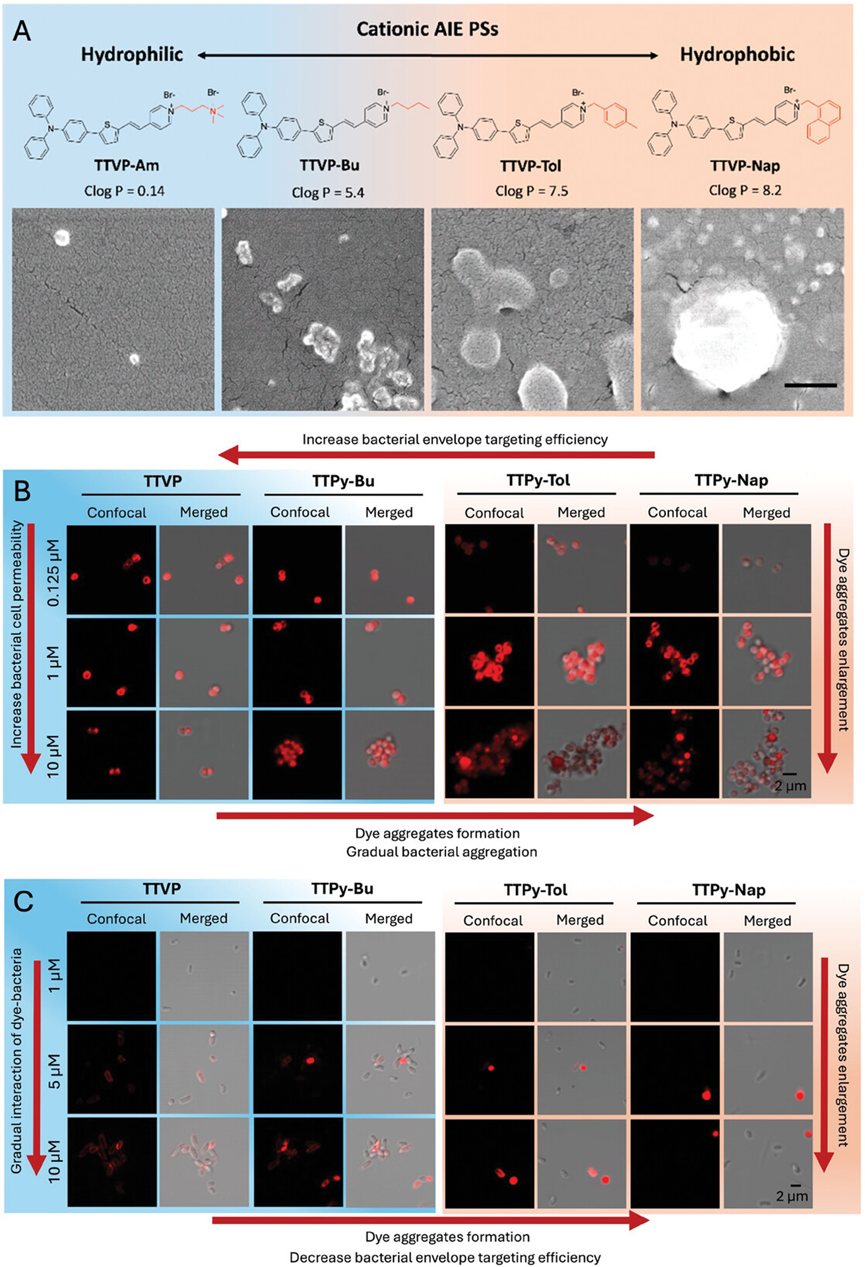
图3.结构疏水性调整
图4展示了具有不同结构疏水性的阳离子两亲性AIEgens(包括PyMe-PIO, PyBu-PIO, PyC12-PIO, 和PyC12-PIOC12)的化学结构、Clog P值以及它们在水溶液中的静态水接触角。通过共聚焦成像技术,研究了这些AIEgens与金黄色葡萄球菌(S. aureus)和大肠杆菌(E. coli)的染色特性。实验结果表明,随着AIEgens分子中烷基链长度的增加,它们与革兰氏阳性细菌的亲和力增强,但当烷基链过长时,会导致AIEgen在细菌表面的不均匀分布和聚集。对于革兰氏阴性细菌,较短烷基链的AIEgens显示出较弱的染色效果,而较长烷基链的AIEgens则能够实现有效的染色。
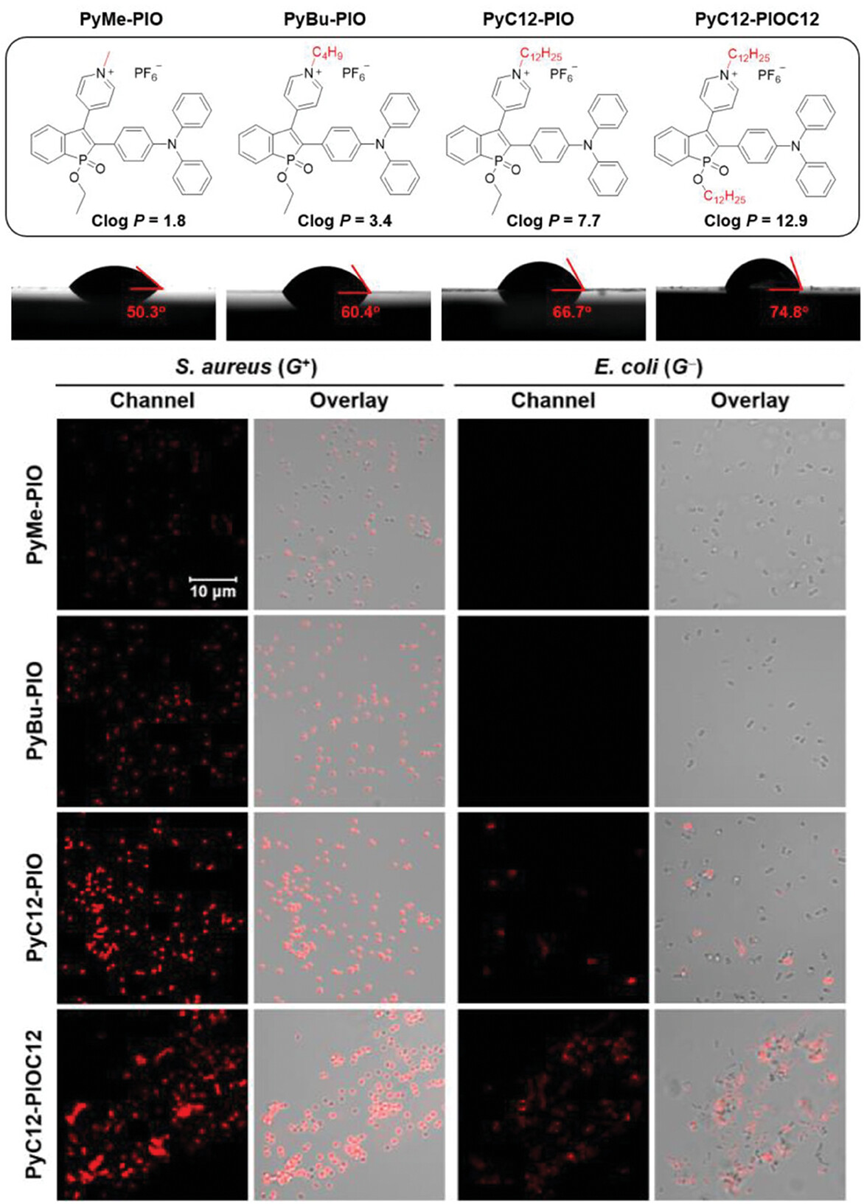
图4.具有不同结构疏水性的阳离子两亲性AIEgens的表征
图5呈现了具有不同分子电荷的阳离子两亲性AIEgens(包括TBTCP, TBTCP-SF, TBTCP-QY以及TBP-1和TBP-2)的化学结构,并展示了它们与金黄色葡萄球菌和大肠杆菌的靶向行为。研究发现,分子电荷的增加可以增强AIEgens与细菌的结合能力,尤其是对于革兰氏阴性细菌。具体来说,带有双正电荷的TBTCP-QY和TBP-2显示出对革兰氏阳性和革兰氏阴性细菌更强的荧光标记能力,而带有单正电荷的TBTCP和TBP-1则相对较弱。这表明通过调节AIEgens的分子电荷,可以有效地优化其对不同类型细菌的靶向性和成像效果。
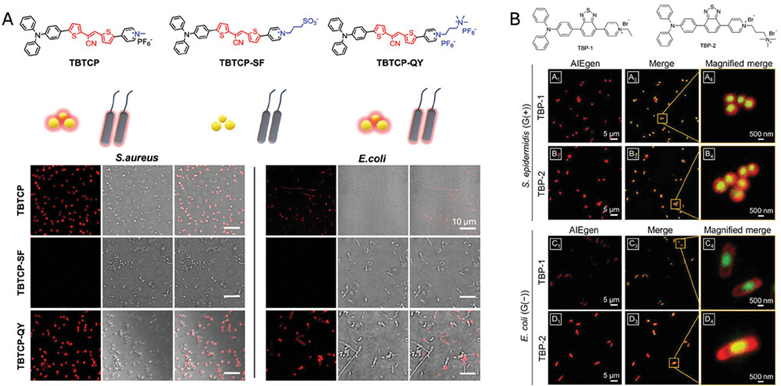
图5. 具有不同分子电荷的两亲性 AIEgens的化学结构
【将过程靶向细菌】
图6介绍了一种阳离子两亲性AIEgen(TO2C),它能够通过荧光开关监测其与细菌的动态相互作用过程。研究发现,TO2C在与细菌接触时,其荧光发射峰发生显著蓝移,并且发射强度增加,表明其从单体状态转变为聚集态。共聚焦图像显示TO2C能够高效地标记金黄色葡萄球菌,且通过连续监测TO2C的荧光变化,确认了其聚集体在细菌接触后5分钟内即完成解聚并达到平衡状态。这些结果揭示了阳离子AIE聚集体最初通过静电作用附着在细菌表面,随后单体解离并穿透细胞膜的过程。此外,通过分子动力学分析,研究还发现TO2C与细菌的结合主要不是由带正电的吡啶基团介导,而是由三苯胺基团与细胞膜的相互作用力决定。
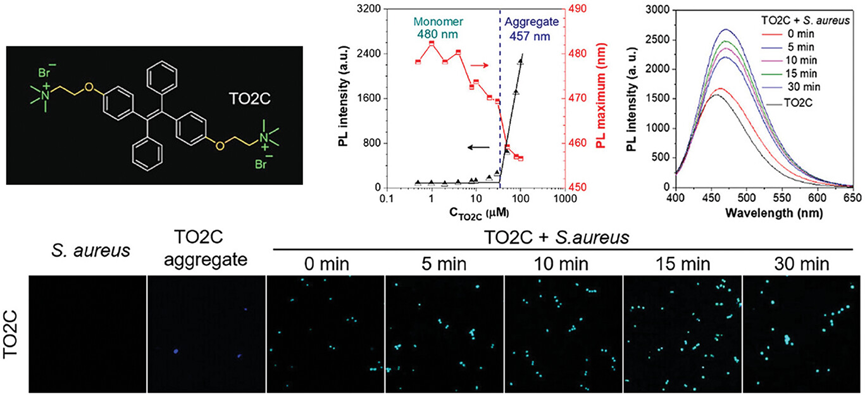
图6.将过程靶向细菌
【阳离子金属络合物】
方案3通过展示阳离子两亲性AIEgens(例如Ir(ppy)2bP, Ir(1-pq)2bP, Ir(2-pq)2bP)的化学结构,阐述了这些材料如何通过静电作用与细菌细胞膜上的负电荷相互作用,实现对细菌的选择性标记和成像。研究结果表明,这些AIEgens能够有效地附着在细菌表面,并通过荧光信号的变化来区分不同类型的细菌,如革兰氏阳性和革兰氏阴性细菌。此外,通过调节AIEgens的分子结构,可以优化其与细菌的亲和力,从而提高成像的特异性和灵敏度。
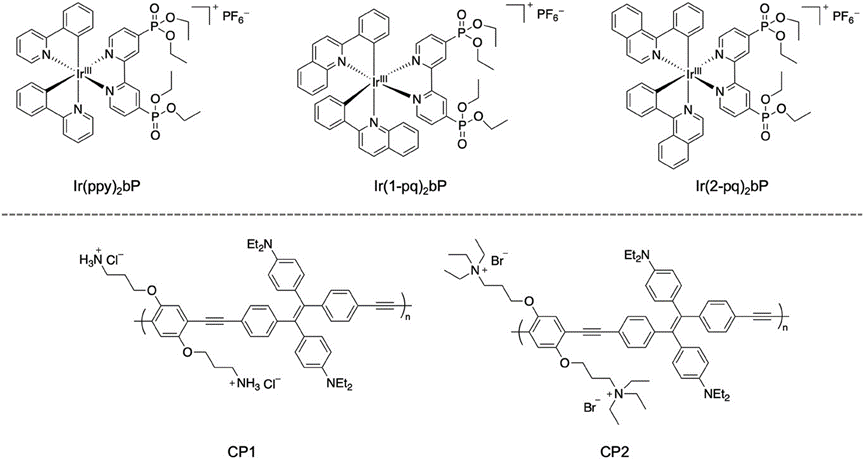
方案3.阳离子金属络合物
【中性AIEgen】
方案4介绍了一种名为TPE-2BA的AIEgen,它能够通过与细菌细胞壁上的二醇基团发生反应,实现对细菌的选择性标记。研究发现,TPE-2BA在与细菌细胞壁的二醇基团发生酯化反应后,能够限制分子内运动,从而激活其荧光,使得细菌在荧光显微镜下可见。这一发现证实了AIEgens可以通过特定的化学相互作用实现对细菌的可视化,为开发新型细菌检测和成像技术提供了新的思路。此外,TPE-2BA的这种特异性标记能力还为研究细菌的生理和病理过程提供了有力的工具,有助于深入理解细菌在感染和疾病中的作用。
方案4.中性AIEgen
【抗生素修饰的AIEgens】
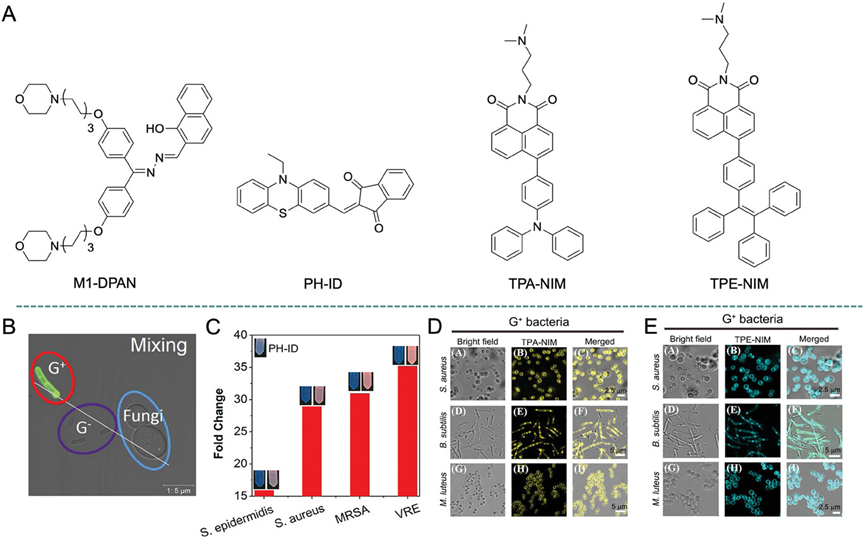
图7展示了中性AIEgen(M1-DPAN)对革兰氏阳性细菌的选择性靶向行为。通过共聚焦成像技术,研究发现M1-DPAN能够特异性地标记革兰氏阳性细菌,而不与革兰氏阴性细菌或真菌发生明显的结合。这一选择性靶向能力归因于革兰氏阳性细菌细胞壁中独特的成分和结构,特别是它们细胞壁中丰富的肽聚糖和磷壁酸,这些成分与M1-DPAN的疏水性部分通过疏水作用力结合。此外,研究还发现M1-DPAN主要定位在细菌的细胞壁上,而不是细胞内部,这表明其与细菌的结合具有较高的特异性。
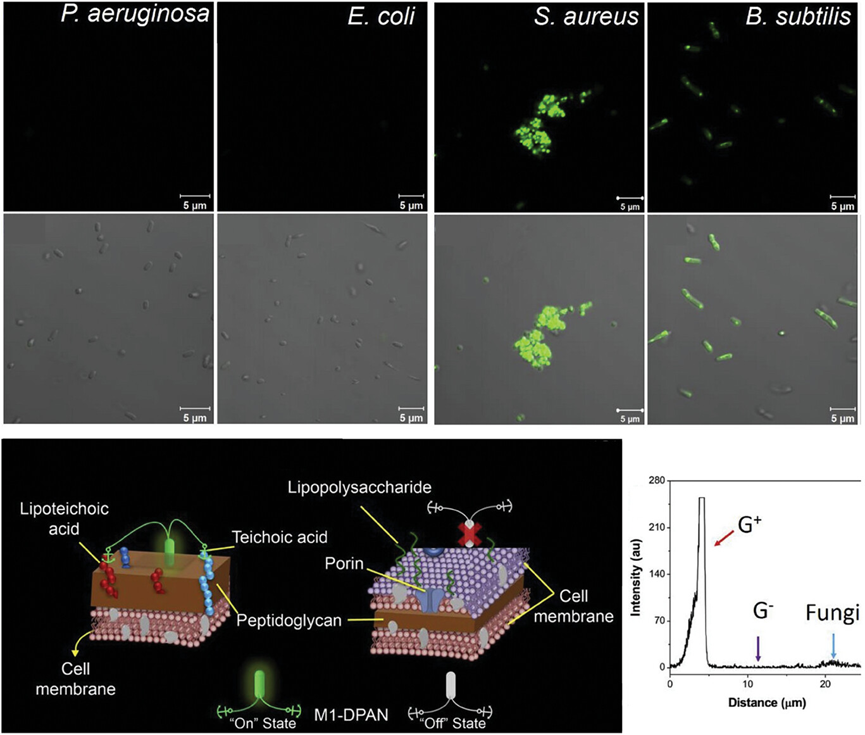
图7.共聚焦图像和选择性靶向革兰氏阳性细菌的中性AIEgen(M1-DPAN)的示意图
图8展示了AIE活性抗生素(如MXF-P和MXF-R)的化学结构以及它们在金黄色葡萄球菌和大肠杆菌中的染色效果。研究发现,这些AIE活性抗生素能够通过静电作用与细菌细胞膜结合,实现对细菌的有效标记和可视化。特别是,带有阳离子AIEgen DMAPy的MXF-R表现出对革兰氏阳性和革兰氏阴性细菌的荧光标记能力,这与其能够促进与细菌细胞膜的静电相互作用有关。此外,通过共聚焦成像观察到MXF-R能够进入宿主细胞并标记内部的细菌,表明其具有穿透细胞膜的能力。
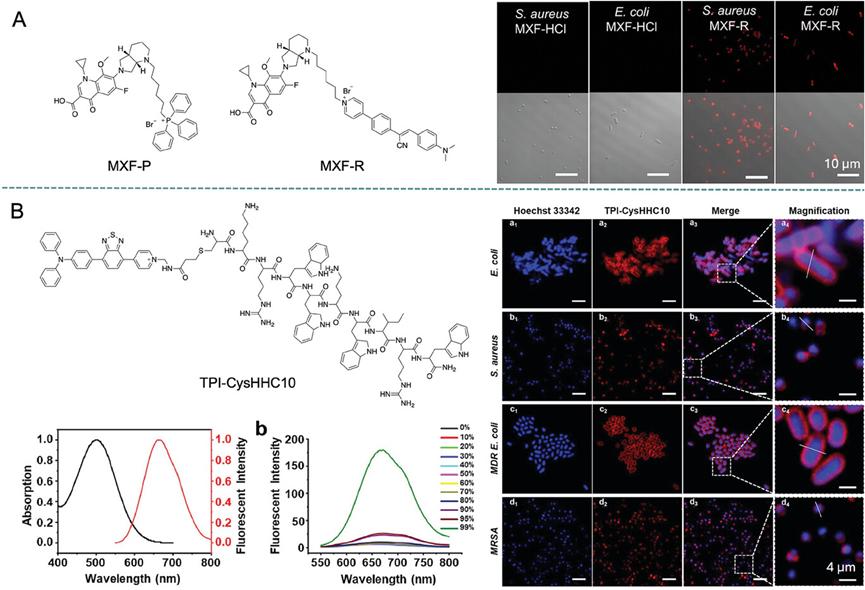
图8.AIE活性抗生素的化学结构,以及用MXF-HCl和MXF-R染色的共聚焦图像
【AIE 代谢探针】
图9介绍了AIE材料在细菌研究中的多样化应用,包括作为荧光传感器阵列用于病原体鉴定、通过代谢标记策略可视化胞内细菌、以及利用噬菌体引导的AIE生物缀合物实现细菌的靶向。研究结果表明,AIE材料能够通过特定的化学结构和功能基团与细菌发生相互作用,实现对细菌的高效标记和选择性识别。
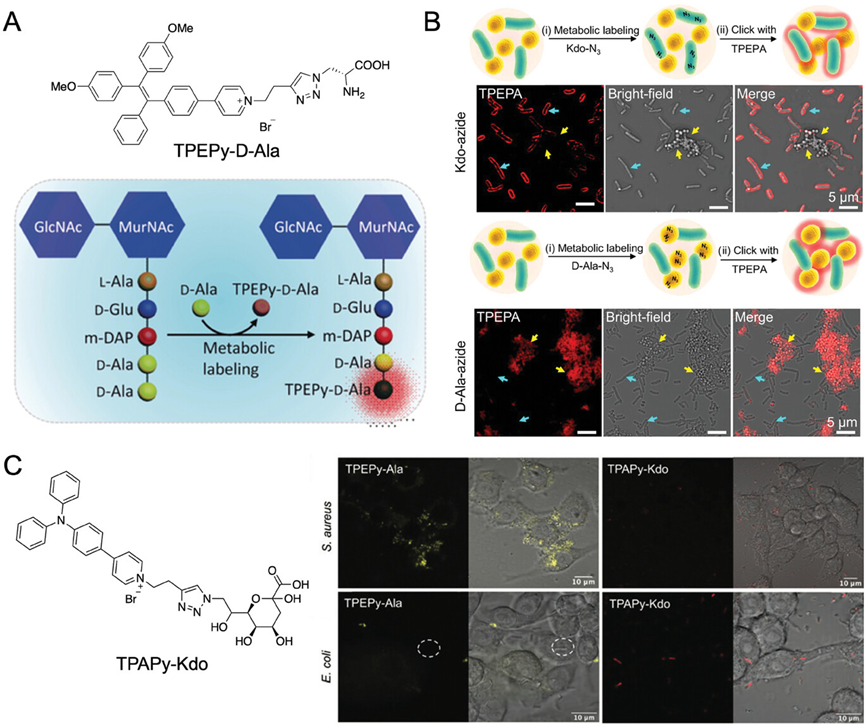
图9.AIEgen在肽聚糖生物合成中的参与和荧光开启的化学结构和示意图
【噬菌体偶联的AIEgens】
图10展示了利用噬菌体作为引导,通过AIE生物缀合物实现对细菌的靶向。具体来说,研究人员开发了一种AIE-phage纳米缀合物(MS2-DNA-AIEgen),它能够特异性地识别并结合到其宿主细菌的表面。这种纳米缀合物通过将AIEgens共价连接到噬菌体的DNA序列上,利用噬菌体的天然靶向能力,实现了对细菌的荧光标记和成像。实验结果证实,MS2-DNA-AIEgen能够有效地标记宿主细菌E. coli-15597,并且不与非宿主细菌E. coli-8739发生结合,显示出高度的特异性。此外,该纳米缀合物还能够进入宿主细胞内部,标记和杀死胞内的细菌,为细菌的检测和治疗提供了一种新的方法。
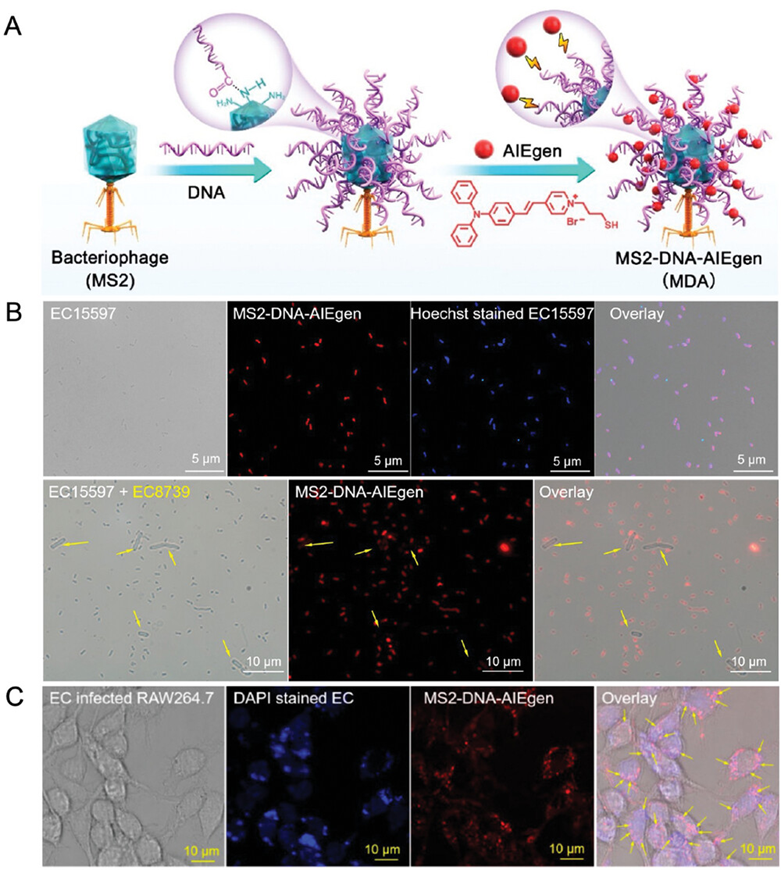
图10.制备噬菌体-AIEgen生物缀合物的示意图
【细胞膜包被的AIE NPs】
图11介绍了一种仿生方法,通过构建细胞膜涂层的纳米颗粒(BBTD@PM NPs),利用激活的巨噬细胞膜来特异性识别并结合到结核分枝杆菌(M. tuberculosis)。研究人员首先通过与M. marinum共培养来激活巨噬细胞,然后从这些激活的巨噬细胞中提取细胞膜,将其涂覆在含有AIEgens的纳米颗粒上。结果表明,这种仿生纳米颗粒能够特异性地与M. marinum和H37Ra杆菌结合,而与S. aureus、E. coli和P. aeruginosa等其他细菌没有明显的结合。
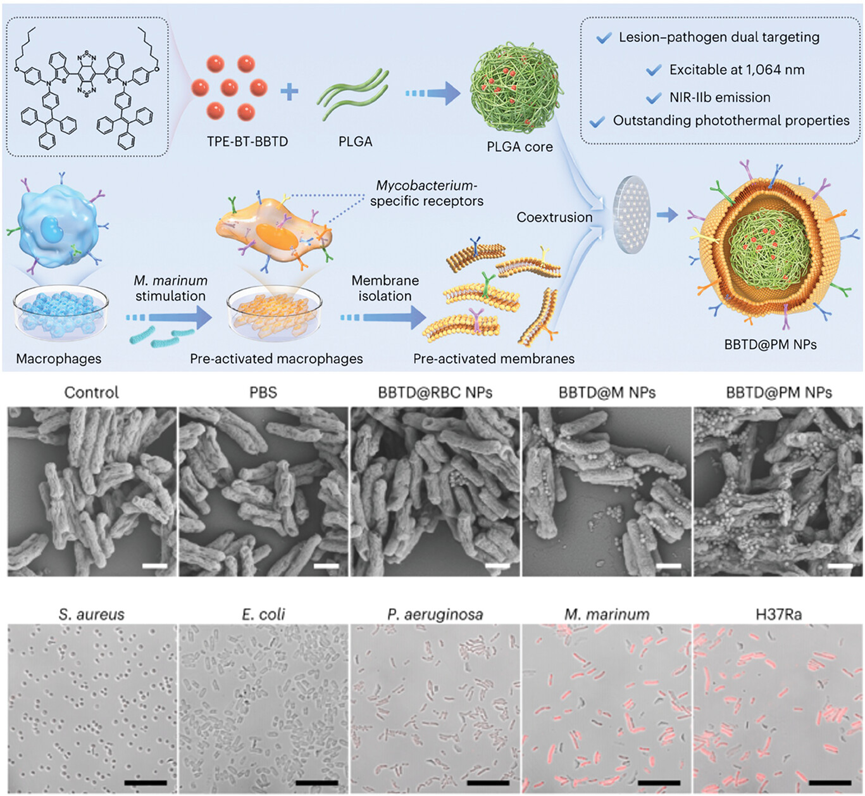
图11.细胞膜包被的 AIE NPs
【AIEgen的糖缀合物】
图12展示了一种基于AIEgen的糖缀合物(TPyGal),它能够通过特定的碳水化合物-蛋白质相互作用靶向并聚集铜绿假单胞菌(P. aeruginosa)。研究中,TPyGal自组装形成具有半乳糖基团修饰表面的球形聚集体,这些聚集体能够与细菌表面的lecA(一种凝集素)特异性结合,导致细菌聚集。通过与自由的D-半乳糖(DGal)竞争结合位点,可以减少TPyGal引起的细菌聚集,从而验证了其对细菌表面的特异性结合。此外,实验观察到TPyGal并未与大肠杆菌(E. coli)聚集,这表明大肠杆菌缺乏相应的凝集素A位点。
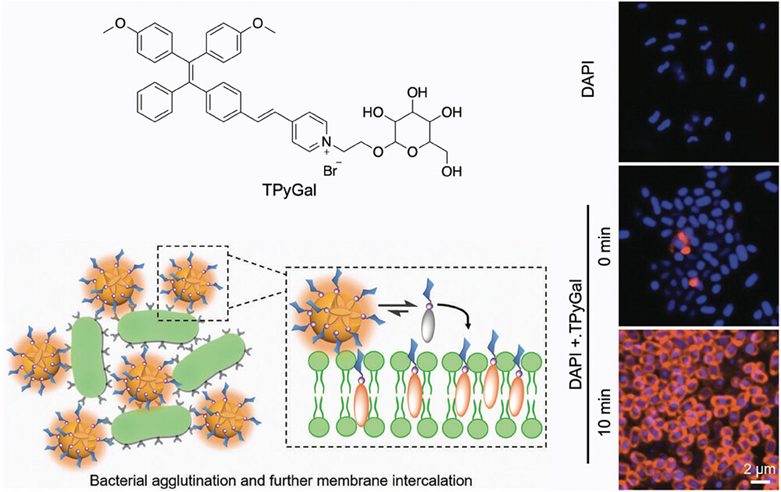
图12.AIEgen的糖缀合物
【其他功能化的AIEgen】
图13介绍了一种酶和活性氧(ROS)响应的AIE探针,用于检测和可视化细菌。研究人员利用AIE-肽探针模拟宿主防御机制,精确定位胞内细菌。例如,PyTPE-CRP探针能够模拟巨噬细胞在细菌入侵时激活caspase-1的天然过程,通过酶切反应在含有细菌的吞噬体内产生强烈荧光。此外,DTF-FFP探针则针对细菌感染期间释放的ROS,特别是次氯酸(HClO),通过荧光共振能量转移(FRET)的变化实现对细菌的检测。这些探针的开发不仅增强了对细菌相互作用的理解,而且提高了细菌检测和研究的能力。
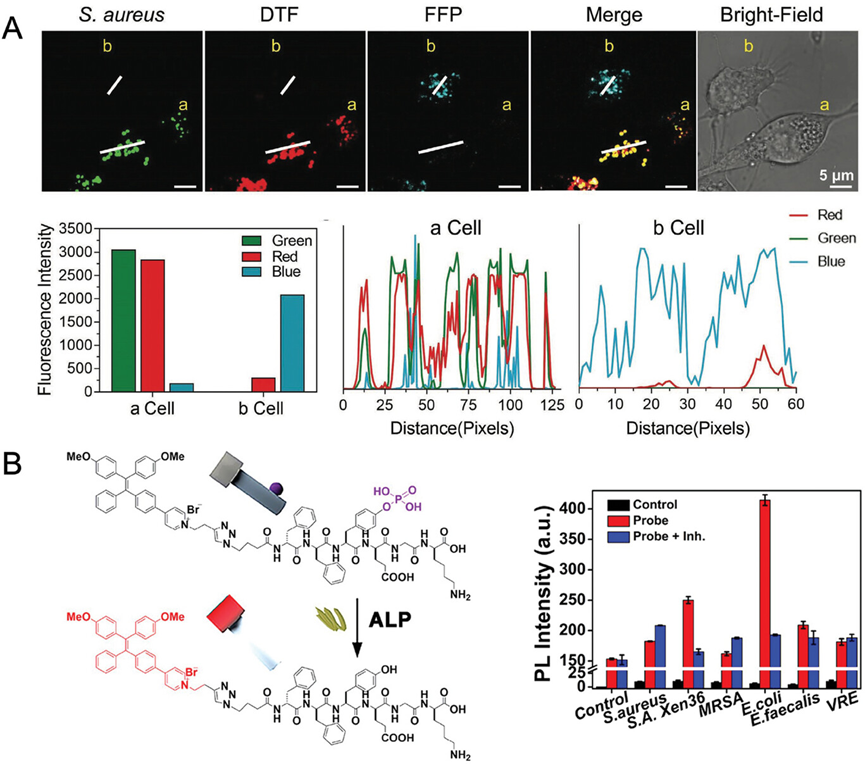
图13.AIE-肽探针模拟宿主防御机制,实现细菌的精确定位的共聚焦图像
图14展示了AIE材料在细菌研究中的多样化应用,包括利用细菌作为模板合成AIE活性聚合物,以及通过AIE材料与细菌细胞外多糖(EPS)的相互作用来靶向和破坏细菌生物膜。研究人员发现,特定的AIE材料能够通过模拟细菌表面的化学成分,实现对细菌的高效识别和结合。例如,利用铜催化的原子转移自由基聚合技术,以细菌为模板合成的AIE聚合物能够特异性地结合到其模板细菌,显示出对特定细菌的高亲和力。此外,AIE材料如Tanshinone IIA能够通过与生物膜中的EPS相互作用,渗透并破坏细菌生物膜结构,从而抑制细菌生长。
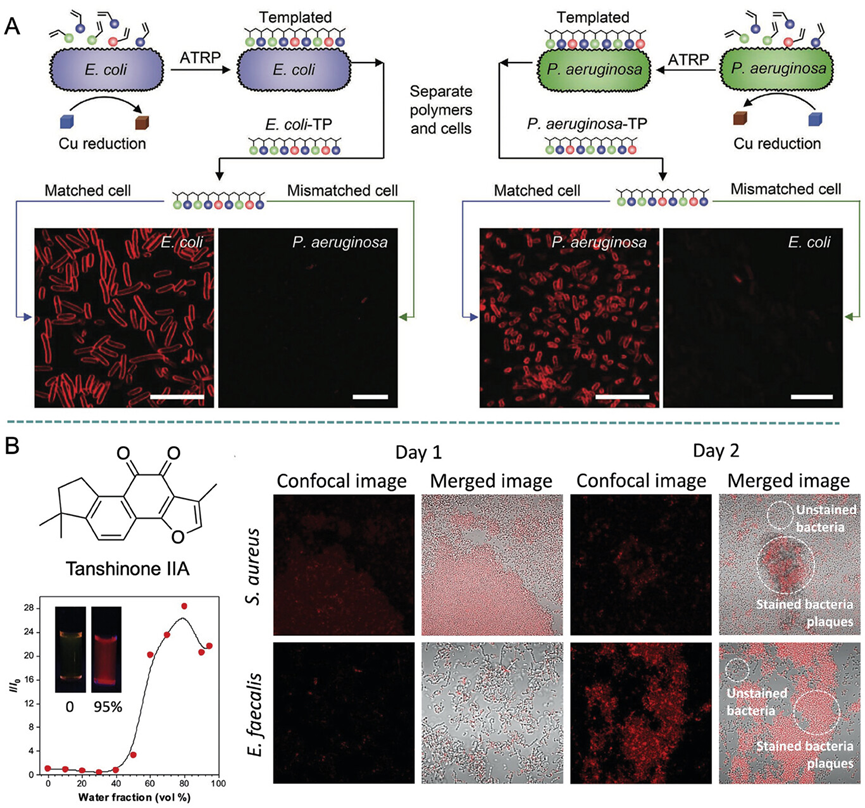
图14.细菌介导的聚合物合成过程的示意图
【AIE材料的3种抗菌策略】
图15展示了阳离子两亲性AIEgens(如C1和C12)以及TO2C、T2OE和TO6C等分子对革兰氏阳性菌(如金黄色葡萄球菌)和革兰氏阴性菌(如大肠杆菌)的抗菌效果。通过透射电子显微镜(TEM)和扫描电子显微镜(SEM)分析,研究证实了这些AIEgens能够破坏细菌的细胞壁,导致细菌死亡。实验结果表明,具有较短烷基链的C1对金黄色葡萄球菌具有更强的抗菌效果,而具有较长烷基链的C12则对大肠杆菌更有效。此外,TO2C、T2OE和TO6C分子的抗菌活性与其疏水性有关,其中TO6C因其更高的疏水性而展现出更强的膜破坏能力。这些结论揭示了AIEgens的分子结构对其抗菌性能有显著影响,并且通过调控分子的疏水性和电荷特性,可以优化其对特定类型细菌的抗菌效果。
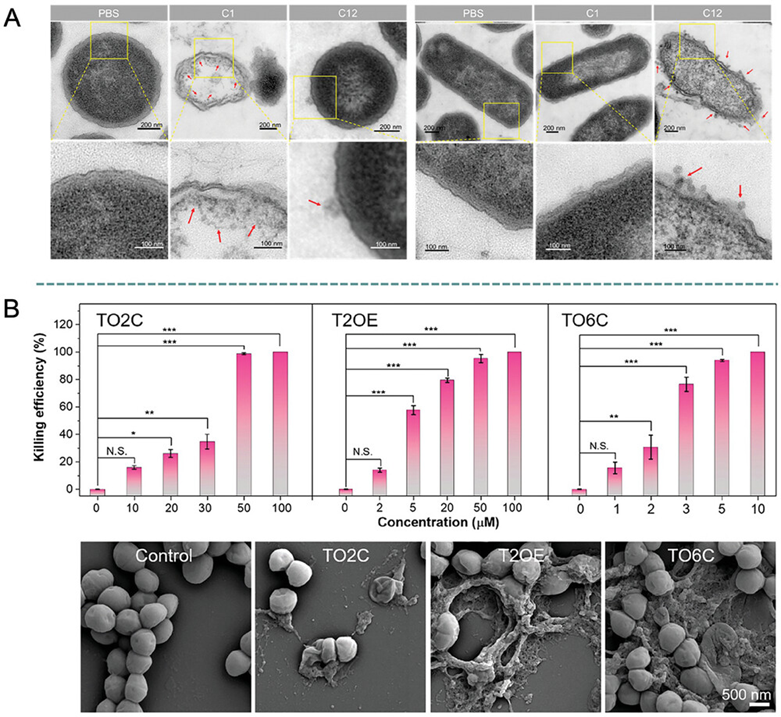
图15.C1和C12对E. coli和S. aureus的抗菌活性的透射电子显微镜分析
【光控抗菌活性】
图16阐释了AIE光敏剂在光动力抗菌治疗(PDT)中的作用机制,特别是通过产生单线态氧(Type II ROS)和自由基(Type I ROS)来实现细菌的杀灭。图中展示了一种光开关型AIE光敏剂(TPE-2Py-DTE NPs)的设计,该光敏剂能够响应不同波长的光照射,通过光异构化反应控制单线态氧的产生。在可见光激发下,TPE-2Py-DTE NPs能有效产生单线态氧,而在365nm紫外光照射下则抑制单线态氧的生成。此外,还介绍了一类AIE光敏剂(TTCPy系列),它们能够通过Type I机制产生ROS,具有高效的光动力杀灭细菌的能力。
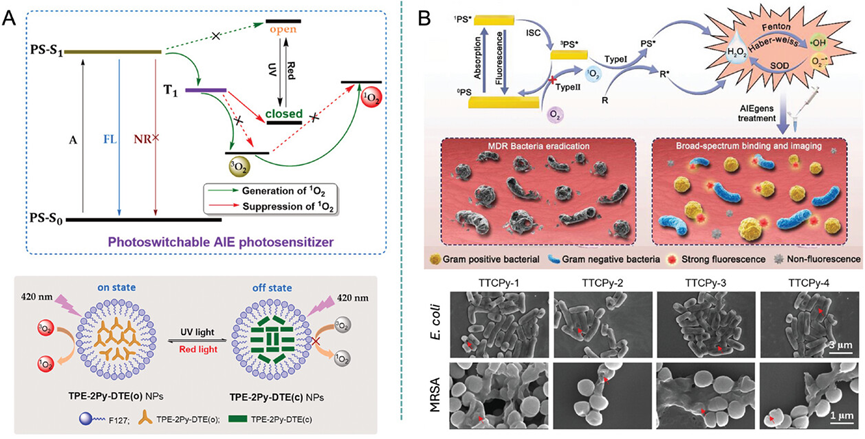
图16.光控抗菌活性
【ROS 作用机制】
图17探讨了AIE材料在抗菌光动力疗法(PDT)中的机制,特别是CAB系列化合物对大肠杆菌和耐甲氧西林金黄色葡萄球菌(MRSA)的抗菌效果。研究发现,CAB-8和CAB-10能够通过光照射产生活性氧(ROS),导致细菌死亡。CAB-8主要在细菌内部产生氧化作用,引起细胞内容物泄漏和细胞结构破坏,而CAB-10则主要影响细菌膜。此外,TI和TTI等AIE光敏剂虽然在光照射下表现出抗菌效果,但在没有光的情况下也具有一定的抗菌活性,这表明它们的抗菌机制可能不仅仅依赖于ROS的产生。
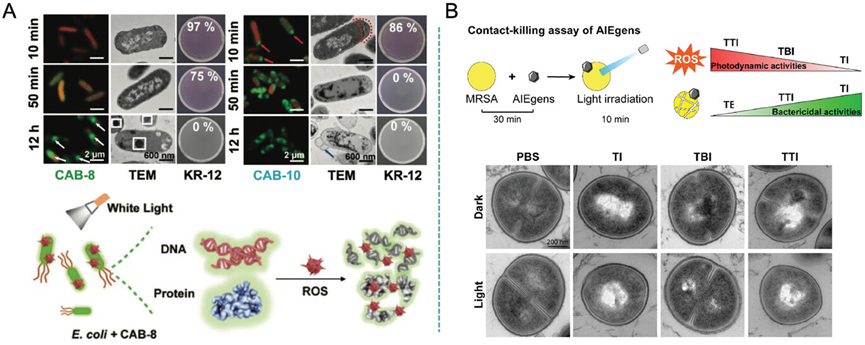
图17.ROS 作用机制
图18介绍了一种结合了AIE光敏剂和光热剂的纳米凝胶系统(AIE-NG和ACQ-NG),用于提高光热转换效率和抗菌效果。该系统利用聚(N-异丙基丙烯酰胺)(PNIPAM)的热响应性质,通过调节AIE光敏剂的聚集状态来增强其光热性能。研究发现,这种纳米凝胶在近红外光照射下能够有效地转换光能为热能,产生足够的热量来破坏细菌细胞结构,实现对耐甲氧西林金黄色葡萄球菌(MRSA)的高效杀灭。此外,通过转录组测序分析,研究还揭示了AIE-NG主要通过破坏细菌的DNA和蛋白质来影响其增殖。
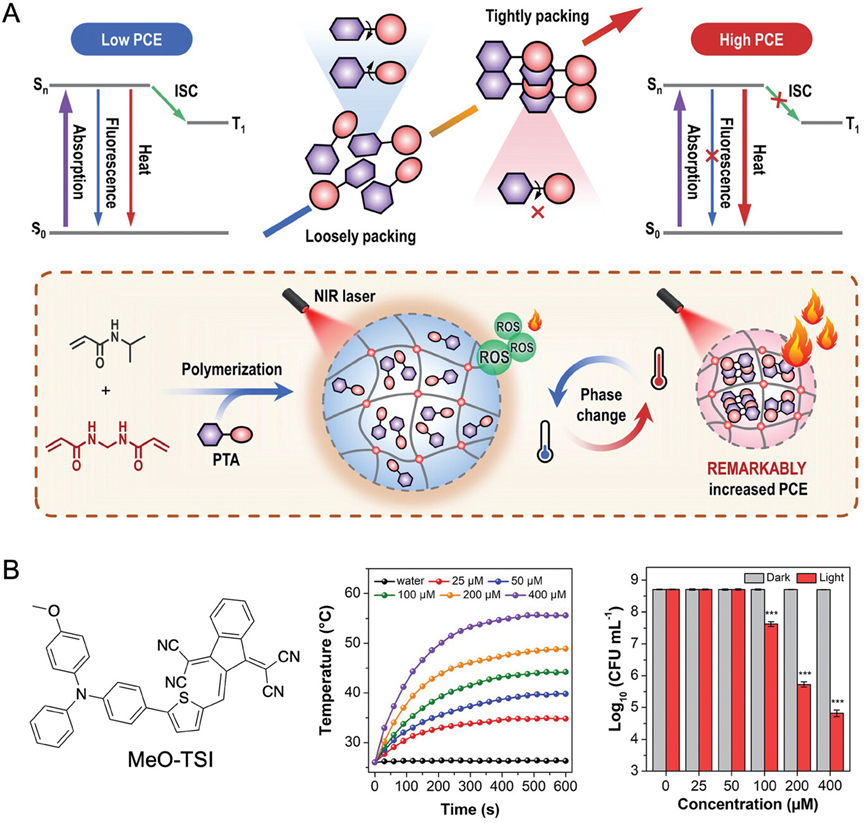
图18.AIEgen MeO-TSI和IR780封装到聚(N-异丙基丙烯酰胺)纳米凝胶的示意图
【联合治疗】
图19展示了一种基于AIE材料的纳米炸弹(AIE-Tei@AB NVs),它结合了光热治疗(PTT)、光动力治疗(PDT)和药物治疗,用于对抗耐药细菌感染。这种纳米炸弹通过自组装形成,包含了AIE光敏剂和抗生素,能够在近红外光照射下产生热量和活性氧,同时释放抗生素,实现对细菌的三重打击。实验结果表明,这种纳米炸弹在体外对多种耐药细菌具有显著的抗菌效果,并且在体内模型中也能有效清除感染并减轻炎症。
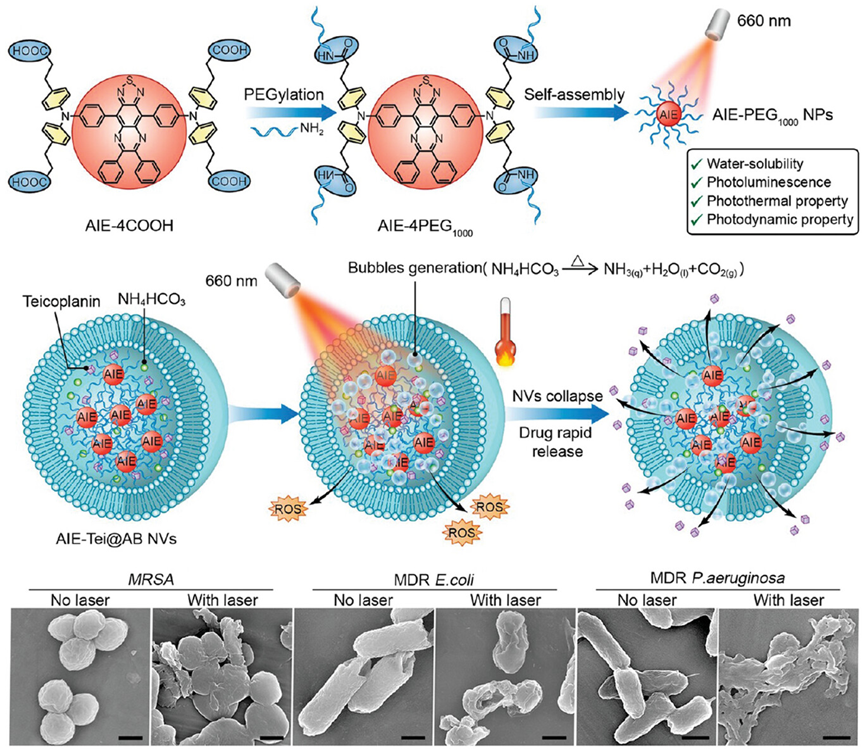
图19.AIE-PEG1000 NPs的制备和特征的AIE-Tei@AB NVs的结构
【多种应用】
图20描述了一种利用天然聚集诱导发光(AIE)光敏剂BBR(Berberine)来灭活致病菌,特别是单核细胞增生李斯特菌(L. monocytogenes),并将其嵌入到食品保存膜中以实现抗菌保鲜的策略。研究表明,BBR作为一种AIE光敏剂,能够有效地通过光动力作用抑制李斯特菌的生长,且在食品包装中的应用展现了良好的生物相容性和抗菌效果。此外,通过将BBR嵌入到钠藻酸盐/壳聚糖复合包装膜中,研究者们开发了一种新型的抗菌包装材料,用于三文鱼等食品的保鲜,有效延长了食品的保质期并减少了食源性疾病的风险。
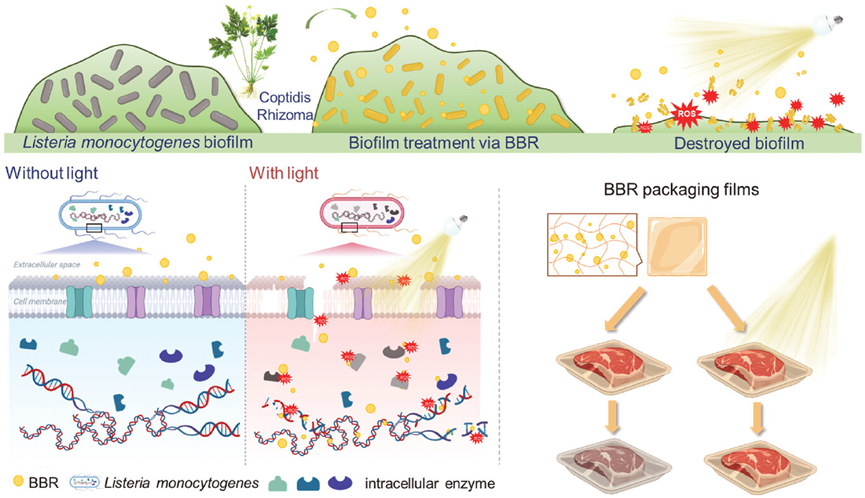
图20.食品保鲜
【抗菌涂层】
图21展示了一种基于聚集诱导发光(AIE)材料的抗菌涂层技术,该技术通过静电自组装将AIE光敏剂(如TTCPy-PF6和TTCPy-Br)固定在各种材料表面,形成具有抗菌能力的涂层。这些涂层在光照射下能够有效抑制金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌和溶血性链球菌等细菌的生长。研究结果表明,AIE涂层在光照射后30分钟内对这些细菌具有显著的抗菌效果,并且在24小时后仍能维持其抗菌活性。此外,这些涂层在一个月后仍能保持其抗菌性能,显示出良好的稳定性。
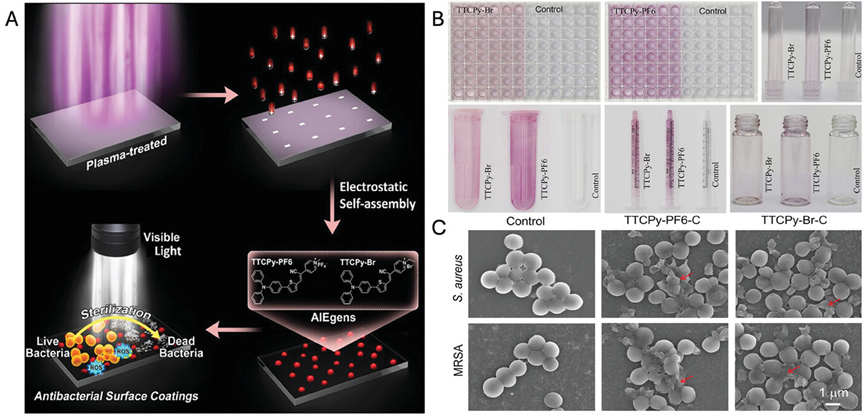
图21.抗菌涂层
【AIE磁纳米粒子的制备和其在水体中细菌光动力灭活可持续回收】
图22介绍了一种可回收使用的AIE(聚集诱导发光)磁性纳米粒子(MNPs),用于光动力灭活水中的细菌。这些纳米粒子由AIE光敏剂(TPA-Py-PhMe)和生物相容的Pluronic F127包裹的铁氧化物磁性纳米粒子组成,能够在光照下释放AIE光敏剂以产生活性氧,从而有效杀灭细菌。研究中展示了这些磁性纳米粒子在不同循环中的可回收性和稳定性,证明了它们在光动力处理后可以通过外部磁场轻松回收,并且能够重复使用,保持高效的抗菌性能。
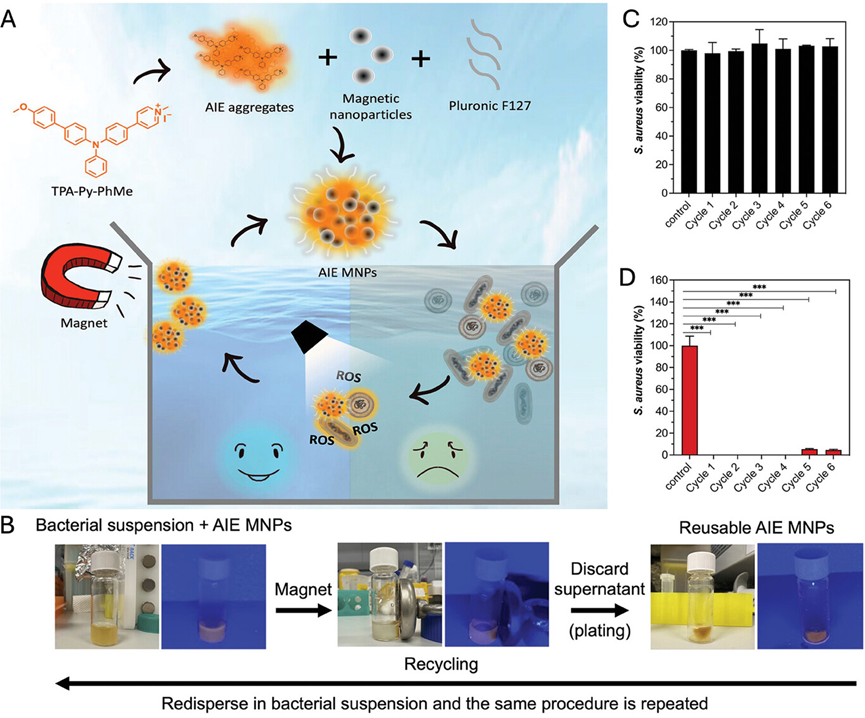
图22.AIE磁纳米粒子的制备及其在水体中细菌光动力灭活可持续回收过程示意图
【自清洁织物】
图23描述了一种自清洁可穿戴口罩的开发,该口罩利用AIE(聚集诱导发光)光敏剂(TTCP-PF6)来灭活呼吸道病原体。研究中,通过模拟口罩捕获含菌气溶胶的过程,展示了在低功率光照射或模拟太阳光下,AIE光敏剂能够产生ROS(活性氧),有效杀灭口罩纤维间捕获的细菌。此外,通过CCK-8细胞活性实验验证了该口罩材料对正常肺和皮肤细胞的生物相容性,表明其对人体细胞无毒性。这些结论证实了将AIE光敏剂集成到可穿戴设备中,可以赋予其自清洁功能,减少环境污染,并防止传染性细菌的再传播,为预防和控制通过呼吸道传播的疾病提供了一种新的策略。
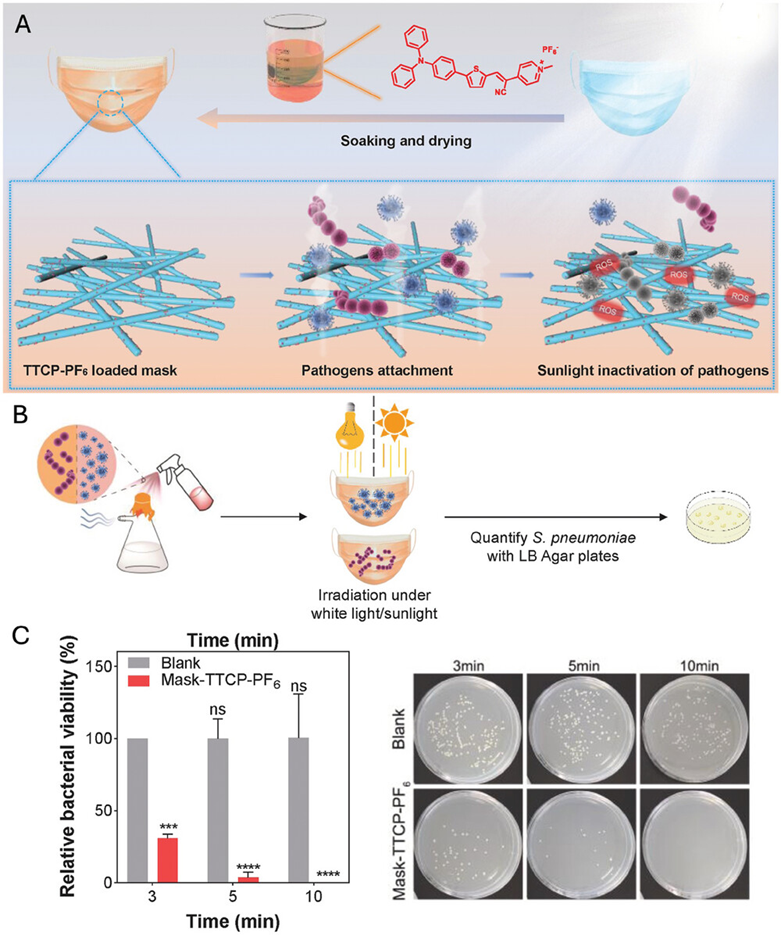
图23.自清洁织物
【细菌检测】
图24展示了基于AIE(聚集诱导发光)材料的侧流免疫分析(LFIA)技术,用于快速检测食品样本中的大肠杆菌O157:H7。研究中开发了一种双读出侧流免疫分析试纸,能够通过比色和荧光两种方式进行检测,其中荧光读出提供了更低的检测限。通过将AIE纳米粒子(BAPFNPs-LFIA)与抗体结合,实现了对目标细菌的高特异性识别。实验结果表明,该方法在检测牛奶和果冻样本中的E. coli O157:H7时具有较高的灵敏度和准确性。此外,还介绍了一种基于磁纳米粒子(MANP)的侧流免疫分析方法,用于结核病的快速诊断,通过磁性富集血液中的生物标志物,提高了检测的灵敏度。
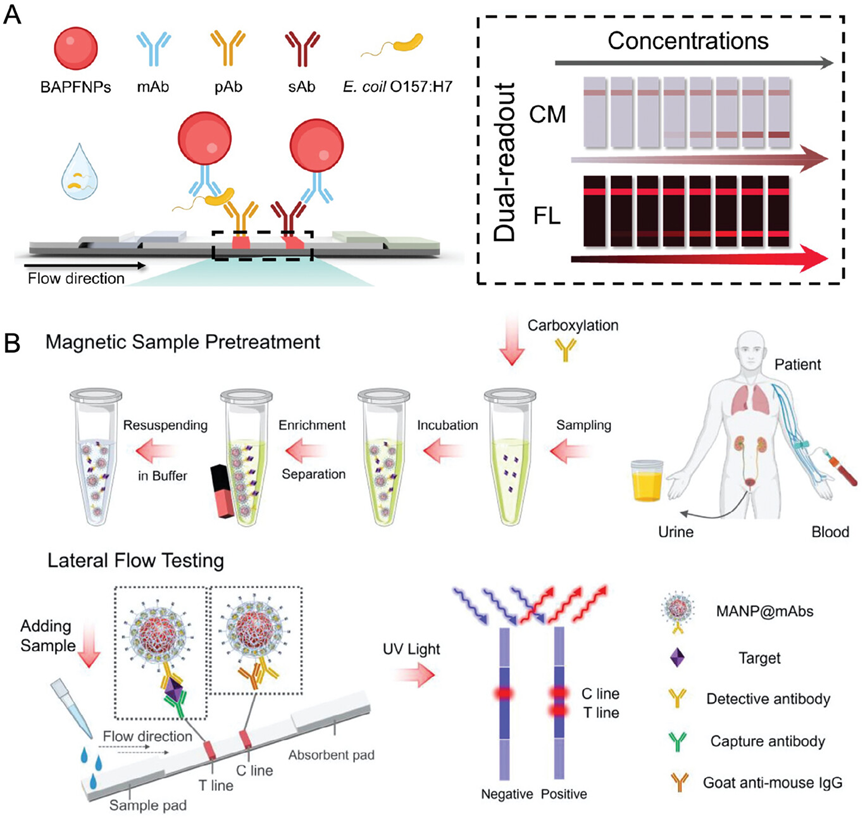
图24.细菌检测
【细菌筛选】
图25介绍了一种基于AIE(聚集诱导发光)材料的高吞吐量细菌检测、抗生素敏感性测试和抗生素筛选方法。该方法利用了一种名为pyone-TPE的探针,它含有一个活性炔基团,能够与细菌裂解后释放的可点击生物物质进行点击生物缀合,产生强烈的荧光信号。这种信号放大策略使得检测灵敏度显著提高,能够检测到低至0.6到4.0 × 103 CFU mL-1的细菌浓度。此外,通过观察抗生素处理后荧光信号的增强程度,可以评估细菌对不同抗生素的敏感性。
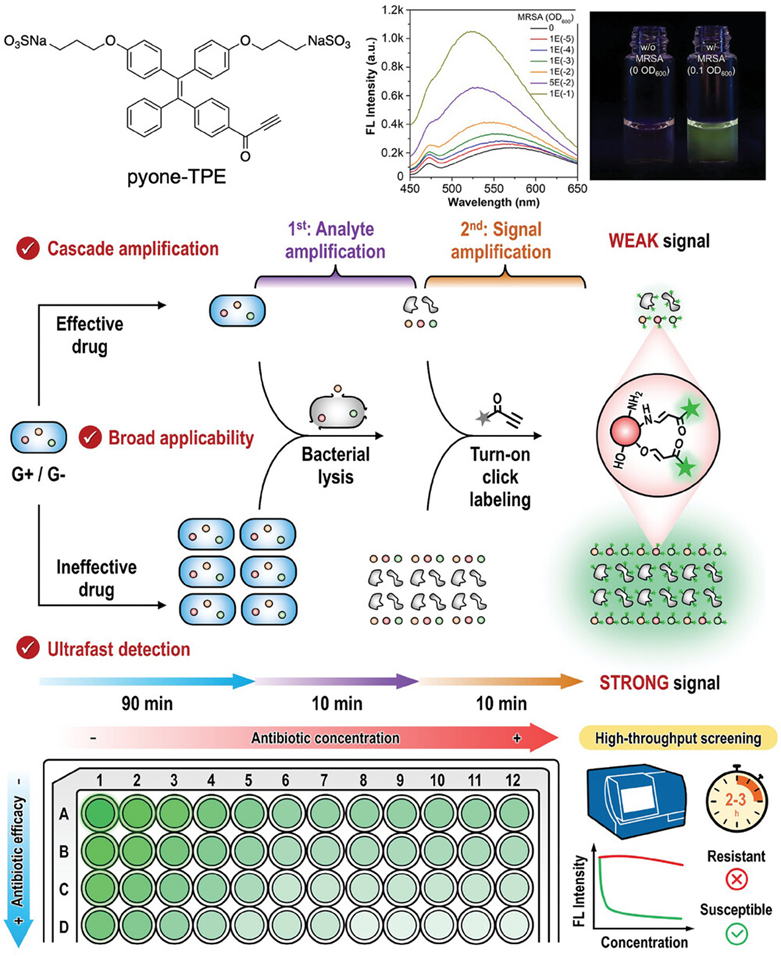
图25.pyone-TPE的化学结构,以及pyone-TPE在不同细菌浓度下荧光光谱和在365 nm紫外灯下的照片
【疾病治疗】
图26展示了两种不同的AIE(聚集诱导发光)材料在皮肤伤口敷料中的应用。第一种是含有AIEgen、姜黄素和二氧化锰的热敏水凝胶,它能够在近红外光照射下产生光热转换,促进皮肤伤口愈合。第二种是含有AIEgen的聚己内酯溶液,通过电纺技术制成的纳米纤维敷料,它同样展现出良好的生物相容性和显著的抗菌效果,有助于减少炎症并加速伤口愈合过程。这些研究结果表明,AIE材料集成的伤口敷料不仅能够有效地清除细菌,还能够促进伤口的快速愈合。
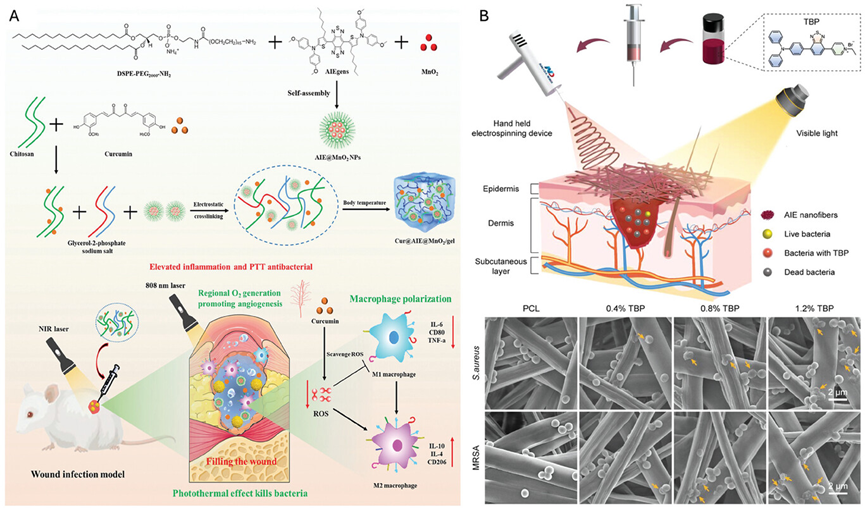
图26.含有AIE光敏剂、姜黄素和二氧化锰的热敏水凝胶的制备示意图
图27介绍了两种基于AIE(聚集诱导发光)材料的抗菌策略。第一种策略利用了AIE光敏剂TBTCP-PMB修饰的磁性纳米粒子,通过其产生的活性氧(ROS)来捕获和灭活血液中的细菌,从而治疗脓毒症。第二种策略则采用了AIE光敏剂TBTCP-PMB与噬菌体的结合体,通过噬菌体的特异性识别和AIE材料的光动力效应,实现了对特定细菌的快速检测和高效灭活。
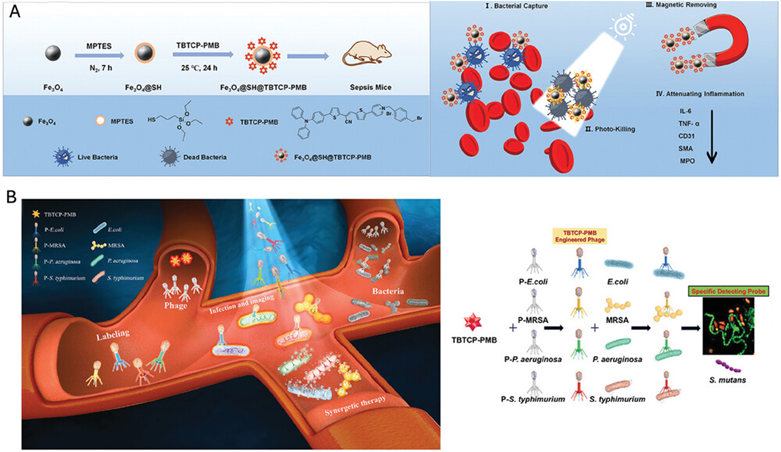
图27.AIE光敏剂基磁性纳米粒子的制备和光动力血液消毒处理败血症的示意图
【结核病治疗】
图28展示了一种仿生AIE(聚集诱导发光)纳米粒子介导的结核病治疗策略。这种策略利用了巨噬细胞膜涂层的AIE纳米粒子,通过特定的受体-配体相互作用靶向并渗透到结核杆菌所在的肉芽肿中。在1064纳米激光照射下,这些纳米粒子能够产生光热效应,精确杀死结核杆菌,同时减少肺部病理损伤和炎症。
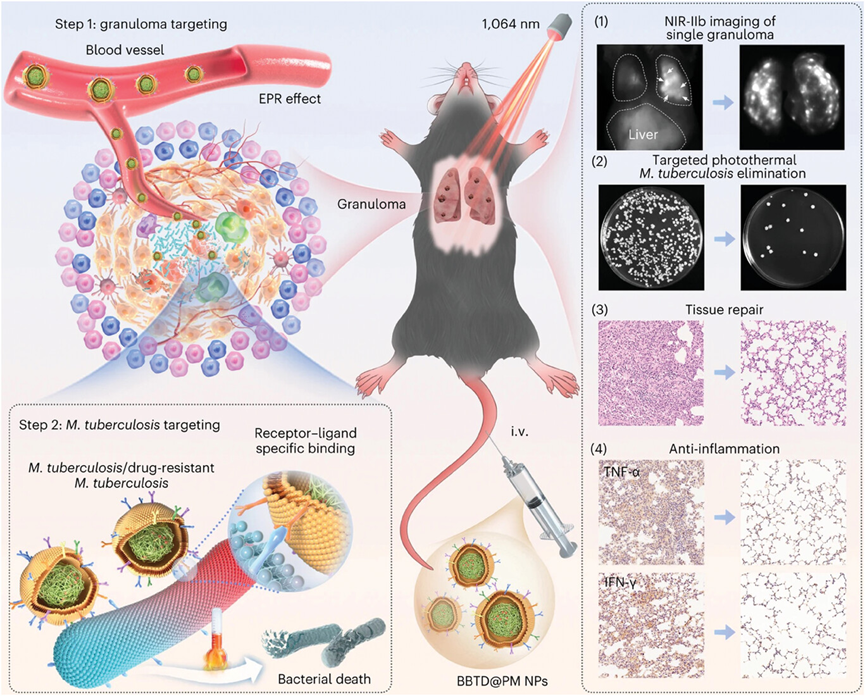
图28.结核病治疗
【AIE 材料和细菌的 5 种协同应用】
图29描述了AIE(聚集诱导发光)材料与细菌结合用于癌症治疗的策略。AIE材料通过代谢标记或静电吸引的方式与细菌结合,使细菌能够携带AIE材料并靶向肿瘤细胞。例如,通过D-Ala-TPApy标记的细菌能够选择性地在肿瘤区域积累,结合光动力治疗(PDT)和免疫治疗来增强治疗效果。此外,TDNPP包裹的活细菌能够作为载体,将光敏剂直接传递到癌细胞内部,实现精准的癌症治疗。
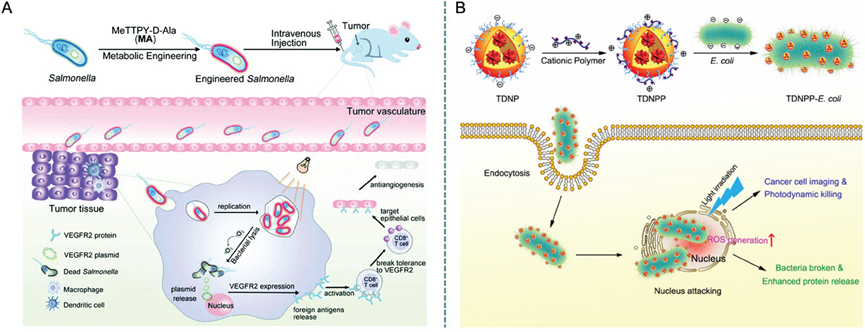
图29.TDNPP包覆的活E. coli的制备和纳米粒子包覆的活E. coli在细胞内运输光敏剂的示意图
图30介绍了AIE(聚集诱导发光)材料TPBA和APO在提升蓝细菌(Synechococcus)光合作用效率方面的应用。这些AIE材料能够吸收紫外线并发出强烈的绿色荧光,其发出的绿光被蓝细菌吸收,从而促进光合作用过程中的光捕获、光反应、ATP合成和碳固定。实验结果表明,TPBA或APO的存在显著增强了蓝细菌在相同光照条件下的生长,这一发现为利用AIE材料提高光合作用效率和促进生物能源生产提供了新的思路。
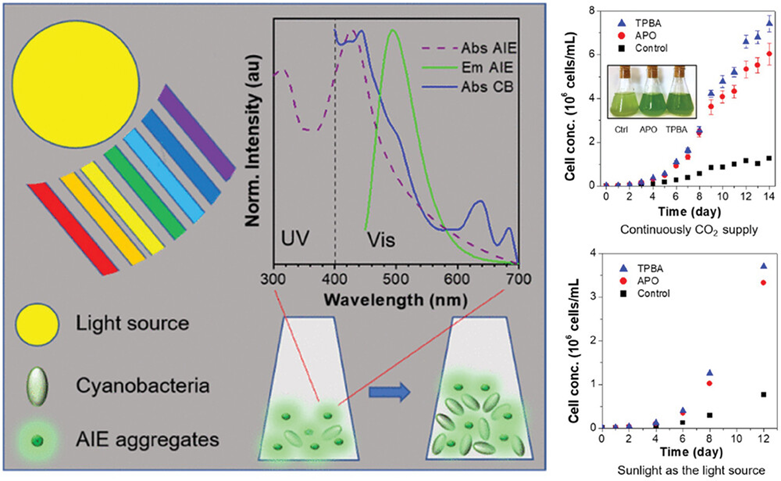
图30.AIE聚集体(TPBA或APO)显著增强蓝细菌生长的示意图
【小结】
该研究总结了聚集诱导发光(AIE)材料在细菌研究中的发展趋势,强调了设计AIE材料时考虑其与细菌的相互作用机制的重要性,并探讨了AIE材料在抗菌策略、疾病治疗和环境消毒等多个领域的应用潜力。论文指出,通过深入理解AIE材料与细菌之间的相互作用,可以为开发新的抗菌疗法和提高疾病诊断准确性提供科学依据,同时展望了AIE材料在未来细菌学研究中的发展方向,包括利用AIE材料与细菌的协同作用来实现增强的治疗效果和环境应用。
原文链接:
https://doi.org/10.1002/adma.202407707
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#抗菌策略# #细菌研究# #AIEgens#
0