Vax-Innate:激活先天免疫优化肿瘤疫苗
2024-11-16 小药说药 小药说药 发表于上海
免疫疗法用疫苗激活免疫系统杀肿瘤。阐述现有肿瘤疫苗临床结果、静脉注射疫苗优势、重塑 TME 策略,提出 “Vax - Innate” 模式,强调考虑免疫景观对优化疫苗的重要性。
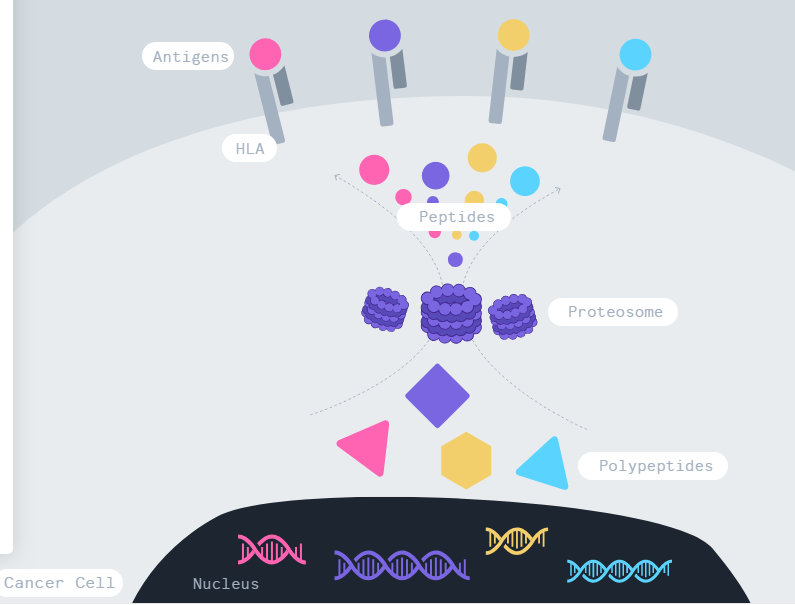
免疫疗法已经成为治疗癌症的一种革命性方法,通过动员免疫系统,特别是T细胞,来控制和杀死肿瘤细胞。肿瘤部位免疫细胞的组成对基于免疫的治疗反应有重大影响。TME有三种主要的免疫表型:以免疫细胞缺乏为特征的免疫沙漠肿瘤;免疫排斥性肿瘤,其特征是存在抑制性基质,防止T细胞与肿瘤细胞直接接触;以及可能由于慢性抗原刺激或抑制性受体如CTLA-4和PD-L1存在而导致T细胞耗竭为特征的炎症肿瘤。
治疗性肿瘤疫苗接种的主要目的是增加具有足够覆盖面和增强活性的肿瘤特异性T细胞。肿瘤中T细胞的募集和功能由组成TME的各种细胞调节,包括基质细胞、内皮细胞和先天免疫细胞,包括单核细胞、巨噬细胞、树突状细胞、中性粒细胞和自然杀伤细胞。TME的组成可以根据环境因素发挥多效性和截然相反的功能,因此,TME的靶向调节必须评估刺激和抑制因素,以实现支持T细胞浸润和功能的“有利”TME。
基于这些考量,这里提出了一种优化肿瘤疫苗的新方法,该方法侧重于通过诱导全身先天免疫刺激来增强T细胞免疫,以提高疫苗产生的肿瘤特异性T细胞杀死肿瘤细胞的能力。除了增强淋巴器官中的T细胞外,与疫苗共递送的佐剂还可以诱导全身先天免疫激活,从而调节TME以改善T细胞功能。这种“Vax-Innate”模式可能最适合用于针对具有抑制性TME的晚期转移性癌症的肿瘤疫苗。
目前的肿瘤疫苗在预防完全肿瘤切除后疾病复发方面可能非常有效,这可能是由于肿瘤负荷低、T细胞与肿瘤细胞比率高以及TME对T细胞功能的影响很小。
mRNA-4157/V940是一种RNA脂质纳米颗粒(LNP)疫苗,在切除黑色素瘤患者的IIb期研究中(KEYNOTE-942,NCT03897881),与抗PD1抗体(pembrolizumab)联合肌肉注射进行了测试。中期数据表明,与单独接受pembrolizumab的患者相比,联合治疗将复发或死亡风险降低了44%。目前尚未确定免疫反应与临床益处之间的关联。Autogene cevumeran是一种脂质体mRNA疫苗,在一项切除胰腺导管腺癌患者中进行了I期临床试验(NCT04161755),静脉注射与抗PD-L1抗体(atezolizumab)和化疗联用,16名患者中有8名出现了新发免疫反应,无复发生存期显著延长。
在这些基于mRNA的临床试验之前,在完全手术切除后的6名晚期黑色素瘤患者中进行了基于肽的肿瘤疫苗试验(NCT01970358)。结果显示,在25个月的中位随访中,四名患者没有疾病复发,而另外两名患者复发。
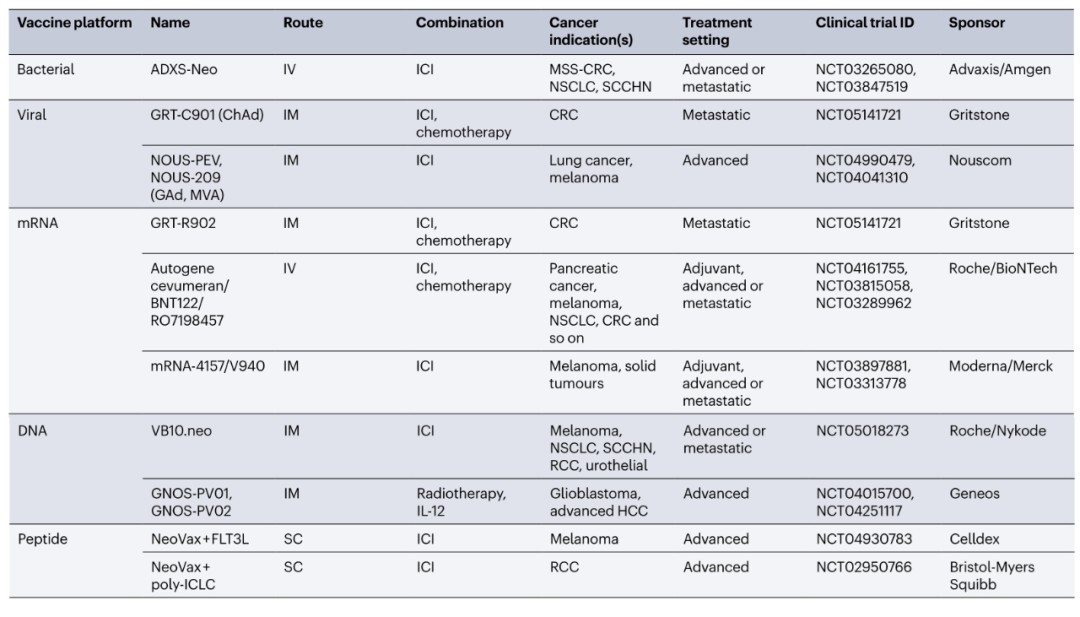
肿瘤疫苗也在晚期癌症患者中进行了测试:在一项针对晚期癌症(包括MSS-CRC、NSCLC和胃食管腺癌)患者的I/II期临床试验(GRANITE,NCT03639714)中,使用黑猩猩腺病毒ChAd68和自扩增mRNA疫苗联合nivolumab和ipilimumab进行了测试。结果显示,治疗后诱导了肿瘤特异性T细胞反应,但大多数患者仍具有进展性疾病。同样,另一项在I/II期研究中,Autogene cevumeran尽管诱导了循环中7.3%的特异性CD8+T细胞,但似乎只有少数晚期实体瘤患者从中受益。
这些数据表明,即使通过肿瘤疫苗接种产生的大量T细胞反应也可能不足以在晚期肿瘤环境中控制疾病。在这个肿瘤阶段,可能有几个限制因素:接种疫苗后产生T细胞反应的时间不足;肿瘤与T细胞的比例太大;以及免疫抑制肿瘤微环境。因此,治疗可能需要额外的策略来改善有效的T细胞反应,并克服可能限制癌症疫苗成功的抑制性TME。
肿瘤疫苗的一个关键和未充分探索的考虑因素是给药途径。事实上,免疫途径会对免疫力和疫苗有效性产生深远影响。常规肌肉内(IM)或皮下(SC)注射DNA、RNA或肽和佐剂疫苗会导致局部先天免疫激活,促进注射部位附近疫苗引流淋巴结中的T细胞启动。相比之下,静脉注射(IV)疫苗可以诱导脾脏(最大的淋巴器官)和其他淋巴结中的T细胞启动,并提供全身先天刺激。
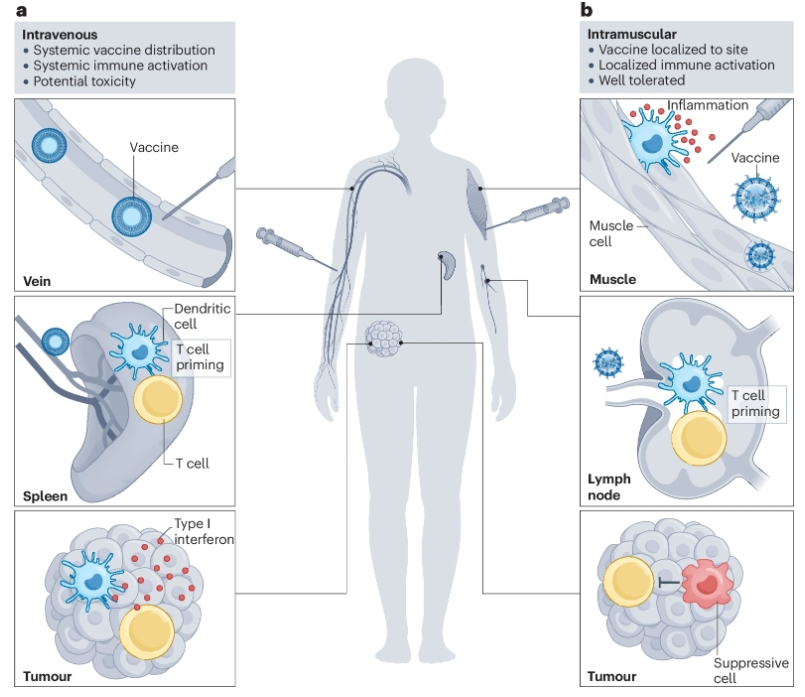
在小鼠中,与SC给药相比,静脉注射合成长肽和聚ICLC可产生高强度的细胞毒性T细胞反应,并提高抗肿瘤疗效。同样,与SC或IM给药相比,静脉注射与TLR7/8激动剂偶联的自组装纳米粒子肽疫苗(SNP-7/8a)在临床前肿瘤模型中的疗效有所提高。此外,静脉注射能够诱导更高频率的干细胞样CD8+T细胞,这些细胞通过产生更多的效应细胞对ICI做出反应,促进抗肿瘤疗效的提高。有趣的是,SC或IM疫苗产生的终末分化CD8+T细胞也能够促进肿瘤消退,但需要在同一区域静脉给予先天免疫刺激。
在肿瘤疫苗的开发过程中,特别是在实体瘤中,需要克服的一个重要挑战是TME中存在可以限制T细胞功能的抑制途径。
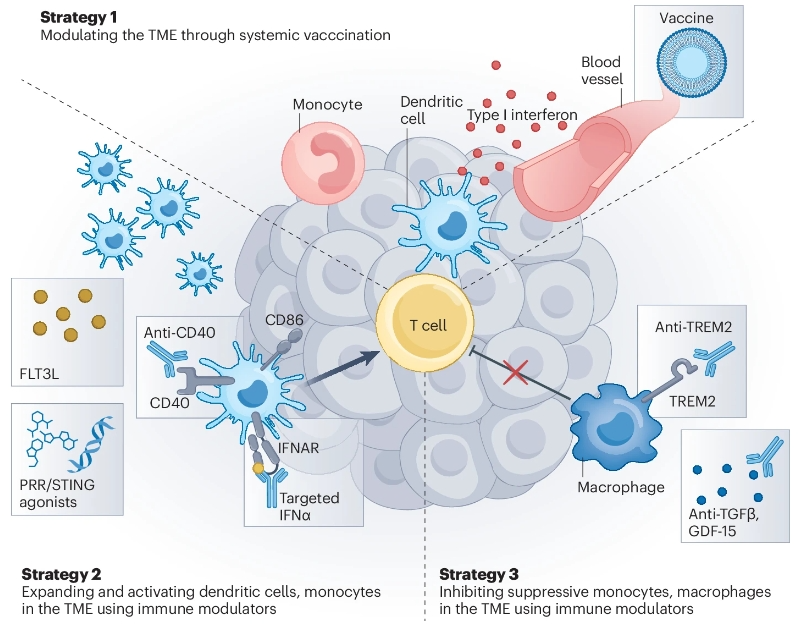
策略1:通过全身疫苗接种调节肿瘤相关巨噬细胞和单核细胞
在SNP-7/8a(肽疫苗)或黑猩猩腺病毒ChAdOx(病毒疫苗)临床前研究中,静脉注射与SC或IM给药相比,促进了更优的抗肿瘤反应。使用单细胞RNA测序发现,静脉注射疫苗改变了肿瘤中的髓系细胞,促炎的Plin2+巨噬细胞群取代了表达免疫抑制基因特征的单核细胞亚群。令人震惊的是,只有静脉注射疫苗才能引起这种变化;SC给药对TME没有影响,也不会促进抗肿瘤疗效。由IV注射疫苗介导的抗肿瘤反应是CD8+T细胞依赖性的,需要全身I型干扰素的产生来调节TME中的单核细胞/巨噬细胞组成,并上调与抗原呈递相关的基因。
策略2:通过免疫调节剂靶向树突状细胞以促进T细胞功能
有许多先天免疫细胞调节剂可以重编程TME中的髓系细胞,以使T细胞具有细胞毒性功能。免疫刺激剂,如I型干扰素、病原体识别受体(PRR)、cGAS-STING和CD40激动剂,可促进髓系细胞的激活,并已被证明在临床前模型中有效。此外,它们可以与FLT3配体(FLT3L)等生长因子结合,以扩大树突状细胞群。对于许多实体瘤,基于疫苗的疗法可能需要重塑TME以增强T细胞功能,以获得最佳的抗肿瘤效果,这可能比目前ICIs的联合疗法更有优势。最佳策略可能取决于通过伴随诊断测试对个体患者TME的表征,以确定合适的组合伴侣。
策略3:通过靶向治疗抑制巨噬细胞的抑制功能
广泛靶向所有单核细胞和巨噬细胞的抗体,如抗CSF1R,的尝试一直没有成功。选择性靶向促瘤活性的TAM亚群可能比阻断所有巨噬细胞更可取。TREM2在TAM和单核细胞来源的巨噬细胞上的表达升高与患者较差的临床结果有关,因此,阻断或耗竭TREM2+巨噬细胞通过使肿瘤对抗PD-L1疗法敏感可以提高抗肿瘤疗效。
调节巨噬细胞的另一种策略是阻断肿瘤衍生的细胞因子,如TGF-β或GDF-15,这些细胞因子会向巨噬细胞发出信号,使其获得更多的抑制功能。鉴于TGF-β的多效性功能,使用TGFβ调节剂的一个主要挑战是无意中抑制具有肿瘤抑制活性的内源性途径。最近,GDF-15被确定为可能导致癌症早期发展的重要因素,其为调节TAM提供了另一个靶点,以改善对免疫治疗的反应。
肿瘤疫苗的优化可以过调节两个条件来进行:(1)产生具有高规模、覆盖面和质量的新抗原特异性T细胞,以及(2)重编程TME以诱导树突状细胞的激活和抑制性单核细胞/巨噬细胞的调节。“Vax-Innate” 模式通过激活先天免疫系统,可以达到这两个目的,应用于晚期转移性肿瘤。
先天疗法调节TME的疗效很可能在很大程度上取决于肿瘤本身的成分。肿瘤是高度异质性的,不同癌症的肿瘤细胞组成不同,并受癌症病理起源、肿瘤进展和可能改变TME的先前治疗方案的影响。因此,在设计基于免疫的疗法时,考虑免疫景观至关重要。空间基因组学和显微镜的技术进步可用于对患者独特的TME进行个性化筛查,以确定哪些患者受益于以调节其TME为重点的治疗策略,从而提高疫苗介导的T细胞免疫力。
参考文献:
1.Vax-Innate: improving therapeutic cancer vaccines by modulating T cells and the tumour microenvironment. Nat Rev Immunol.2024 Oct 21.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#肿瘤疫苗# #免疫疗法#
4