深度思考:如何看待间充质干细胞的免疫调节
2022-11-14 干细胞者说 干细胞者说
间充质干细胞(MSCs)对参与固有免疫和适应性免疫的免疫细胞都有一定的不同类别的影响。但笔者认为,目前依然混淆不清,不能解释临床应用研究的现象。
 首发:间充质干细胞
首发:间充质干细胞
众所周知,间充质干细胞(MSCs)对参与固有免疫和适应性免疫的免疫细胞都有一定的不同类别的影响。但笔者认为,目前依然混淆不清,不能解释临床应用研究的现象。
因此,本文梳理一下这些容易混淆的问题,抛砖引玉,期待能引起大家的重视,共同推动MSCs免疫特性功能的研究。
-01-间充质干细胞不等同于免疫抑制剂
大部分动物实验和体外实验数据表明,MSCs对 T 细胞、B细胞、NK细胞、DC细胞、巨噬细胞都是抑制作用,对Treg细胞是促进作用。即总体而言,MSCs对免疫系统是负向作用,抑制免疫应答、诱导免疫耐受。如果这个理论是正确的,那么MSCs就几乎等同于免疫抑制剂,MSCs的临床应用就会增加机体感染的风险和肿瘤高发的风险。
实际上,大样本临床研究证明了MSCs治疗的安全性。多项临床试验,发现MSCs治疗组和对照组的感染率没有差异,明确提出MSCs治疗不会增加感染的风险,而且MSCs治疗组和对照组在恶液质和成瘤方面没有差异。长期观察的临床试验,也没有发现病人增加感染和MSCs致瘤的现象。我国福州总医院的团队在国际顶级期刊 JAMA 发表文章,首次通过随机对照临床试验来证实自体BMSCs在实体器官肾移植后发挥免疫抑制作用,起到类似免疫抑制剂的治疗效果。在移植后一年的随访时间内,MSCs治疗组的肾移植患者发生更低的急性排斥反应和感染的风险,同时促进了更好的肾功能的恢复。
因此,MSC并不等同于免疫抑制剂。
新冠疫情以来,我国和多国相续开展MSCs治疗COVID-19的临床研究,初步证明了静脉回输MSCs治疗COVID-19是安全有效的,尤其是降低危重患者的死亡率和促进肺功能恢复。
2020年5月,美国梅奥诊所发现经MSCs治疗后,COVID-19患者的放射学结果、肺功能(肺顺应性、潮气量、PaO2/FiO2比值、肺泡毛细血管损伤)和炎症生物标志物水平均有改善的趋势。即使COVID-19患者体内存在新冠病毒,MSCs的使用反而提高了机体免疫细胞对新冠病毒的清除,同时促进了炎症的消退和损伤组织的恢复。
综上所述,经MSCs静脉输注后,并没有抑制免疫应答反应,并没有削弱免疫清除能力(这一点很重要)。因此,MSCs并不同于免疫抑制剂。越来越多的数据证明,MSCs可以成为宿主导向疗法的一种重要武器,可以改善宿主细胞对病原体的清除反应,防止或减少抗生素耐药性等待。
-02-间充质干细胞对免疫的正向作用
共培养将MSCs与T细胞,MSCs对T细胞的激活抑制是暂时性的;如果移除MSCs,那么T细胞能再次对抗原刺激产生应答增殖。在病毒感染期间,MSCs并不抑制CD8+T淋巴细胞功能,而是通过释放IFN-γ促进CTL反应。
在白俄罗斯开展MSCs治疗耐药性肺结核患者的临床研究,临床数据证明了MSCs治疗可以极大地改善耐多药肺结核患者的预后,75%的患者得到治愈。有意思的是,MSCs回输后,大部分结核患者免疫细胞在抗原刺激下产生更多的IFN-γ,提示免疫细胞的功能得到一定程度的恢复,并没出现免疫抑制效应。
MSCs可以上调Treg细胞的数量,从而对炎症性心肌病的心脏发挥保护作用。我国的大样本临床研究发现,类风湿性关节炎患者普遍存在Treg细胞减少,经过MSCs治疗后,Treg细胞增加的患者,其RA相关的临床症状体征缓解非常明显,MSCs的疗效得到较好地维持。
-
2007年,瑞典卡罗琳斯卡大学医院的团队就发现MSCs促进B细胞增殖和分泌免疫球蛋白,而且MSCs和B细胞直接接触的促进效果优于非接触的效果
-
2008年,意大利研究者发现健康人和SLE患者的BMSCs均可以在Toll样受体9激动剂的刺激下,促进了记忆B细胞的增殖和向浆细胞的分化和免疫球蛋白(IgG和IgM)的分泌。
-
2012年,我国科学家证明人脐带MSCs促进人B细胞的增殖和分化成熟,进而促进免疫球蛋白的分泌;小鼠BMSCs具有同样的作用效果,而且作用机制涉及PGE2的分泌。
巨噬细胞是非常关键的免疫系统参与者,在组织修复、内稳态和清除细菌感染等方面发挥作用。在MSCs分泌的细胞因子作用下,单核/巨噬细胞和中性粒细胞的吞噬和杀伤能力增强。
经MSCs治疗后,感染组织中的巨噬细胞表现为以M2表型为主,而未经MSCs治疗的感染组织中主要含M1巨噬细胞。MSCs促使巨噬细胞吞噬功能增强,主要调节依赖于PGE2和磷脂酰肌醇3-激酶,这两种激酶能够有效促进巨噬细胞吞噬未调理的细菌。MSCs还可以通过纳米隧道管的结构直接给巨噬细胞输送线粒体,从而提高了巨噬细胞的吞噬能力。MSCs增强巨噬细胞的吞噬活性,这部分依赖于对含有MSCs线粒体的胞外小泡的摄取。
MSCs具有很强的支持造血的功能,也就是说MSC能促进造血干细胞更好地分化发育为各种血液细胞,也包括各种免疫细胞,所以MSCs对整体免疫系统并不是全是负向作用(抑制)。
-03-免疫调节是否需要直接接触
还有一种观点认为,细胞与细胞之间通过黏附分子(ICAM-1和VCAM-1)来结合接触,是MSCs发挥免疫抑制作用的前体条件。意大利科学家最早证明:MSCs抑制T细胞的增殖是不需要依赖细胞之间的相互接触。随后美国、意大利和德国等不同实验室利用transwell实验研究也证明,MSCs抑制T细胞的激活是不需要细胞之间的相互接触。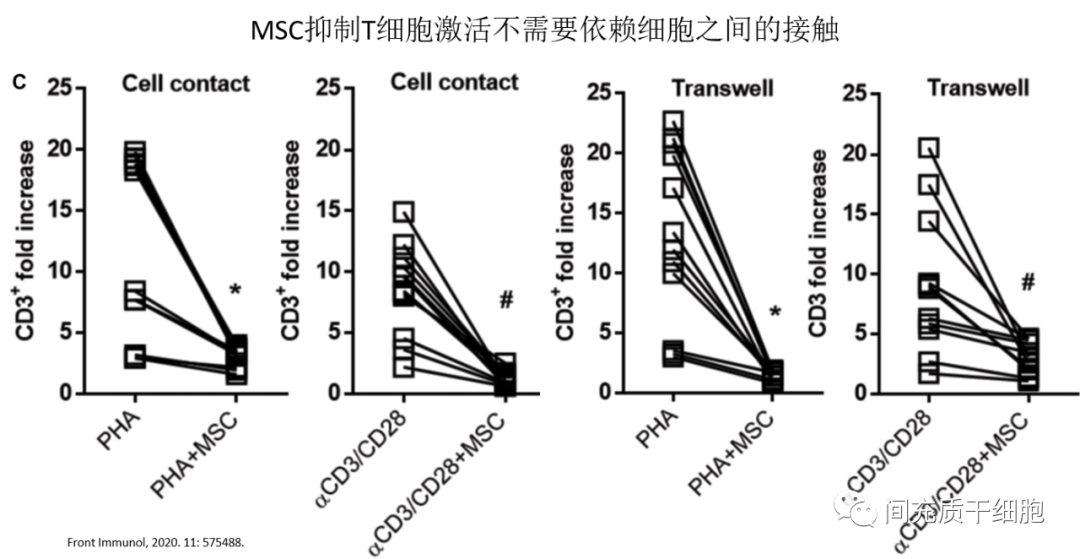 可溶性诱导因子
可溶性诱导因子
既然MSCs的免疫抑制功能不需要依赖细胞之间的相互接触,那就理应存在可溶性因子,发挥抑制T细胞激活的作用。那么,可溶性因子有哪些?
从最早的HGF和TGF-β,到IDO、NO、HO-1、PGE2、HLA-G5、Galectin-1和Sema-3A、Galectin-9等。如果这些因子都参与发挥了作用,那么这些因子背后的共同点是什么?
2006年,有研究证明IFN-γ诱导MSCs表达IDO,从而增强了MSCs对T细胞的抑制能力。也有实验数据发现阻断IDO,并不能逆转MSCs对T细胞的抑制作用。爱尔兰研究团队发现小鼠BMSCs并不表达PD-1或者PD-L1/PD-L2、IDO,但是IFN-γ能刺激MSCs表达PD-L1和IDO,从而增强MSCs的免疫抑制功能。
2007年,日本Katsutoshi Ozaki教授团队发现NOS-/-小鼠来源的BMSC的免疫抑制能力下降,不能显著地抑制T细胞的增殖;MSCs和T细胞的相互作用,诱导MSCs的iNOS表达,增加NO 的产生,从而抑制了T细胞的增殖。我国科学家进一步证明了敲除了iNOS的小鼠BMSCs,或者敲除了IFN-γ受体1的MSCs,都失去了免疫抑制能力,不能有效治疗小鼠的GVHD。但是,2007年的另一篇文章证明,IFN-γ受体1缺乏的MSCs,不表达IDO,而且MSCs抑制PBMC(绝大部分为免疫细胞)的效果不受IFN-γ受体1的影响。谁是谁非?
TNF-α和IFN-γ联合刺激BMSCs,诱导MSCs表达iNOS,从而产生NO,这些NO诱导淋巴细胞凋亡。随后发现TNF-α和IFN-γ联合刺激BMSCs,诱导MSCs表达iNOS产生的NO反过来也能诱导MSCs的凋亡。这些实验研究的数据结果表明,NO作为血管舒张的小分子,能诱导淋巴细胞和BMSCs的凋亡,损伤免疫系统和机体的修复能力。如果这个理论成立,那么基于第二信使NO小分子开发出来的相关药物(伟哥)就可能损伤免疫系统和修复能力的(好可怕)。实际上,这个实验缺乏“NO诱导MSCs凋亡的作用机制”的数据。
另外,MSCs细胞表面没有TNF的结合点,那么为何还有数据证明TNF能对MSCs有损伤作用呢?相类似的情况,MSCs并不表达LPS的受体(CD14),那么为何还能看到LPS对MSCs产生影响的实验数据?对这些实验数据的两个解释之一,就是需要证明TNF-α和LPS能分别各自诱导MSCs的TNF膜受体和LPS受体的表达。
目前没看到MSCs分泌的TSG-6直接抑制T细胞激活的实验证据,但是较多的实验数据证明TSG-6具有抗炎作用。MSCs分泌的TSG-6还可将巨噬细胞极化为抗炎M2表型。在平皿培养中,MSCs不表达TSG-6,而当MSCs处于3D球体中培养时,则高水平表达TSG-6。但是,不少团队证明骨髓、羊膜、脂肪和脐带血来源的MSCs表达TSG-6,介导抗炎保护作用。TSG-6表达减少的小鼠和人MSCs,其免疫抑制能力也同时减弱。因此,有观点认为TSG-6可以作为反应MSC免疫抑制能力的一个指标。不过,也有私下交流的数据提示MSCs表达很低水平的TSG-6,但依然具有很强的免疫抑制功能。
可溶性IL-2R,是一个易被忽视的发挥抑制T细胞激活的可溶性因子。MSCs与CD4+T细胞的共培养实验发现高表达IL-2R,可中和T细胞分泌的IL-2。早在2002年,美国Bartholomew教授团队报道了MSCs具有抑制淋巴细胞激活的功能,在体外实验MSCs和T细胞共培养中,额外添加IL-2可以部分地逆转MSCs的抑制作用。这提示当IL-2的激活力量大于MSCs的抑制作用,那么最终效果就是促进T细胞的增殖。
有观点认为人类、猴子和猪的MSCs通过表达大量的IDO来发挥免疫抑制作用,而啮齿动物和兔子MSCs通过表达大量的iNOS来发挥免疫抑制作用。但这个观点和支持数据解释不了人类MSCs抑制动物免疫细胞的现象(跨种属的抑制作用),所以这个观点非常值得商榷。
-04-是否具有抗原提呈功能
早在2003年,美国波士顿儿童医院William T. Tse教授团队证实MSCs并不具有抗原提呈细胞(APC)的功能,MSCs也不能诱导T细胞的凋亡。
多个动物实验发现:输注后的异体MSCs并不是完全的免疫逃逸,而是存在一定的抗原特性,能诱导机体产生免疫记忆,包括记忆性CD4+T和记忆性CD8+T细胞;异体MSCs回输到体内后,还是能被免疫系统所识别并清除,从而导致异体MSCs治疗效果稍微不如自体MSCs。单次注射MHC不匹配的脐带MSCs并不能诱导产生免疫反应,但是当在炎症部位注射、在同一区域重复注射或注射前用IFN-γ刺激时,MSCs具有明显的免疫原性。因此,有专家提出MSCs并不具有免疫豁免特性,而只是免疫原性很低。
MSCs本身具有低免疫原性,可以异体或跨种属使用,不会引起免疫排斥反应,只是出现机体对MSCs的清除加速。虽然MSCs抑制了T细胞的激活,但是MSCs却能促进T细胞的存活,使得T细胞处于静息状态。MSCs能分泌大量的营养性因子,具有营养支持的功能,促进受伤的组织细胞的修复,同样也能促进T细胞的存活。
非常需要注意的是,如果培养的MSCs出现纯度不够(BMSCs比较常见),那么残留杂细胞就增加了培养细胞整体的免疫原性,导致了这些细胞进入体内后,容易出现机体的免疫排斥反应。
如何判断MSCs的纯度,目前可以根据流式检测细胞表型的结果。2006年国际细胞治疗协会提出MSCs的鉴定标准,如下: -05-IFN-γ对MSC的真实作用如何
-05-IFN-γ对MSC的真实作用如何
2003年,研究者发现IFN-γ可以刺激MSCs表达MHC-II,但是MSCs并没有发挥抗原提呈细胞(APC)的功能。IFN-γ可刺激MSCs表达MHC-II,这种作用可以被TGF-β所抑制。有意思的是,MSCs本身分泌很低浓度的IFN-γ,但是分泌很高浓度的TGF-β。
因为MSCs不表达MHC II,低表达MHC I,MSCs的免疫原性很弱。如果用IFN-γ刺激MSCs,可上调MHC I和MHC II,这可能会MSCs在具有免疫能力的宿主中容易发生排斥反应。MSCs细胞表面高表达MHC-I(IFN-γ促进MHC-I类分子的表达),则MSCs容易被CD8+CTL细胞所杀伤。如果MSCs的细胞表面低表达或者不表达MHC-I,则MSCs容易被NK识别和杀伤。
其实,不管是异体还是自体,MSCs都是短暂性逃逸免疫系统的监视,终究是被免疫系统所识别,只是异体比自体更容易被免疫系统所识别和清除。
2006年,有研究者发现低水平的IFN-γ能提高MSCs的MHC-II表达,但随着IFN-γ水平的增加,MSC的MHC-II表达逐渐减少。但通过文章的数据分析发现,实验用到的BMSC,正常培养下,MSCs就高表达MHC-II(至少80%-90%),那么,这些细胞已经不是MSCs了,MSCs本身是低表达MHC-II(不超过2%的HLA-DR)。很奇怪的是,这篇文章能够得以发表,而且不少专家还认可这篇文章的数据和结论。会不会是这些专家都忘记了MSCs的鉴定标准?这里有图有真相: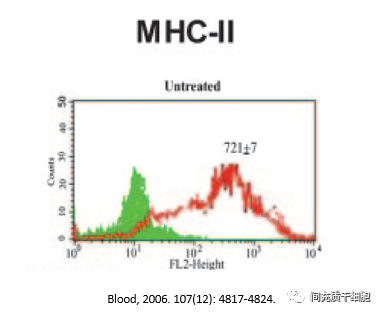 还有一种观点认为,MHC II的表达与MSCs的疗效没有必然的联系。
还有一种观点认为,MHC II的表达与MSCs的疗效没有必然的联系。
-
给大鼠心肌缺血部位局部注射大鼠骨髓MSCs后,明显提高了大鼠心肌功能,同时组织病理切片检测结果发现MHC I和MHC II的表达都增加。
-
在小鼠肠炎模型,IFN-γ在促进MSCs高表达MHC II的同时,也提高了MSCs的免疫抑制能力和治疗肠炎以及GVHD的效果。
需要对这些实验结果和观点需要保持谨慎的态度,MSCs的MHC II高表达,即MSC的免疫原性升高,那么所伴随而来的后果就是MSCs被机体更快速地清除,从而没法更好地发挥治疗作用。
-06-间充质干细胞免疫调节的其他问题
▉ MSCs与地塞米松
地塞米松能抑制T细胞的增殖和诱导T细胞的凋亡,MSCs也能抑制T细胞的增殖,但有趣的是,地塞米松联合MSC,地塞米松就能通过抑制STAT1的磷酸化和抑制MSCs 表达iNOS,最终促进T细胞的增殖。
这个负负得正的现象,只能解释为地塞米松在同时面对MSCs和T细胞的时候,只能优先作用于MSCs,而丢下T细胞不管。 MSCs与炎症水平
MSCs与炎症水平
2013年,国际期刊Cell Stem Cell 有一篇文章的观点认为:MSCs在低水平炎症(轻度炎症)的环境里,会促进T细胞的激活,从而会加重炎症;但是MSCs在高水平炎症(重度炎症)的环境里,才能发挥诱导Treg细胞的增殖来消除炎症。这篇文章和另一篇文章提出这样的假设:虽然MSCs在强炎症的情况下具有免疫抑制作用,但弱炎症则导致MSCs增强免疫反应。
翻译为通俗话,就是说,在轻度炎症的环境里,MSCs嫌弃炎症不够严重,要先变身为促炎细胞,让轻度炎症进展为重度炎症。然后,MSCs才能发挥抗炎的作用,消除炎症。这个观点好魔幻!!那到底对不对呢?接着看下文。
 很简单的实验可以反驳这个理论,就是建立轻症肝损伤的老鼠模型,然后给与MSCs治疗;如果MSCs治疗后,这些轻症肝损伤老鼠进展为重症肝损伤(重症肝炎),那么这个理论就成立;如果MSCs治疗后,轻症肝损伤老鼠的肝功能好转,那么这个理论就不成立。
很简单的实验可以反驳这个理论,就是建立轻症肝损伤的老鼠模型,然后给与MSCs治疗;如果MSCs治疗后,这些轻症肝损伤老鼠进展为重症肝损伤(重症肝炎),那么这个理论就成立;如果MSCs治疗后,轻症肝损伤老鼠的肝功能好转,那么这个理论就不成立。
各位爱动手的同学,可以试试,这是亲手做实验挑战大咖理论的大好机会。需要注意的一点,就是需要明确所用的治疗MSCs细胞,确实不是纯度和细胞质量很差的MSCs
MSCs的组织差异性
有研究提示:脐带和羊膜来源的MSCs的免疫调节能力明显优于骨髓和脐血来源。脂肪来源MSCs的免疫调节能力也明显优于骨髓。然而,最近的一项研究表明,脂肪来源的MSCs比来自相同供体的骨髓的免疫抑制能力略高,但是没有统计学差异。这一结果与小鼠实验一致,即来源于同一个小鼠的脂肪来源和骨髓来源的MSCs在抑制T细胞增殖的免疫抑制能力上没有差异。但是,MSCs的免疫调节和增殖潜力之间没有明显的关系。因此,不同组织来源MSCs的免疫调控能力到底哪个强,尚无明确定论。
-07-文末小结
总之,我们首先需要明确影响MSCs免疫调节能力的各种因素,然后针对性筛选出免疫调节能力较强的MSCs亚群,或者输注前先用相关因子预处理强化其免疫调节能力,最后用于适合免疫调节的适应症(如GVHD,系统性红斑狼疮,类风湿关节炎等)。
面对众说纷纭的实验结果和专家观点,您如何认为呢?笔者认为,如果细胞实验和动物实验得到的理论,不能解释临床的现象(结果),那么需要思考的应该是当前细胞和动物实验得到的理论。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







学习了
29