iNKT细胞通过增强T淋巴细胞浸润,抑制肿瘤进展相关因子富集,缓解胰腺癌肝转移
6小时前 《基因启明》公众号 《基因启明》公众号 发表于上海
这项研究揭示了iNKT细胞对PCLM的治疗潜力,并阐明了药物机制。相信在不久的将来,iNKT细胞疗法必将为胰腺癌病人带来曙光。
亮点
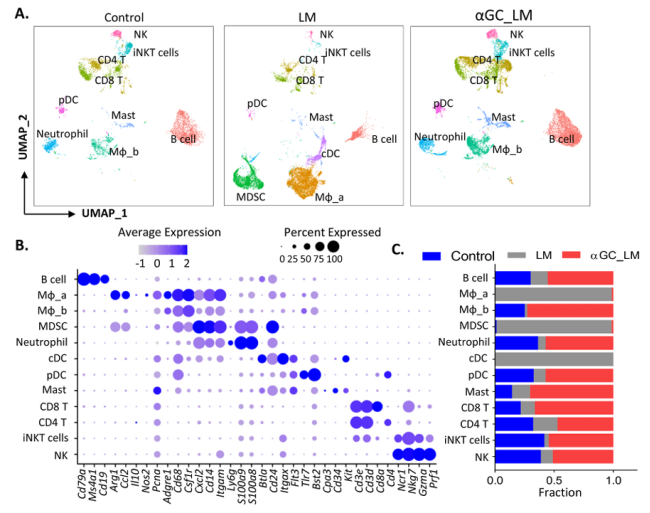
1、被α-GC激活的iNKT细胞将免疫细胞募集到肝脏,对胰腺癌肝转移(PCLM)产生抑制作用。
2、活化的iNKT细胞促进CD4 T细胞显示细胞毒性,抑制PCLM微环境中肿瘤进展相关因子的富集。
3、活化的iNKT细胞减少巨噬细胞表面肿瘤相关标记物含量,缓解肿瘤进程。

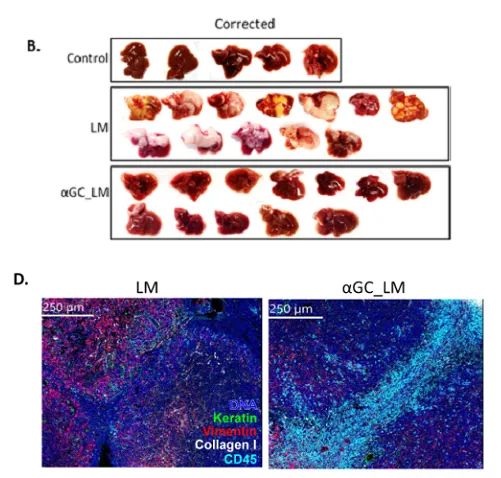
α-GC治疗抑制胰腺肿瘤肝转移
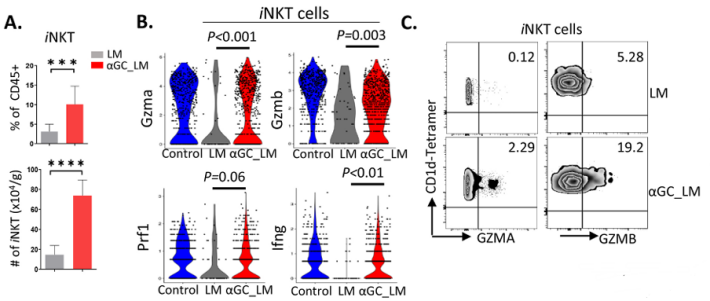
iNKT细胞在α-GC处理下显示出细胞毒性
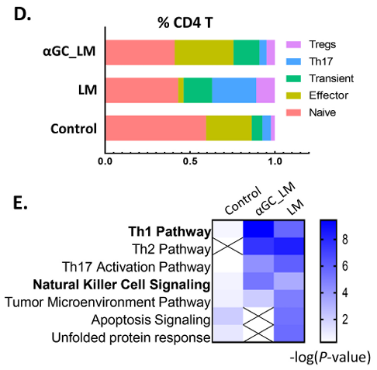
α-GC激活iNKT细胞使T细胞偏向细胞毒性
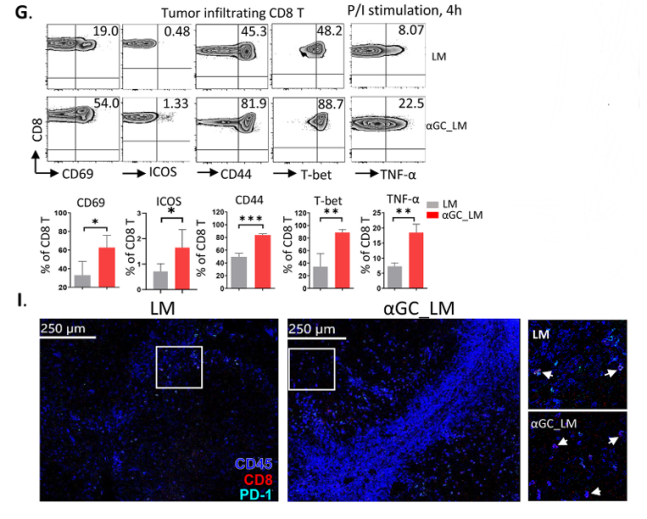
α-GC激活的iNKT细胞促进CD8 T细胞毒性并防止CD8 T细胞耗竭
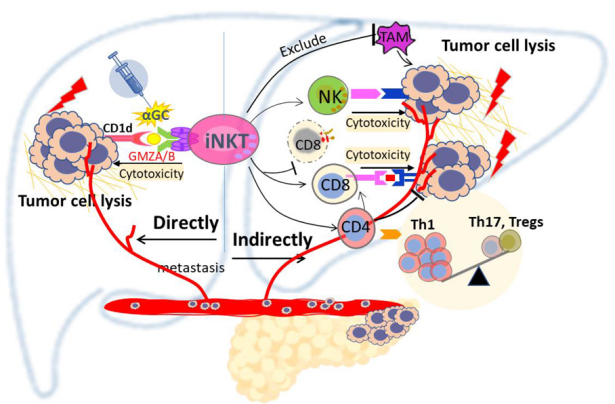
iNKT细胞介导的 PCLM 保护模型
来源:
微信公众号: 基因启明
参考文献:
Yi Q, Wang J, Liu T, Yao Y, Loveless I, Subedi K, Toor J, Adrianto I, Xiao H, Chen B, Crawford HC, Fang D, Zhou L, Mi QS. scRNA-Seq and imaging mass cytometry analyses unveil iNKT cells-mediated anti-tumor immunity in pancreatic cancer liver metastasis. Cancer Lett. 2023 May 1;561:216149. doi: 10.1016/j.canlet.2023.216149. Epub 2023 Mar 27. Erratum in: Cancer Lett. 2024 Aug 10;597:217071. doi: 10.1016/j.canlet.2024.217071. PMID: 36990268.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









前往app查看评论内容
0 0
#胰腺癌肝转移#
4