【Gynecol Oncol】恩朗苏拜单抗治疗PD-L1阳性复发或转移性宫颈癌具有持久的抗肿瘤活性!
2024-11-02 e路新干线 e路新干线 发表于上海
研究结果表明,恩朗苏拜单抗治疗一线铂基化疗后进展或不耐受的PD-L1阳性复发或转移性宫颈癌患者显示出持久的抗肿瘤活性和可接受的安全性。
前言
2024年10月23日,中国医学科学院肿瘤医院吴令英教授作为通讯作者,华中科技大学同济医学院附属协和医院李贵玲教授和北京大学肿瘤医院李小凡教授作为共同第一作者在国际期刊《Gynecol Oncol》发表题为“Phase II study of enlonstobart (SG001), a novel PD-1 inhibitor in patients with PD-L1 positive recurrent/metastatic cervical cancer”的研究论文1。研究结果表明,恩朗苏拜单抗治疗一线铂基化疗后进展或不耐受的PD-L1阳性复发或转移性宫颈癌患者显示出持久的抗肿瘤活性和可接受的安全性。一项正在进行的Ⅲ期研究(NCT05715840)正在探索恩朗苏拜单抗+化疗±贝伐珠单抗一线治疗复发或转移性宫颈癌的有效性和安全性。

图1.恩朗苏拜单抗治疗PD-L1阳性复发或转移性宫颈癌Ⅱ期研究结果发表于《Gynecol Oncol》
研究背景
以铂类药物为基础的化疗联合或不联合贝伐珠单抗是复发或转移性宫颈癌患者的标准一线疗法,在一线治疗后,复发或转移性宫颈癌患者的治疗选择有限。
恩朗苏拜单抗(研发代号:SG001)是IgG4型重组抗PD-1全人源单克隆抗体,于2024年6月25日获NMPA批准上市,用于既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发或转移性宫颈癌患者,后续相继获《中国妇科肿瘤临床实践指南2024版》2和《子宫颈癌免疫检查点抑制剂临床应用指南2024版》3的2A类双推荐,《中国临床肿瘤学会(CSCO)宫颈癌诊疗指南2024版》4的Ⅱ级推荐。
既往Ⅰb期研究5表明,SG001对PD-L1阳性复发或转移性宫颈癌患者有良好的疗效,因此研究者进行了一项Ⅱ期研究进一步评估恩朗苏拜单抗治疗一线铂基化疗后进展或不耐受的PD-L1阳性复发或转移性宫颈癌患者的疗效和安全性。

图2.研究概况
研究方法
在这项多中心、单臂、开放、Ⅱ期研究中,符合条件的患者为年龄≥18岁、一线铂基化疗后疾病进展或不耐受的PD-L1阳性宫颈癌患者。患者接受SG001 240 mg Q2W,持续24个月或直到疾病进展、毒性无法耐受或满足其他研究终止标准。主要终点为独立审查委员会(IRC)根据RECIST v1.1评估的客观缓解率(ORR)。
研究结果
01 基线特征
2021年7月29日至2022年5月27日,107例患者接受至少一剂SG001并纳入分析,中位年龄53.0岁(范围:26-72岁)。38例(35.5%)患者ECOG PS为0,69例(64.5%)患者ECOG PS为1。几乎所有(94.4%)患者为鳞状细胞癌。所有患者既往接受过≥1线全身治疗,34例(31.8%)患者既往接受过贝伐珠单抗治疗。大多数(90.7%)患者既往接受过放疗,63例(58.9%)既往接受过手术。
表1.人口统计学和基线疾病特征
02 疗效结果
中位随访14.0个月(范围:0.4-21.9),IRC评估的ORR为29.0%(95% CI 20.6-38.5),2例完全缓解,29例部分缓解。研究者评估的ORR为27.1%(95% CI 19.0-36.6),3例完全缓解,26例部分缓解,与IRC评估的结果基本一致。
表2.根据RECIST v1.1评估的SG001治疗复发或转移性宫颈癌患者的疗效
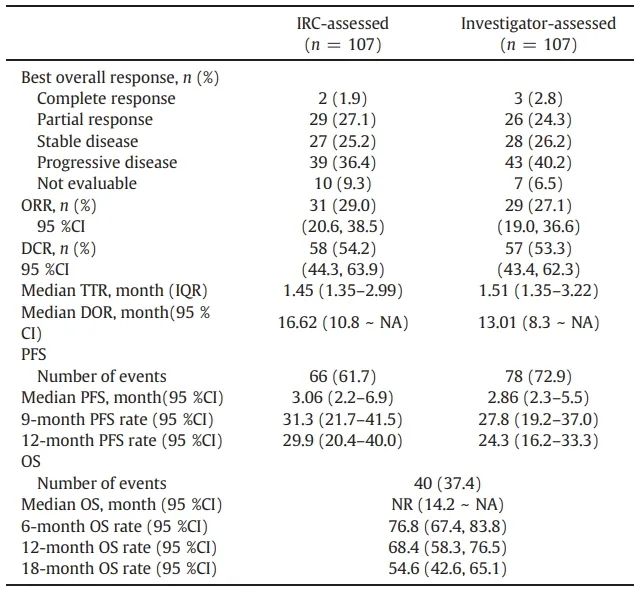
IRC评估的疾病控制率(DCR)和研究者评估的DCR分别为54.2%(95% CI 44.3-63.9)和53.3%(95% CI 43.4-62.3)。56例(52.3%)患者靶病灶缩小,其中37例(34.6%)患者靶病灶缩小≥30%(图3a);IRC评估的中位至缓解时间(TTR)和缓解持续时间(DOR)分别为1.45个月(四分位间距[IQR] 1.35-2.99)和16.62个月(95% CI 10.8-无法评估[NA]),研究者评估的中位TTR和DOR分别为1.51个月(IQR 1.35-3.22)和13.01个月(95% CI 8.3-NA)(图3b);至数据截止日期,66例(61.7%)患者出现疾病进展或死亡。IRC评估的中位PFS为3.06个月(95% CI 2.2-6.9)(图3c),9个月估计PFS率为31.3%(95% CI 21.7-41.5),12个月估计PFS率为29.9%(95% CI 20.4-40.0);中位OS未达到(95% CI 14.2-NA)(图3d),6个月估计OS率为76.8%(95% CI 47.4-83.8),12个月估计OS率为68.4%(95% CI 58.3-76.5),18个月估计OS率为54.6%(95% CI 42.6-65.1)。
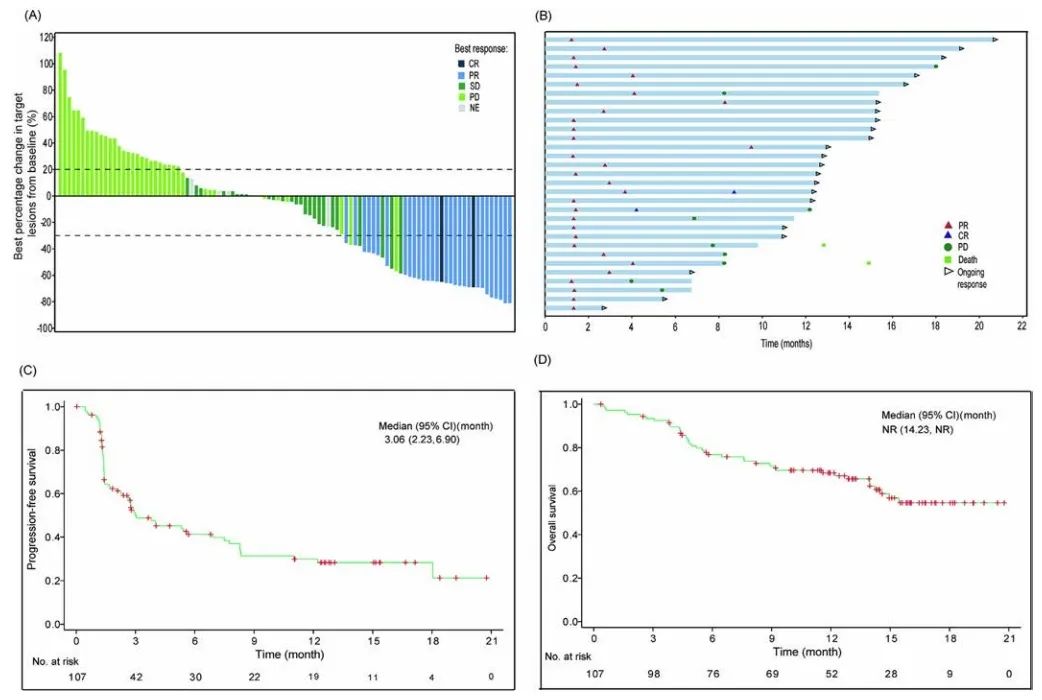
图3.(a)靶病灶自基线变化的最佳百分比;(b)最佳总缓解为CR或PR的患者的至缓解时间和缓解持续时间(n=31);(c)PFS的K-M曲线;(d)OS的K-M曲线
03 安全性
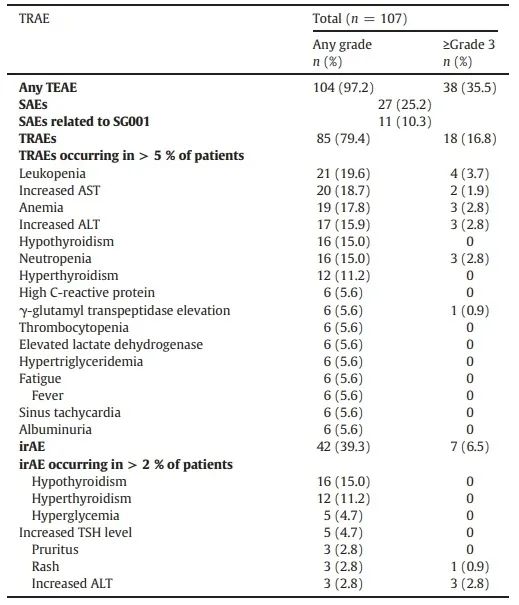
104例(97.2%)患者经历了至少一次治疗中出现的不良事件(TEAE),85例(79.4%)患者发生了治疗相关不良事件(TRAE),18例(16.9%)患者发生≥3级TRAE,分别有2.8%(3/107)和14.0%(15/107)的患者观察到TRAE导致的停药和中断,无治疗相关死亡事件发生。44例(41.1%)患者观察到免疫相关不良事件(irAE),其中8例(7.5%)发生3级irAE,无≥4级irAE发生。
表3.SG001治疗后发生率≥5%的TRAE和≥3级TRAE总结表
04 疗效对比
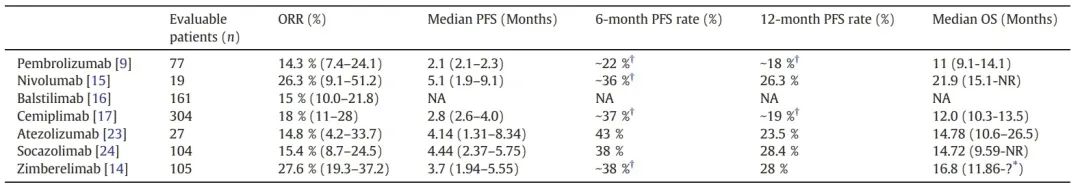
在已发表的文献中,SG001在PD-L1阳性复发或转移性宫颈癌患者中显示出比既往PD-1抑制剂更高的ORR和更长的中位OS(塞帕利单抗[ORR 27.6%,中位OS 16.8个月],纳武利尤单抗[ORR 26.3%,中位OS 21.9个月],巴替利单抗[ORR 20%,中位OS 无法评估],西米普利单抗[ORR 18%,中位OS 12.0个月],帕博利珠单抗[ORR 14.3%,中位OS 11.0个月])。尽管研究的横向对比具有挑战性,但本研究患者的基线特征与其他PD-1抑制剂研究的患者基线特征相似。中位年龄为53.0岁,64.5%的患者ECOG PS为1,36.5%的患者既往接受过≥2线系统治疗,31.8%的患者既往接受过贝伐珠单抗治疗。
表4.PD-(L)1抑制剂单药治疗既往至少接受过一线治疗的PD-L1阳性复发或转移性宫颈癌患者的疗效
研究结论
SG001治疗一线铂基化疗后进展或不耐受的PD-L1阳性复发或转移性宫颈癌患者显示出持久的抗肿瘤活性和可接受的安全性。一项正在进行的Ⅲ期研究(NCT05715840)正在探索SG001+化疗±贝伐珠单抗一线治疗复发或转移性宫颈癌的有效性和安全性。
参考文献:
1. Li G,et al. Gynecol Oncol. 2024 Oct 23;191:165-171.
2. CACA指南:中国妇科肿瘤临床实践指南(2024年版).
3. 龙行涛等.中国实用妇科与产科杂志,2024,40(07):712-719.
4. CSCO指南:宫颈癌诊疗指南(2024年版).
5. Zuo J, et al. Cancer Commun (Lond). 2024 Jul 23.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#宫颈癌# #恩朗苏拜单抗#
20