近日,肿瘤浸润淋巴细胞(TIL)疗法Lifileucel(LN-144)已完成生物制品许可申请(BLA)的滚动式递交过程。有望成为全球首款TIL细胞疗法。适应症为PD-1/PD-L1治疗后进展的晚期黑色素瘤。

TIL疗法
TIL疗法(TILs)简言之就是将手术切除的肿瘤组织中的淋巴细胞分离纯化,挑选出其中能特异性抗癌的淋巴细胞,扩增活化后回输。这类疗法拥有30多年的历史,最早用于恶性黑色素瘤,近年来在宫颈癌、肺癌等多种实体瘤中都给出了不俗的数据。
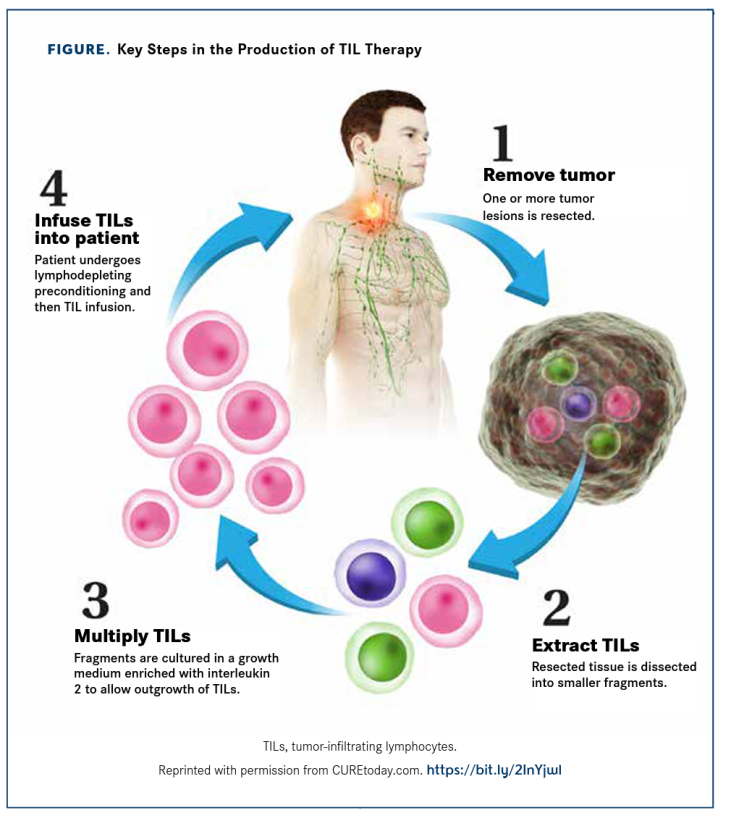
此次滚动上市申请基于lifileucel治疗晚期黑色素瘤患者的II临床试验C-144-01的阳性结果。C-144-01研究入组患者为既往接受过包括PD-1抗体在内≥1次全身治疗的不可切除或转移性黑色素瘤;如果患者BRAF V600突变阳性,则采用BRAF抑制剂±MEK抑制剂联合治疗。该研究共分为4个队列,其中队列1 (n=30)患者接受非冷冻保存的TIL产品治疗;队列2(n=66)和队列4 (n=75)患者皆接受经冷冻保存的TIL治疗;队列3 (n=~10)为重复接受TIL治疗患者。非冷冻保存的TIL产品(Gen1)是一种不通过冷冻保存的肿瘤浸润淋巴细胞(TIL)疗法。Gen1产品通常用于TIL疗法开发的早期阶段,其中TIL在体外扩增后立即注入患者,因此不需要被冷冻。这与冷冻保存的TIL产品(Gen2)工艺有所不同,后者会被冷冻以备后续使用,以实现长期储存和运输。

研究结果显示,经过独立影像学委员会(IRC)评估,队列2的客观缓解率(ORR)为34.8%;队列4的ORR为28.7%;队列2+4的总ORR为31.4%。

在ESMO大会上,TIL疗法首个Ⅲ期试验数据公布。在M14TIL Ⅲ期试验中,将168例不可切除的IIIC-IV期黑色素瘤患者随机分配到抗CTLA-4抗体伊匹单抗的免疫治疗或TIL治疗。大多数患者先前的抗PD-1治疗失败。结果显示,接受TIL治疗的患者的中位无进展生存期显着延长,为7.2个月,而接受伊匹单抗的患者为3.1个月;对TIL的总体反应率为49%,而伊匹单抗为21%;中位总生存期为25.8个月,18.9个月。这种全新的个体化细胞免疫治疗策略显著提高了晚期黑色素瘤患者的无进展生存期。
除了黑色素瘤,TIL疗法再其他癌种的治疗上也有很好的疗效。
TIL疗法治疗NSCLC
在2021年8月12日,一项有关TILs疗法的重磅研究登上顶级期刊《Nature》。TIL已经在黑色素瘤中进行了广泛的研究,但此项是TIL治疗转移性NSCLC的首次结果。使用肿瘤浸润淋巴细胞(TILs)的过继细胞治疗的16名转移性NSCLC患者中的2名获得了完全缓解和持久应答。

这项单臂开放标签1期试验涉及20名收集了TIL的患者,其中包括16名最终接受TIL的患者。中位年龄为54岁;所有患者均有转移性NSCLC和纳武利尤单抗单药治疗后疾病进展。在13例评估患者中,3例已确认有反应,11例肿瘤负荷减轻。两名患者在TIL治疗后1.5年获得了持续的完全缓解。
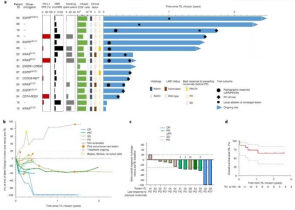
TIL的临床活性与患者生存
值得关注的一点是,低肿瘤突变负荷,PDL-1阴性和从不吸烟是引起免疫疗法耐药的三个因素,但TIL疗法还是达到了完全缓解。这表明,对于传统免疫检查点治疗不敏感的肿瘤亚型,TIL可实现有效治疗。
2021年11月,在肿瘤免疫治疗协会(SITC)年会上,Iovance 公布TILs疗法LN-145在治疗转移性非小细胞肺癌(mNSCLC)的临床研究数据。LN-145单药治疗后的患者总缓解率(ORR)为21.4%(n=28),1例为完全缓解,5例为部分缓解。所有6名获得缓解的患者此前都曾经接受过化疗。此外,疾病控制率(DCR)为64.3%,其中2例产生应答的患者携带PD-L1阴性肿瘤。

LN-145疗法机理
相关研究者表示,二线治疗NSCLC在提高应答率和延长生存期方面还有很大的提升空间。LN-145在此项研究中呈现的数据给予难治患者群体以希望。
TLI疗法治疗宫颈癌
LN-145于2019年5月,被FDA授予突破性疗法。是基于ASCO会议上报道的一项II期C-145-04研究,该研究是一项正在进行的,开放标签,多中心的临床试验,用来评估LN-145 TIL治疗晚期宫颈癌患者的安全性和有效性。截至2019年2月4日,该研究纳入了27例宫颈癌患者,这些患者至少接受过一次化疗治疗,平均之前接受过2.6种治疗。这些患者接受了第2代的LN-145输注,输注的平均TIL细胞为28x109。患者在输注前接受一周的环磷酰胺,氟达拉滨进行预处理,清除淋巴细胞,然后接种最多6剂IL-2(600,000 IU / kg)。主要终点是客观反应率ORR; 次要终点包括反应持续时间(DOR),疾病控制率(DCR)和LN-145安全性。
经过3.5个月的中位随访,发现ORR为44%,疾病控制率DCR为89%。1例患者达到完全缓解,9例达到部分缓解,2例达到未确认的部分缓解((1 CR,9 PR,2uPR))。不良事件可耐受,主要就是淋巴细胞清除和IL-2方案带来的副作用一致。
TIL与抗PD-1疗法联合使用是否更有效?
先前数据表明,无论是单独使用TIL还是与PD-1抑制剂联合使用,这两种治疗方法似乎并不一定具有协同作用。当比较Iovance COM-202试验的NSCLC患者数据时,患者在接受了两到三种先前的治疗后出现了进展,缓解率约为21%,结果并不持久。然而,当TIL与PD-1抑制剂联合使用时,表现出更强的信号。这可能与从患者肿瘤中切除的TIL的类型有很大关系。患者暴露于PD-1或PD-L1抑制剂的时间越长,这些TIL的稳定性就越差。等待疾病进展并不是用TIL治疗这些患者的最佳时机,最好的时机可能是患者疾病负担较轻时,有机会让自身免疫系统根除残留的肿瘤克隆。
Iovance还就lifileucel的III期注册试验(研究代号TILVANCE-301)设计方案与FDA达成一致,该试验是将lifileucel与K药联合用于一线晚期黑色素瘤的试验,不仅旨在全面支持lifileucel获批用于治疗PD-1单抗进展后的黑色素瘤患者,同时也是为了支持lifileucel与K药联合用于一线晚期黑色素瘤治疗方案的注册申请。
ITIL-168已作为黑色素瘤的单一疗法,DELTA-2试验正在将其与帕博利珠单抗联合使用,用于先前PD-1抑制剂治疗进展的患者。因为免疫检查点受体,如PD-L1,在与特异性配体(PD-1)结合后,可能会抑制淋巴细胞的杀伤活性。癌细胞利用这些机制使肿瘤浸润淋巴细胞(TIL)失活以逃避免疫监视。如果不增加检查点阻断,那些TIL可能会迅速耗尽或被不利的肿瘤微环境抑制。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







