协和医学杂志:PSMA/[18]F-FDG PET显像在前列腺癌骨转移[223]Ra治疗中的应用体会
2023-09-17 协和医学杂志 协和医学杂志 发表于加利福尼亚
本研究回顾性展示北京协和医院接受223Ra治疗的PCa患者临床资料,并分享PSMA PET与18F-FDG PET应用心得,以期为国内223Ra的临床应用提供参考。
雄激素剥夺疗法(ADT)是前列腺癌(PCa)的主流疗法,虽然95%以上的患者对此治疗手段反应良好,但少数病例逐渐进展为转移性去势抵抗性前列腺癌(mCRPC),而超过90%的mCRPC患者存在骨转移,骨转移已成为导致此类患者预后不良的主要原因[1]。
2020年8月,氯化镭-223(223Ra)通过国家药品监督管理局审核,成为我国首个获批的用于治疗伴症状性骨转移且无内脏转移的去势抵抗性前列腺癌的α粒子药物,其可提高患者的总生存期(OS)、降低骨相关不良事件发生率,但鉴于开展时间较短,其临床应用尚存在两方面局限性:
(1)缺乏统一的病例筛选标准;
(2)前列腺特异性抗原(PSA)与碱性磷酸酶(ALP)是评估223Ra治疗反应的重要生物学标志物,但PSA存在假性增高的情况(PSA闪烁现象)[2],而ALP变化仅对ALP升高病例具有参考价值,故单纯PSA/ALP不足以对223Ra进行精确的疗效评价。
骨扫描是临床检测前列腺癌骨转移的常规影像学检查。但文献报道,相较于骨扫描,前列腺特异性膜抗原(PSMA)正电子发射断层显像(PET)在mCRPC患者骨转移灶检测中更具优势[2]。
此外,虽然18F-氟代脱氧葡萄糖(18F-FDG) PET并非PCa患者的常规检查项目,但受肿瘤异质性的影响,晚期PCa患者存在18F-FDG PET显像与PSMA PET显像不一致的情况,且存在18F-FDG阳性/PSMA阴性病灶与患者预后不良具有相关性[3]。
因此,在传统骨扫描的基础上,将PSMA PET与18F-FDG PET分子影像学检查纳入223Ra治疗病例的筛选及疗效评价体系,有助于实现患者获益最大化。
本研究回顾性展示北京协和医院接受223Ra治疗的PCa患者临床资料,并分享PSMA PET与18F-FDG PET应用心得,以期为国内223Ra的临床应用提供参考。
1 材料与方法
1.1 研究对象
本研究为描述性分析。研究对象为2021年9月—2023年1月北京协和医院行223Ra治疗的PCa患者。纳入标准:(1)均经组织病理确诊为PCa;(2)骨扫描证实存在2个及以上成骨性转移灶;(3)初次接受223Ra治疗。排除标准:同期采取其他手段治疗者。
本研究已通过北京协和医院伦理审查委员会审批(审批号:B484),并豁免患者知情同意。
1.2 研究方法
1.2.1 223Ra治疗方法
患者满足以下治疗条件时,静脉注射223Ra 55 kBq/kg,每4周1次(每次1针),共治疗6次。治疗条件[4]:
①首次给药前中性粒细胞计数绝对值≥1.5×109/L、血小板计数≥100×109/L、血红蛋白≥100 g/L;
②治疗期间每次给药前10 d中性粒细胞计数绝对值≥1.0×109/L、血小板计数≥50×109/L。若不满足治疗条件,需根据个体化情况进行延迟给药。
1.2.2 观察指标
收集所有患者的临床资料,包括:(1)年龄、病程、Gleason评分、既往治疗方式等一般资料;(2)初次治疗前1周内及每次治疗后第4周PSA、ALP、白细胞、红细胞、血红蛋白、血小板及疼痛评分;(3)治疗前1周内、第4针治疗前1周内及结束治疗后4周内骨扫描、PSMA和/或18F-FDG PET显像等影像学检查;(4)对患者进行疗效评价[5-6]及生存状态随访(截至2023年3月15日)。
1.3 统计学处理
采用SPSS 23.0软件进行数据整理。PSA、ALP、血小板等计量资料以实测值的形式表示,计数资料以频数或百分数表示。
2 结果
2.1 一般临床资料
研究期间,共11例骨转移PCa患者拟行223Ra治疗,其中1例因PSMA PET和18F-FDG PET证实存在肺转移和肾上腺转移而变更治疗方案(图1),1例因外院18F-FDG PET检查显示存在肝转移而未纳入治疗(患者在1个月后死亡),最终入选9例接受不同针次223Ra治疗的PCa患者(表1),包括8例mCRPC患者,1例转移性激素敏感性前列腺癌( mHSPC)患者。
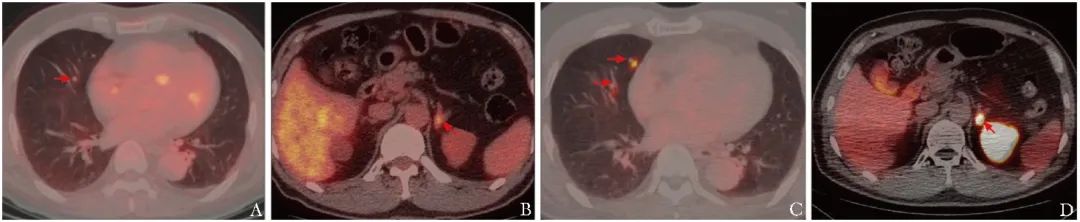
图1 1例男性患者,59岁,确诊PCa 7年余,经手术、放化疗及内分泌治疗后出现多发骨转移,拟行223Ra治疗,基线18F-FDG PET(A、B,箭头)和PSMA PET(C、D,箭头)均提示存在肺转移及肾上腺转移,判定该患者不宜接受223Ra治疗
PCa:前列腺癌;18F-FDG:18F-氟代脱氧葡萄糖;PSMA:前列腺特异性膜抗原;PET:正电子发射断层显像;223Ra:氯化镭-223
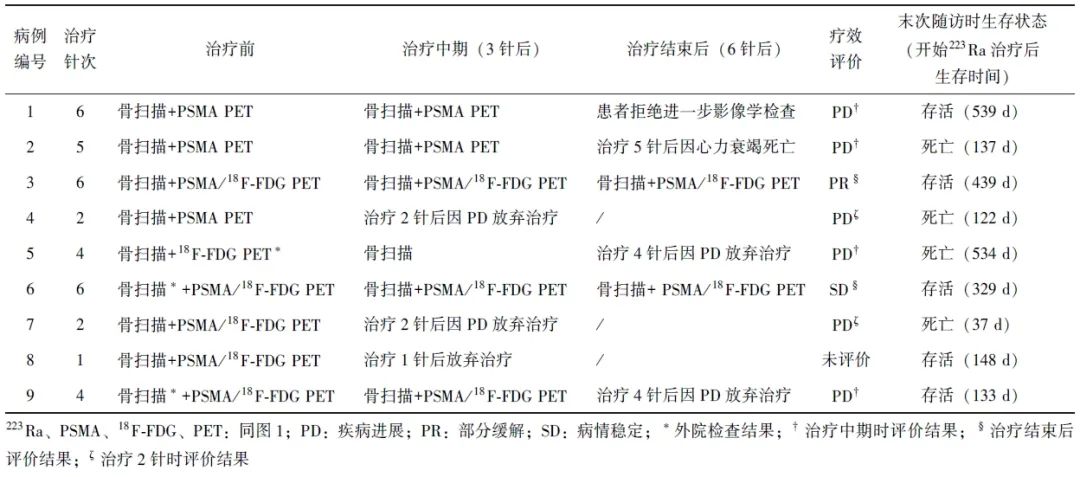
表1 9例患者基本资料
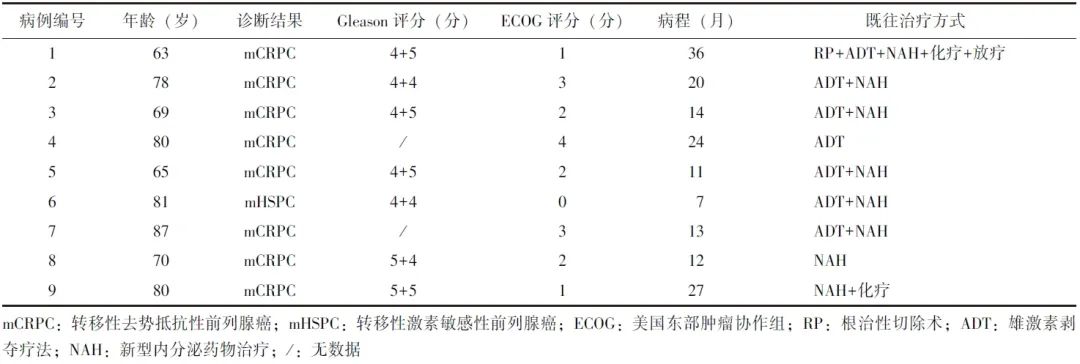
2.2 223Ra治疗前后临床监测指标变化及血液学不良反应
9例患者共接受36针223Ra治疗。其中3例患者完成6针治疗(病例1、3、6);1例患者完成5针治疗(病例2);2例患者完成4针治疗(病例5、9);2例患者完成2针治疗(病例4、7);1例患者完成1针治疗(病例8)。
2.2.1 疼痛
2例患者(病例6、9)在治疗过程中始终无骨痛,余7例患者均存在不同程度的骨痛,其中4例治疗后疼痛有所缓解(病例1、2、3、5),1例治疗后骨痛无缓解(病例4),2例治疗后骨痛加重(病例7、8)。见图2A。

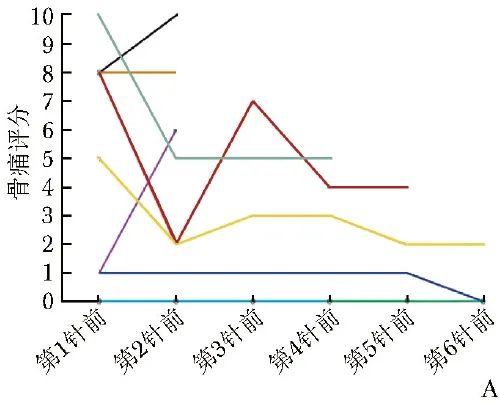
图2A 223Ra治疗前后9例患者骨痛评分情况
2.2.2 血PSA及ALP
PSA:7例患者治疗后PSA未见降低,反而持续增高;1例患者(病例3)治疗期间PSA呈先下降后上升的趋势,6针223Ra治疗结束后,PSA较基线水平下降(由20.5 μg/L降至14.1 μg/L);1例患者(病例6)治疗前及治疗过程中PSA始终处于较低水平(图2B)。

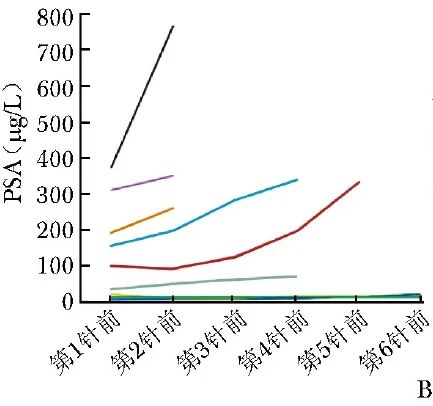
图2B 223Ra治疗前后9例患者PSA(前列腺特异性抗原)变化情况
ALP:1例患者ALP变化情况缺失,余8例患者中ALP始终正常4例,余4例患者基线ALP均升高,其中3例治疗后ALP出现下降,1例(病例5)在治疗过程中ALP持续增高(图2C)。

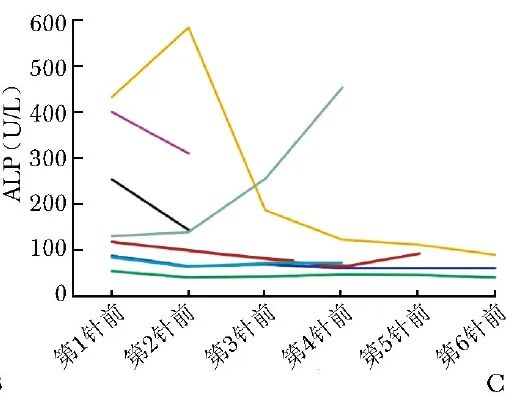
图2C 223Ra治疗前后9例患者ALP(碱性磷酸酶)变化情况
2.2.3 223Ra治疗的血液学不良反应
主要的血液学不良反应包括不同程度的红细胞、血红蛋白及白细胞降低(仅病例2在4针治疗后出现血小板轻度降低),且当患者基线红细胞、血红蛋白及白细胞水平低于正常值下限时,在随后的治疗中更易出现血液学不良反应(图2D~2G)。

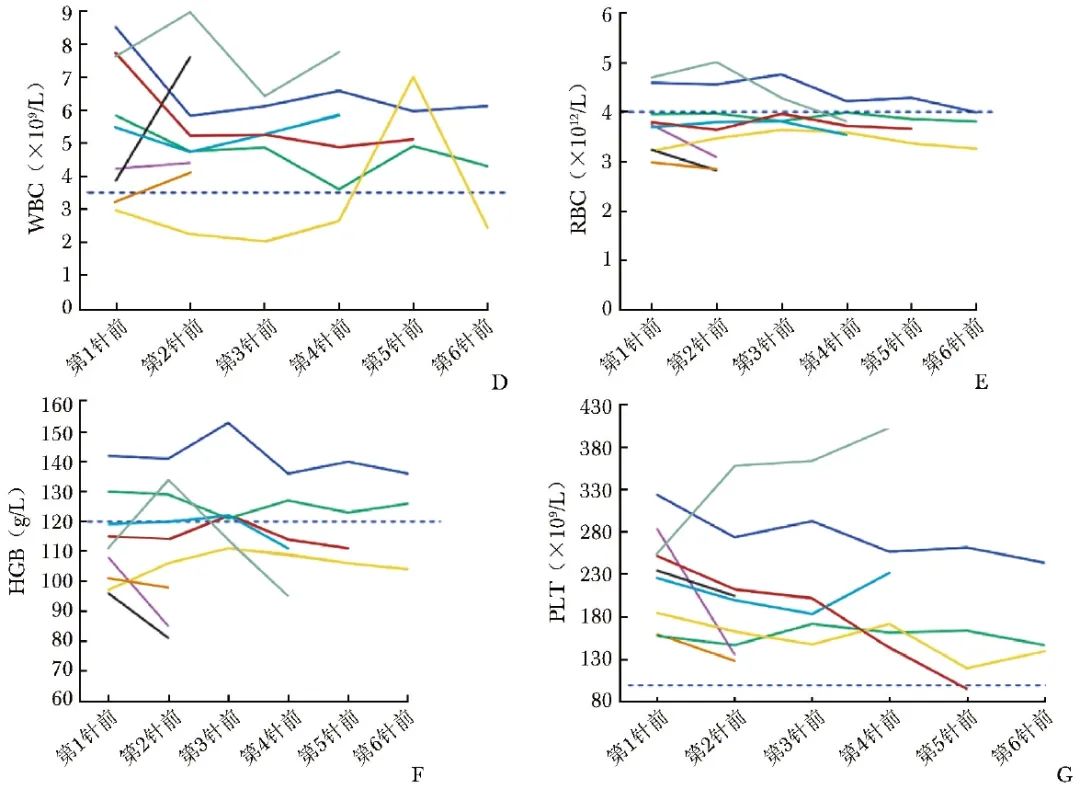
图2D~G 223Ra治疗前后9例患者WBC(白细胞)RBC(红细胞)HGB(血红蛋白)PLT(血小板)变化情况
2.3 223Ra治疗效果及患者生存状态
根据骨扫描及PSMA PET和/或18F-FDG PET影像学特征进行治疗效果评价,结果如表2所示。1例患者(病例8)因一般状况差,完成1针223Ra治疗后采取了内分泌治疗,未进行效果评价,余8例患者中部分缓解1例、病情稳定1例、疾病进展6例。截至末次随访,9例患者中,死亡4例(除病例2因心力衰竭死亡外,余3例均因疾病进展死亡),存活5例。
表2 9例患者治疗前后影像学检查情况及患者预后
2.4 PSMA/18F-FDG PET显像应用价值分析
(1)在病例筛选阶段:2例患者因PSMA PET和/或18F-FDG PET显像提示存在内脏转移而未被纳入223Ra治疗(图1);对死亡或疾病进展患者的基线影像学特征分析后发现,PSMA PET和/或18F-FDG PET显像所示的骨转移灶与骨扫描在病灶分布上存在不一致性,前者可发现更多的骨转移灶(图3),提示PET显像除可作为评估内脏转移情况的重要检查手段外,对治疗效果亦有一定预测作用,可辅助临床筛选出对治疗有应答的患者。
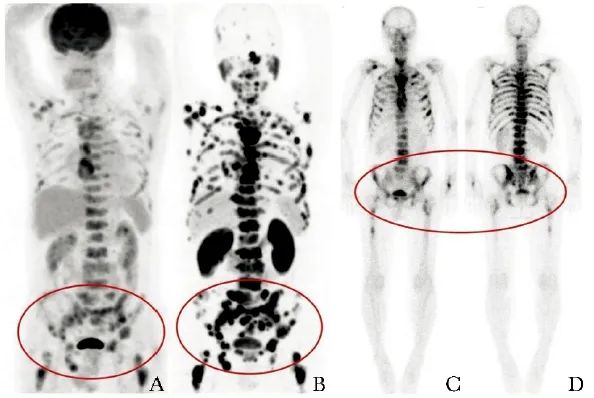
图3 病例7治疗前18F-FDG PET(A)、PSMA PET(B)示骨转移灶均明显多于骨扫描(C、D),尤其骨盆部分(红色圆圈),且骨扫描显示骨盆多发转移灶对示踪剂的摄取程度低,可能预示治疗效果不佳
18F-FDG、PSMA、PET:同图1
(2)在疗效评估阶段:3例治疗中期PET显像评估为疾病进展患者(病例1、2、9)中,骨扫描评估为2例(病例1、2)疾病进展,1例病情稳定(图4);病例3治疗中期时骨扫描出现闪烁现象,结束治疗后骨扫描示病情稳定,而PSMA PET和18F-FDG PET显像均评估为部分缓解(图5),提示PET显像在疗效评价方面更具优势。
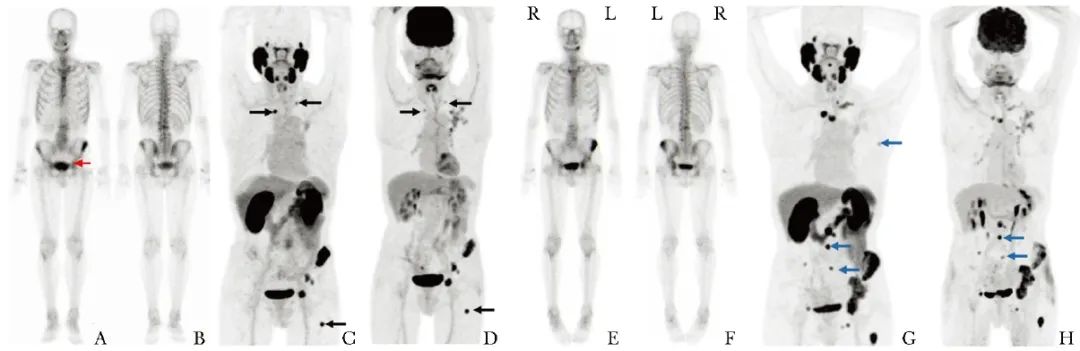
图4 病例9治疗前骨扫描示左侧髂骨及左侧髋臼骨转移(A、B),其中髋臼转移灶摄取程度较低(红色箭头),PSMA PET(C,黑色箭头)和18F-FDG PET(D,黑色箭头)示骨转移灶明显多于骨扫描;3针223Ra治疗后,骨扫描未见新增病灶(E、F),而PSMA PET和18F-FDG PET均示原骨转移灶范围较前增大且出现新发多处骨转移灶(G、H,蓝色箭头)
18F-FDG、PSMA、PET:同图1
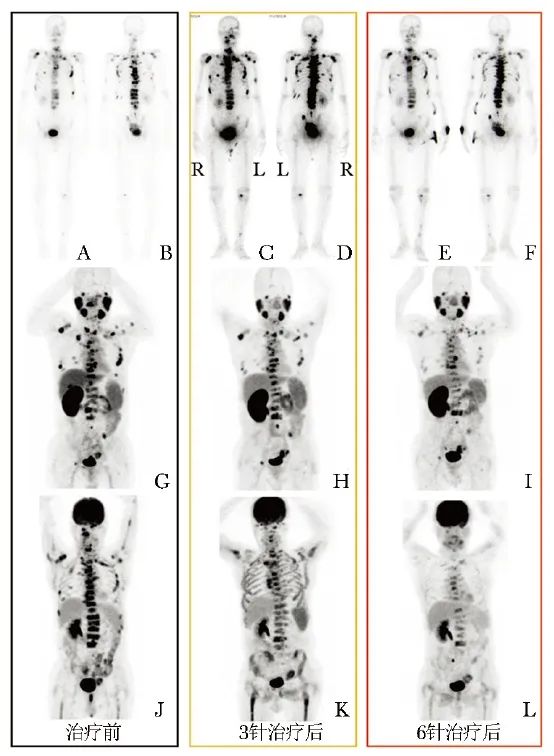
图5 病例3骨扫描示相较于治疗前(A、B),治疗中期(C、D)时骨转移灶示踪剂摄取程度明显增高,治疗结束后较治疗前变化不明显(E、F);相较于较治疗前(G),治疗中期(H)及治疗结束后(I)PSMA PET显像均提示骨转移灶数量明显减少;相较于治疗前(J),治疗中期时18F-FDG PET显像提示骨髓放射性摄取弥漫性增高(K,结合血常规结果考虑为继发性骨髓放射性摄取增高而非新增转移灶),治疗结束后骨髓继发放射性摄取增高基本缓解(L),骨转移灶数目明显减少,转移灶代谢活性明显减低,考虑为部分缓解
18F-FDG、PSMA、PET:同图1
3 讨论
本研究基于北京协和医院9例初次接受223Ra治疗的骨转移性PCa患者的影像学资料,对18F-FDG PET和PSMA PET显像在病例筛选、病情监测中的作用进行了初步分析,笔者认为PET显像尤其PSMA PET可辅助临床筛选出对223Ra治疗有反应的病例且其在疗效评估中作用优于骨扫描。
223Ra是一种靶向α治疗药物,可选择性与骨转移瘤的骨转换区域结合,并发射短程(<100 μm)的高能α粒子,进而起到杀灭肿瘤细胞的作用[7-8]。此外,镭和钙属于同族元素,具备相似的理化特性,镭元素进入体内后可与羟基磷灰石相结合至新形成的骨基质中(病理骨活跃区域),尤其是在成骨性或硬化转移灶的微环境内[8-9](靶向结合)影响骨转移灶活性。
ALSYMPCA研究证实,相较于安慰剂,223Ra可延长已发生骨转移PCa患者的OS,患者死亡风险降低30%[1]。目前,223Ra已通过我国国家药品监督管理局审批,是国内外指南唯一推荐的出现骨转移且无内脏转移去势抵抗性前列腺癌的核素治疗药物。
本研究9例PCa骨转移患者经223Ra治疗后,仅1例达到部分缓解,1例病情稳定,6例出现疾病进展,提示治疗效果不理想,分析原因:
(1)纳入223Ra治疗对象时沿用了现行国际标准(骨扫描及CT、MRI等常规影像学检查示无内脏转移或直径>3 cm淋巴结转移),以致部分对223Ra无反应的病例被纳入;
(2)对基线PET显像与骨扫描结果不一致者未及时更改治疗方案。
本研究9例PCa患者中,无论最新随访状态为存活或死亡,多数患者的PSA呈上升或平稳趋势,仅病例3治疗结束后PSA较基线下降31.2%(图2B)。结合ALP变化特征(图2C)可知,死亡患者在治疗过程中ALP缓解趋势不明显、甚至出现升高,而至今存活患者的ALP缓解趋势明显。
虽然本研究病例数较少且随访时间有限,暂无法得出ALP或PSA与患者OS的相关性,但ALSYMPCA研究证实,相较于PSA,ALP与223Ra治疗PCa骨转移患者OS的相关性更强[10],本研究数据亦符合上述特点。从缓解患者疼痛、改善生活质量的角度来看(图2A),采用223Ra治疗后大多数患者均呈现疼痛逐渐缓解的趋势,且至今仍存活患者的疼痛缓解趋势一致性更强。
在安全性方面,ALSYMPCA研究报道的贫血和血小板下降率分别为31%和12%,而本研究9例患者均未出现严重血液学不良事件,除病例1和病例6外,多数患者(77.8%,7/9)基线存在轻度贫血,且在随后的治疗中更易出现血液学不良反应(但并未影响后续治疗);需注意的是,本研究4例死亡患者中3例死于疾病进展,余1例(病例2)接受第5针治疗后因心力衰竭死亡,其在第5针治疗前出现了血小板下降,虽然暂未明确二者的关联性,但仍建议在治疗前以及治疗过程中密切监测血液学指标动态变化,以更好地管理和处理血液学不良事件。
95%的PCa骨转移病灶为成骨性病变,5%为混合型病变,单纯溶骨性病变极为少见[11]。临床对于骨转移病灶进展情况的评估相当棘手,主要原因是目前常用的肿瘤进展评估标准(RECIST标准)对靶病灶的要求是具有可评价和可重复性,这在骨转移灶的影像学资料中难以作出判断。
本中心纳入的病例主要为多发骨转移的晚期PCa患者,其通常具有多个骨转移灶,增加了病情评估的难度。众所周知,全身骨扫描是PCa骨转移的首选筛查手段,但部分患者在疗效评估时存在骨闪烁现象,从而限制了该方法的应用。
目前,前列腺癌工作组3(PCWG3)仍以骨扫描作为骨转移灶疗效评价的主要方式[12],其对骨转移进展的判定标准如下:治疗后首次骨扫描(治疗后8~9周)至少存在2个新病灶,第二次扫描(第一次骨扫描后8~9周)时至少额外出现2个新病灶,或治疗后非首次骨扫描发现至少2个新病灶并在下次骨扫描中得到确认(首次出现2个新病灶的时间记录为疾病进展时间);如果存在疑似骨闪烁现象,则需行CT/MRI检查进一步确认。虽然PCWG3标准中骨扫描可用于骨转移灶疗效评价,但其时效性较差(需间隔数周再次骨扫描检查才可判断)[6]。
Ahmadzadehfar等[2]比较了不同影像学手段筛查的PCa患者采用223Ra治疗的反应性,发现相较于CT联合骨扫描组,PSMA PET联合骨扫描组出现PSA(43.8% 比12.9%)或ALP(88.9% 比63.2%)应答的比例更高,其肯定了PSMA PET在病例筛选中的应用价值。
proPSMA研究[13]显示,在高危PCa患者中,PSMA PET对病灶检测的准确性、敏感性和特异性均优于常规影像学检查(CT、骨扫描),对治疗决策有重要影响,但部分PCa患者(尤其晚期病例)在持续治疗中可出现PSMA低表达或无表达的病灶[14],而18F-FDG PET/CT对此类病灶的探测效果优于PSMA PET,二者联合应用可实现互补,更全面地评估肿瘤病变情况[15-16]。
故本中心将PSMA PET与18F-FDG PET纳入223Ra治疗病例筛选与疗效评价体系,以期可更精准地评估肿瘤负荷,筛选出更适宜此治疗手段的患者。如图1所示,对于拟接受223Ra治疗的PCa患者,行PSMA PET和/或18F-FDG PET显像均可检出内脏转移灶,从而避免患者接受无效的223Ra治疗。
本研究发现PSMA PET及18F-FDG PET在骨转移灶检测方面明显优于骨扫描,与文献报道结果相符[15-16],而且当患者基线时上述两项检查显示骨转移灶明显多于骨扫描时(图3、4),采用223Ra治疗的效果通常较差,此类患者可能更适合行177Lu-PSMA治疗,提示PSMA PET和/或18F-FDG PET(尤其是PSMA PET)可作为骨扫描之外的“守门员”,辅助临床对拟接受223Ra治疗的PCa骨转移病例进行筛选,以识别出更有可能从该治疗手段中获益的人群,提高治疗效果。
除病例筛选外,PET显像在疗效监测中也具有重要应用价值,以指导临床决策。本研究9例接受223Ra治疗的PCa患者中,治疗前均完善了PET检查(PSMA PET和/或18F-FDG PET),且达到治疗中期的病例中几乎均进行了PET复查,为后续治疗方案提供了参考依据。
以病例3为例,其治疗中期时骨扫描示骨转移灶放射性浓聚程度较治疗前明显增高(假性升高,即骨闪烁现象),但18F-FDG PET和PSMA PET显像均提示骨转移灶数量较前减少,按既定方案完成后续治疗后达到了部分缓解(图5)。
病例9治疗中期时骨扫描示无新发病灶,而PSMA PET和18F-FDG PET显像均提示出现多个新发骨转移灶(图4),提示疾病进展。因此,在疗效评估过程中,PSMA PET和18F-FDG PET显像有望弥补骨扫描的不足,一方面可避免因出现骨闪烁现象而过早停药,另一方面可及时识别出疾病进展(图4),进而及时停药并改变治疗策略。
本研究局限性:(1)由于223Ra临床应用时间较短且治疗周期较长,故收集的病例数较少且未进行统计学分析;(2)由于部分患者对辐射剂量有所顾虑,故并非所有患者均接受了PSMA PET和18F-FDG PET联合显像检查,无法充分阐述二者联合应用的优势。
综上所述,本研究基于9例接受223Ra治疗的骨转移PCa患者临床资料,初步分享了PET显像在其中的应用体会,笔者认为在骨扫描的基础上联合PSMA PET和/或18F-FDG PET显像有助于筛选出对223Ra治疗有反应的病例,并辅助临床更精准、及时地进行疗效评价,以视情况调整临床策略,促进患者获益最大化。
专家点评
北京协和医院 核医学科
霍 力 教授
骨骼是晚期前列腺癌常见的转移部位。骨转移将导致一系列骨相关不良事件发生,严重影响患者生活质量,是前列腺癌致死的主要原因。传统治疗方法,如手术、雄激素剥夺疗法、放射治疗(如外放射治疗或β粒子药物治疗)、镇痛及双膦酸盐类药物治疗等尚不能满足临床需求,对于骨痛症状的控制不理想。
223Ra是目前国内外指南唯一推荐的存在症状性骨转移且无内脏转移的去势抵抗性前列腺癌的核素治疗药物,不仅有助于延长前列腺癌骨转移患者总生存期,延缓骨相关不良事件发生,而且镇痛效果明显,可显著改善患者生活质量。鉴于223Ra在国内的获批时间较短,相关研究较匮乏且主要集中于223Ra的有效性及安全性评估方面。
本研究是国内首次探究PET显像在指导223Ra治疗中应用价值的相关研究,结果显示PSMA/18F-FDG PET显像联合骨扫描在223Ra治疗患者的病例筛选、疗效监测及预后评估中具有特殊优势,有助于优化治疗方案,提高治疗效果,同时避免了无效的医疗干预。
基于本研究结果,作者首次对现行国际指南所推荐的223Ra治疗病例筛选标准提出了质疑,认为有必要将PSMA/18F-FDG PET显像纳入病例筛选体系,以辅助临床识别出对该治疗方式更敏感的人群,体现了作者团队勇于创新、敢于质疑的科学精神,值得国内外同行借鉴。
参考文献
[1]Parker C, Nilsson S, Heinrich D, et al. Alpha emitter radium-223 and survival in metastatic prostate cancer[J]. N Engl J Med, 2013, 369: 213-223.
[2]Ahmadzadehfar H, Azgomi K, Hauser S, et al. 68Ga-PSMA-11 PET as a Gatekeeper for the Treatment of Metastatic Prostate Cancer with 223Ra: Proof of Concept[J]. J Nucl Med, 2017, 58: 438-444.
[3]Jadvar H. The VISION Forward: Recognition and Implica-tion of PSMA-/18F-FDG+ mCRPC[J]. J Nucl Med, 2022, 63: 812-815.
[4]Jadvar H, Quinn DI. Targeted alpha-particle therapy of bone metastases in prostate cancer[J]. Clin Nucl Med, 2013, 38: 966-971.
[5]Gafita A, Rauscher I, Weber M, et al. Novel Framework for Treatment Response Evaluation Using PSMA PET/CT in Patients with Metastatic Castration-Resistant Prostate Cancer (RECIP 1.0): An International Multicenter Study[J]. J Nucl Med, 2022, 63: 1651-1658.
[6]Scher HI, Morris MJ, Stadler WM, et al. Trial Design and Objectives for Castration-Resistant Prostate Cancer: Updated Recommendations From the Prostate Cancer Clinical Trials Working Group 3[J]. J Clin Oncol, 2016, 34: 1402-1418.
[7]Bruland OS, Nilsson S, Fisher DR, et al. High-linear energy transfer irradiation targeted to skeletal metastases by the alpha-emitter 223Ra: adjuvant or alternative to conventional modalities?[J]. Clin Cancer Res, 2006, 12: 6250-6257.
[8]Henriksen G, Breistol K, Bruland OS, et al. Significant antitumor effect from bone-seeking, alpha-particle-emitting 223Ra demonstrated in an experimental skeletal metastases model [J]. Cancer Res, 2002, 62: 3120-3125.
[9]Henriksen G, Fisher DR, Roeske JC, et al. Targeting of osseous sites with alpha-emitting 223Ra: comparison with the beta-emitter 89Sr in mice[J]. J Nucl Med, 2003, 44: 252-259.
[10]Sartor O, Coleman RE, Nilsson S, et al. An exploratory analysis of alkaline phosphatase, lactate dehydrogenase, and prostate-specific antigen dynamics in the phase 3 ALSYMPCA trial with radium-223[J]. Ann Oncol, 2017, 28: 1090-1097.
[11]Roudier MP, Morrissey C, True LD, et al. Histopathological assessment of prostate cancer bone osteoblastic metastases[J]. J Urol, 2008, 180: 1154-1160.
[12]董世强,柳青,徐子寒,等. 前列腺癌骨转移的治疗进展及疗效评价[J]. 肿瘤, 2019, 39: 573-81.
[13]Hofman MS, Lawrentschuk N, Francis RJ, et al. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study[J]. Lancet, 2020, 395: 1208-1216.
[14]Alipour R, Azad A, Hofman MS. Guiding management of therapy in prostate cancer: time to switch from conventional imaging to PSMA PET?[J]. Ther Adv Med Oncol, 2019, 11: 1-14.
[15]Rosar F, Ribbat K, Ries M, et al. Neuron-specific enolase has potential value as a biomarker for 18F-FDG/68Ga-PSMA-11 PET mismatch findings in advanced mCRPC patients[J]. EJNMMI Res, 2020, 10: 52-62.
[16]Chen R, Wang Y, Zhu Y, et al. The Added Value of 18F-FDG PET/CT Compared with 68Ga-PSMA PET/CT in Patients with Castration-Resistant Prostate Cancer[J]. J Nucl Med, 2022, 63: 69-75.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言