多发性骨髓瘤对T细胞衔接治疗的耐药机制
2024-06-22 聊聊血液 聊聊血液 发表于上海
复发/难治性淋巴瘤治疗中,CAR-T细胞疗法和双抗等存在耐药,与肿瘤、T细胞及微环境相关,介绍了相关机制和应对策略。
CAR-T细胞疗法和双抗等T细胞衔接(TCE)治疗为复发/难治性淋巴瘤的治疗领域带来了一个新的希望,但也有相当一部分患者会发生耐药。一般来说,耐药是在肿瘤、T细胞和微环境相关因素的共同作用下发生的。
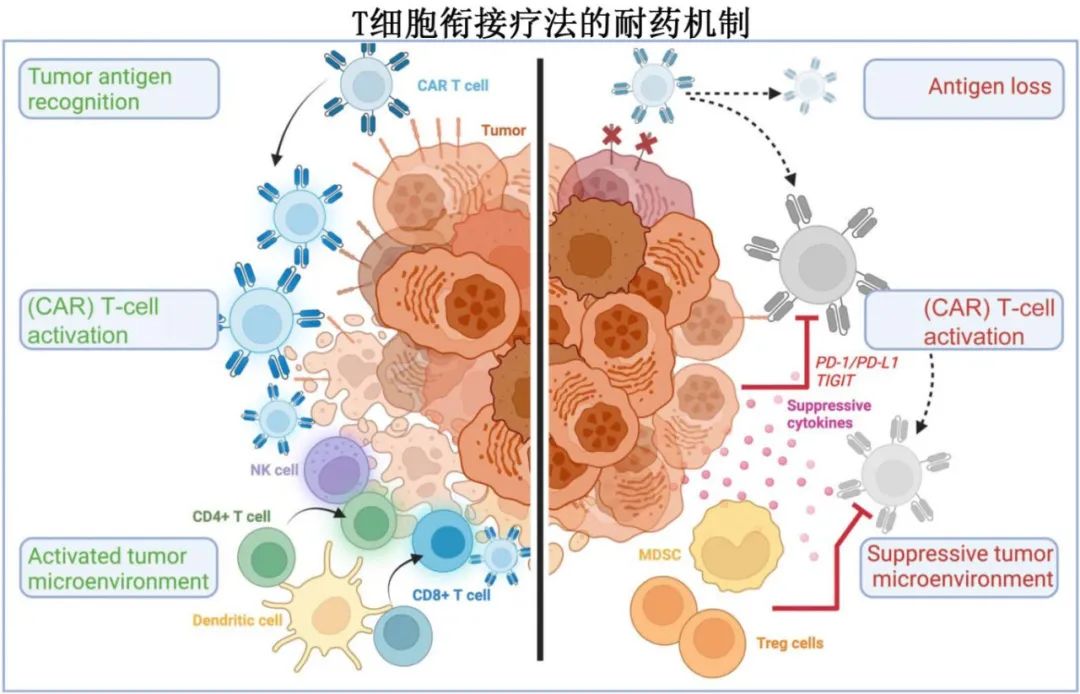
肿瘤内在耐药机制
有病例报告认为,由于TNFRSF17基因位点(即表达BCMA的基因)和上游调控位点的突变、缺失、剪接改变或更复杂的遗传改变而导致抗原丢失。靶向BCMA治疗可在进展时下调BCMA表达,但在大多数情况下是可逆的。尽管BCMA完全丧失并不常见,但复发疾病更常表达较低水平抗原,有时低于最佳CAR-T细胞功能的阈值(体外和体内模型)。约7%的抗BCMA初治患者存在杂合子BCMA缺失(即16p染色体上TNFRSF17基因位点的单等位基因缺失),它是抗BCMA治疗后由于选择压力导致BCMA缺失的危险因素。16p染色体缺失似乎可与17p缺失同时发生,后者是一种典型的不良预后遗传改变。可溶性BCMA可能是早期检测BCMA表达缺失或下调的有用生物标志物。
有病例报告抗GPRC5D双抗治疗后双等位基因突变或结构染色体改变导致 GPRC5D 基因位点双等位基因丢失。由于需要反复给予双抗治疗,与 CAR-T 细胞治疗相比,恒定的选择压力可能有利于以更高的频率诱导抗原丢失。对抗或预防因抗原丢失导致的耐药的方法包括同时靶向一种以上的肿瘤相关抗原。例如,可以使用多特异性 CAR-T 细胞产品、三特异性抗体以及同时或序贯给予靶向不同抗原的T细胞衔接治疗。
CAR-T细胞相关耐药机制
如果输注的 CAR-T 细胞无法增殖,则反应通常短暂甚至无反应。在大多数多发性骨髓瘤患者中,外周血中 BCMA CAR-T 细胞水平在输注后前4周内达到峰值。有的患者输注后≥6个月仍可检测到 CAR-T 细胞持续存在,但不太常见。与峰值扩增不同的是,可检测到CAR-T 细胞的较长持续性与多发性骨髓瘤更持久的缓解无关。
除了CAR 的设计及其共刺激结构域外,T细胞健康度也与T细胞衔接治疗的反应相关,是治疗排序的重要考虑因素。CD19 CAR-T 细胞疗法的数据表明,与效应记忆或更耗尽的 CAR T 细胞相比,具有中央记忆或干细胞记忆表型的 CAR-T 细胞具有改善的抗肿瘤疗效。在多发性骨髓瘤中,接受 cilta-cel 治疗患者的相关数据表明,输注后前6周的CD4+ 和 CD8+中心记忆 CAR-T 细胞增加与更持久的缓解相关。
双抗的T细胞表型与结局存在相关性。调节性T细胞(Treg)水平的升高和持续与PFS下降有关,并且在复发时可以看到更高比例的耗竭T细胞。缺乏客观反应与免疫检查点的增加和持续表达相关。
正在研究逆转或预防耗竭和恢复 T 细胞功能的策略,许多研究集中于 PD-1 和 TIGIT 免疫检查点,其他策略包括使用小分子药物暂时抑制 T 细胞活性,并提供短暂的休息期以防止耗竭。在多发性骨髓瘤中,免疫调节剂(来那度胺和泊马度胺)和新型 cereblon 调节剂(iberdomide和mezigdomide)是与双抗或 CAR-T 细胞联合使用的有吸引力的辅助药物,可改善 T 细胞的增殖、活化和分化,包括肿瘤微环境。目前正在进行研究,以确定添加这些药物是否有助于增加T细胞衔接治疗反应的持久性。
耐药相关的肿瘤微环境因素
骨髓 TME 对肿瘤细胞的保护作用尤其重要,骨髓瘤细胞可通过细胞间接触以及通过可溶性细胞因子和生长因子,与细胞外基质内的基质细胞及免疫细胞库相互作用。树突状细胞是抗原呈递和协调 T 细胞活化所必需的,表现出微环境内功能受损,从而阻碍 T 细胞启动和活化。多发性骨髓瘤还对 CD4+ 和 CD8+ T 细胞功能和效应具有影响。骨髓瘤细胞可促进 Treg和髓源性抑制细胞 (MDSC) 扩增,进一步抑制针对肿瘤的有效免疫反应。NK细胞是对癌细胞具有细胞毒作用的先天性免疫细胞,在多发性骨髓瘤患者中表现出发育、分布和功能受损。最后,多发性骨髓瘤细胞和微环境中的其他细胞分泌的免疫抑制性细胞因子(例如IL-10 和TGF-b)可抑制有效的抗肿瘤免疫。
在多发性骨髓瘤中证实,免疫抑制性髓系细胞(例如MDSC)在T细胞衔接治疗后复发和耐药中发挥作用,一项小型研究表明 BCMA CAR-T 细胞治疗后复发时髓系细胞群显著增加。在接受 cilta-cel 治疗的多发性骨髓瘤患者队列中,免疫细胞群的单细胞分析也表明,较高水平的 MDSC 与较短的反应相关。此外,骨髓间充质基质细胞有助于保护骨髓瘤细胞抵抗 CAR-T 细胞,具有一定体外杀伤能力。许多免疫抑制性细胞可通过可溶性介质介导其作用,尤其是TGF-β。为了抵消 TGF-β在多发性骨髓瘤 TME 中的免疫抑制作用,开发了分泌 TGF-β显性负结构域的装甲CAR。
参考文献
Mohan M,et al.Charting the Course: Sequencing Immunotherapy for Multiple Myeloma.Am Soc Clin Oncol Educ Book . 2024 Jun;44(3):e432204. doi: 10.1200/EDBK_432204.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#多发性骨髓瘤# #T细胞衔接治疗#
152