【JCI】综述:克隆性造血与髓系肿瘤
2024-11-02 聊聊血液 聊聊血液 发表于上海
《Journal of Clinical Investigation》近日发表综述,阐述了克隆性造血与髓系肿瘤的关联、驱动突变、转化风险及管理。现整理主要内容供参考。
在人类的整个生命周期中,血细胞通过细胞的分裂和分化不断形成,这一过程称为造血。在这个层次的顶端是一个罕见的5万到20万个多能造血干细胞(HSC)群体,它们产生更多的祖细胞,其后代最终产生所有的血细胞谱系。包括造血干细胞在内的所有细胞在整个生命过程中都会获得体细胞突变,虽然大多数突变无关紧要,有时甚至是有害的,但特定的罕见突变可以赋予fitness优势,使宿主HSC及其携带突变的后代能够扩大并占据HSC群体的很大一部分,这一过程称为克隆性造血(CH)。在大多数携带者中,CH仍然是亚临床的,但在少数情况下会发展为髓系肿瘤(MN),如急性髓性白血病(AML)、骨髓增生异常综合征(MDS)或骨髓增殖性肿瘤(MPN)。
《Journal of Clinical Investigation》近日发表综述,阐述了克隆性造血与髓系肿瘤的关联、驱动突变、转化风险及管理。现整理主要内容供参考。

部分老年健康女性个体表现出扭曲的x染色体失活模式,从而为CH提供了早期证据。后基因组学时代的多项关键研究表明,CH的特征为在没有任何明显血液肿瘤的个体中,在少数基因中存在反复出现的、赋予fitness的“驱动”突变,其中大多数与白血病有关。随着年龄的增长,这一过程越来越普遍,70岁以上人群中高达10%-20%,随后的一项研究利用二代测序(NGS)检测到50-60岁人群中多存在CH非常小的克隆。CH的一个典型特征在于它与发生血液恶性肿瘤的风险增加有关,且该风险的大小根据驱动突变的性质、克隆大小及CH产生的环境而变化。
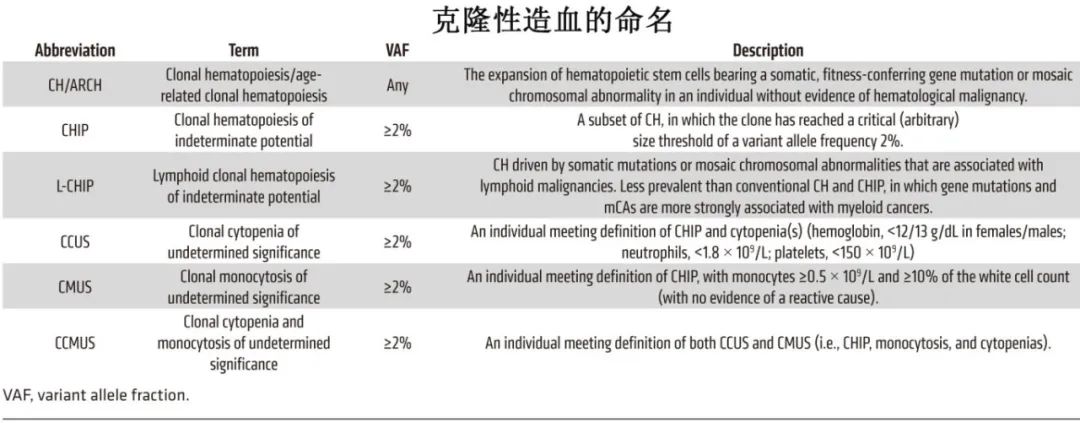
大多数CH是由一组有限的基因突变所引起,主要是参与表观遗传调控(DNMT3A、TET2和ASXL1)、信号转导(JAK2)、剪接(SF3B1、SRSF2和U2AF1)和DNA损伤反应(DDR、TP53和PPM1D)的基因突变。
CH与血液恶性肿瘤的关联
2014年,Genovese等和Jaiswal等发表了具有里程碑意义的论文,确立了CH与恶性血液病之间的关联。此后的几项研究证实了该关联,并表明主要与髓系肿瘤进展相关,包括AML、MDS和MPN,它们代表一个肿瘤族系,每年的总发病率约为12/10万人。分子学异质性是所有MN亚型的特征之一,在MN谱系中发现的许多突变基因和基因组畸变都是CH的驱动因素,因此认为CH是一种癌前病变,CH和MN之间的关系可以类似于意义未明单克隆免疫球蛋白血症(MGUS)和多发性骨髓瘤(MM)或单克隆B淋巴细胞增生(MBL)和慢性淋巴细胞白血病(CLL)之间的关系。与MGUS和MBL类似,CH可先于MN发展多年,总体年进展率约为0.5%-1%;但驱动每个克隆的具体体细胞突变强烈影响进展为MN的风险和性质。
虽然DNMT3A是CH中最常见的突变基因,但与其他CH亚型相比,DNMT3A-CH的转化风险较低。然而对于高度fit的R882热点突变,其转化风险明显更高,并且比非R882 DNMT3A-CH发展为AML的可能性高8倍。同样值得注意的是,未发现DNMT3A-CH与MDS或MPN进展显著相关。在其他常见突变的表观遗传修饰因子中,TET2-CH会适度增加发生AML或MPN的风险,而ASXL1-CH则与MN的所有主要亚型都有较强关联。一个重要的例外为TET2-CH与CMML之间的显著关联(风险比91.5),但TET2-CH导致CMML的绝对风险较低。
与由表观遗传修饰因子突变驱动的CH不同,由剪接因子基因SF3B1、SRSF2和U2AF1突变驱动的CH会产生更高的进展为MN的风险,特别是MDS。类似地,信号转导基因JAK2、CALR和MPL的驱动突变也可赋予进展为MPN的高风险;因为这些突变是相关恶性肿瘤的定义性特征:例如,SF3B1突变是MDS亚型难治性贫血伴环状铁母细胞(RARS)的特征,而JAK2、CALR和MPL中发生的突变是MPN的定义性突变(defining mutations)。
TP53突变CH与MN的相关性有差异,部分研究表明进展的风险很高,而另一些研究则没有发现显著相关性。鉴于TP53突变可导致MDS和AML预后不佳,这种异质性关联似乎违反直觉,它可能是多种混杂因素调节TP53突变克隆的行为和fitness的产物,因素包括先前暴露于细胞毒化疗、胚系致病性变异(Li-Fraumeni综合征)、双等位基因TP53丢失、突变类型(错义变异多表现为负面影响)。与之类似,大约20%的治疗相关性AML和MDS病例中存在PPM1D的功能获得突变,但在原发性(de novo)AML中却很少见,这与先前的化疗暴露强烈增强PPM1D突变CH克隆的fitness优势相一致。当PPM1D突变存在于tMN中时,它们通常为亚克隆,表明PPM1D突变在这种情况下可能间接反映基因毒性损伤,而非tMN的真正驱动因素。
除了单个突变基因外,驱动突变的数量和CH克隆大小也与进展密切相关。此外,转化的倾向与与驱动基因相关的相对生长速率成正比:例如,剪接因子突变是最fit的CH驱动因素之一,与进展为MN的高风险相关,而非r882 DNMT3A突变通常具有较低的fitness效应,并且进展不频繁。另一个因素为从CH到MN的进展模式。虽然CH是大多数MN病例的共同前驱疾病,但将无症状克隆性扩增(即CH)与恶性肿瘤联系起来的轨迹在不同类型的MN中有所不同。De novo AML的临床表现通常为爆炸性,先前健康的患者经常出现暴发性骨髓衰竭或白细胞停滞的并发症。De novo AML的两个最常见驱动因素为NPM1最后外显子的小重复/插入和FLT3的内部串联重复(FLT3-ITD)。尽管这些突变在AML中高度复发,但在CH中却明显不存在;表明这些突变的获得导致克隆快速扩增,并在短时间内转化为AML。Quiros等人的研究证实了该轨迹,他们在英国生物银行(UKB)中使用敏感的variant calling来识别NPM1突变人群;分析了200453个具有全外显子组测序(WES)数据的人群,发现只有两人具有NPM1突变,这两人都在5个月内发生AML。同样值得注意的是,这两人先前都有较大的DNMT3A-CH克隆,且DNMT3A(尤其是R882)、NPM1和FLT3突变在AML中共同发生较为常见;事实上,孤立性NPM1突变不足以转化为AML。综上所述,这意味着DNMT3A-R882等CH突变可促进NPM1突变的驱动效应,或增加获得这些突变的可能性,也可能增加获得FLT3-ITD突变的可能性,表面上是通过共享的致突变过程,因为两者都是具有相似分子解剖结构的插入突变。
与de novo AML相比,CH与MDS或MPN之间的区别不太明显(下图)。事实上,一部分由剪接或信号转导途径突变驱动的CH人群在进展为MDS或MPN时似乎并未获得进一步的驱动事件:例如,约1/4的SF3B1突变MDS病例未显示额外的驱动突变,45%的MPN仅携带单一驱动,即JAK2、CALR或MPL突变。在这种情况下,CH和MDS或MPN之间的转变并不明确,可能反映出克隆达到临界质量,从而明显扰乱血细胞计数,导致临床表现,或遗传性细胞变化的积累逐渐扰乱造血。

由于其渐进发展的性质,从CH到MDS的转变经常可以在CCUS的中间状态进行识别,此时形态学和血细胞减少的变化还不符合MDS诊断的定义标准。同样,CH和CMML之间的中间阶段最近被ICC定义为CMUS。相比之下,PV和ET的诊断标准不包括相应的“克隆性细胞增多症”。然而血红蛋白浓度或血小板计数的小幅上升可超过预定义的阈值,从而导致从CH到MPN的任意“跳跃”,这突出了当下的病理学分类无法充分捕捉从CH到MDS或MPN的生物学连续性和进展。
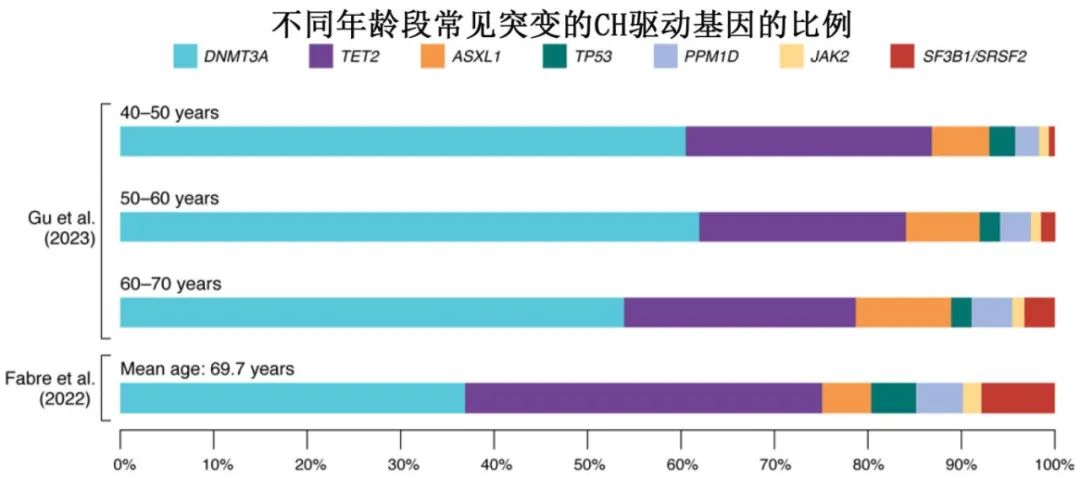
CH风险分层及MN预测
尽管最近治疗取得了进展,但AML和MDS患者的生存率仍很低。髓系恶性肿瘤发生之前有一段较长的、可检测的克隆性扩增临床前阶段,这提示有可能在这一时间窗内进行干预,以预防或延缓恶性转化。尽管目前仍缺乏恶性前干预手段,但实现MN预防目标的一个关键障碍在于CH的高患病率但总体进展率较低,因此当检测到CH时应准确预测MN风险,这对于了解哪些患者可以获益于临床随访和/或参加干预性研究很重要。
两个工作组独立地寻求利用UKB数据来解决该挑战。Weeks等在193743名UKB参与者中确定了11337例CHIP和CCUS,根据他们是否在10年内随访中发生MN事件进行标记,然后使用人口统计学、分子学和血细胞计数数据作为基于决策树的机器学习模型的特征。从最终模型中生成二值化特征后,将这些特征作为Cox回归模型的输入,生成系数,从中得出CH风险评分(CHRS),该评分将个体指定为MN低、中、高危。通过在一个未知的内部和两个外部队列中进行验证,发现这个简单、可解释的评分对MN事件有很强的预测作用,在一个外部CH队列中,低CHRS个体的事件发生率为0.6%,而高CHRS个体的事件发生率为15.2%。
相比之下,Gu等确定了CH人群,并对207035人的训练队列进行了前向逐步Cox回归,以拟合一个简约模型(称为MN-predict),利用人口统计学、分子、血细胞计数和生化数据预测无MN生存,并在一个不可见的内部测试集和两个外部CCUS队列中同样验证了该模型。与Weeks等的方法相反,Gu等分别对每个MN亚型进行建模; 不区分CH、CHIP或CCUS;并对每种MN(AML、MDS、MPN)的无MN生存期进行定量、时间依赖性预测。
每种方法都有其优点:Weeks等开发的CHRS提供易于解释的评分和临床医生容易理解的MN风险分类,而Gu等人采用的MN-predict法可提供对三种主要MN类型中每种类型发展可能性的细微连续估计(下图)。CHRS将临床常用的少量变量作为输入,但MN-predict也可以纳入其他变量,这些变量在临床实践中可能无法常规测量,尽管它仍然可以在没有这些变量的情况下产生可靠的预测。此外,只有MN-predict能够预测由U2AF1突变驱动的CH,因为该基因座在人类参考基因组中的问题排除了将其纳入CHRS的可能性。这两种方法都可以通过用户友好的网络界面(http://www.chrsapp.com和https://bioinf.stemcells.cam.ac.uk/shiny/vassiliou/MN_predict/)轻松访问,并且将成为未来确定患有CH、CHIP或CCUS的个体风险分层的重要工具(尽管目前这两种工具都没有经过美国食品和药物管理局或同等国家机构的前瞻性验证或审查)。在缺乏统一的CH风险分层策略的情况下,使用这两种模型或开发一种结合两者最佳方面的模型,可能有利于评估CH患者的MN风险。
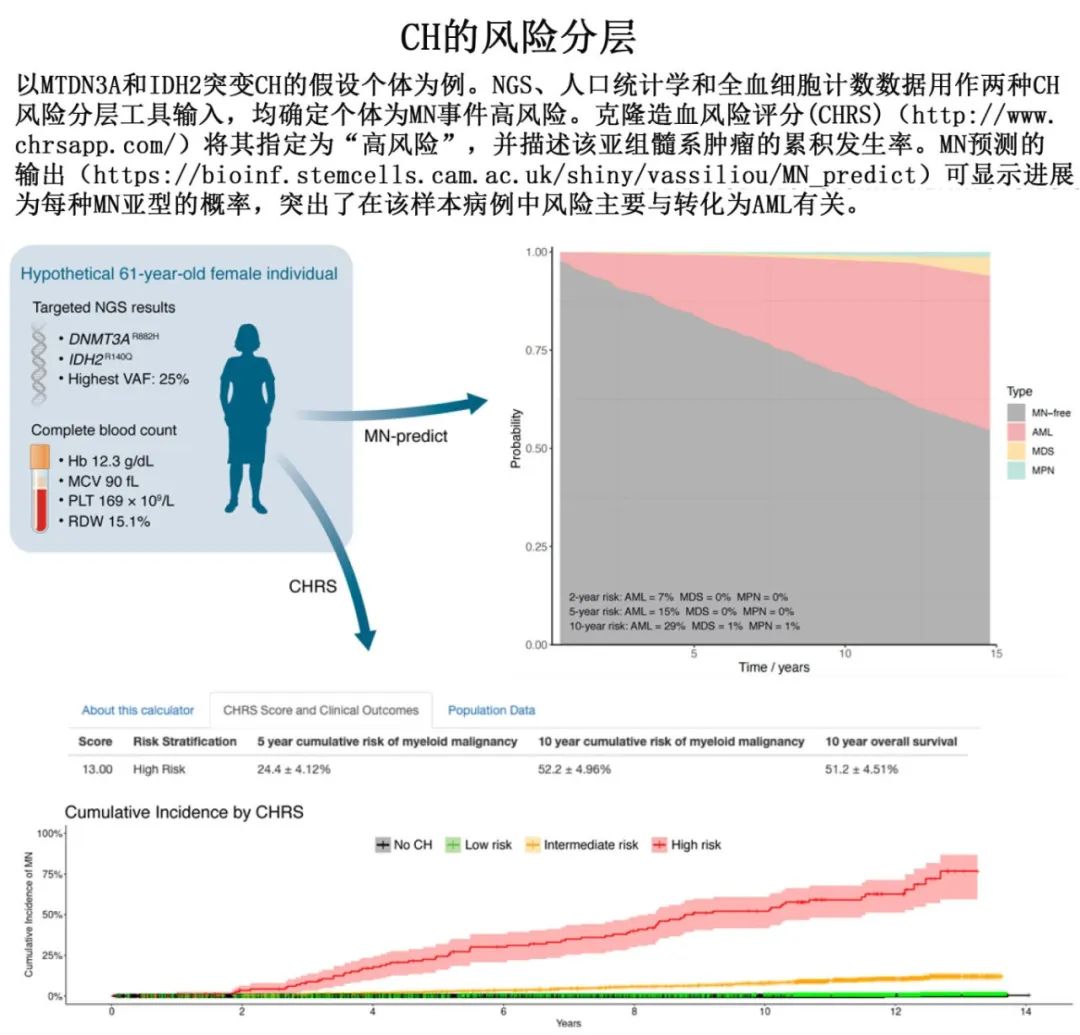
CH的临床管理与预防医学
随着NGS在诊断和研究中的应用越来越广泛,经常会偶然发现CH。由于CH是高龄患者非常普遍的现象,在临床决策中采用上述风险分层工具,对于确保高危CH患者密切随访并考虑纳入干预性研究非常重要。此外重要的是,了解临床背景对于指导患者的细致管理也至关重要,这些患者在决定临床管理之前需要考虑年龄、健康状况、对风险的感知、合并症、治疗史和其他因素。
目前还没有批准的治疗方法来防止CH进展为MN,事实上,CH患者在很大程度上是无症状的,因此任何此类干预措施都必须具有良好的耐受性和最小的毒性。此外,考虑到CH检测和MN发病之间的窗口期较长,在初始干预性研究中使用无MN生存期作为终点可能不切实际,因此需要使用替代终点,如CCUS的克隆大小减少或血液指标改善。最近启动的临床试验正在研究CH/CCUS的潜在治疗方法,包括抗IL-1β抗体canakinumab治疗高危CCUS(以减轻炎症驱动的克隆扩增) (NCT05641831),维生素C (TET2的辅助因子)用于TET2-CCUS (NCT03418038),以及靶向治疗探索,例如IDp/2抑制剂治疗IDp/2-CCUS (NCT05030441和NCT05102370)。在缺乏既定疗法的情况下,CH 诊所的重要作用在于确定患者进入 MN 预防的临床研究。此外在实践中,CH诊所可建立监测高危 CH/CCUS 的模式和频率,从而早期识别已转化为MN的患者,直至明确确立治疗 CH/CCUS 特定亚型的证据。以 MN 预防为重点的 CH 临床管理的拟定策略如下图所示。
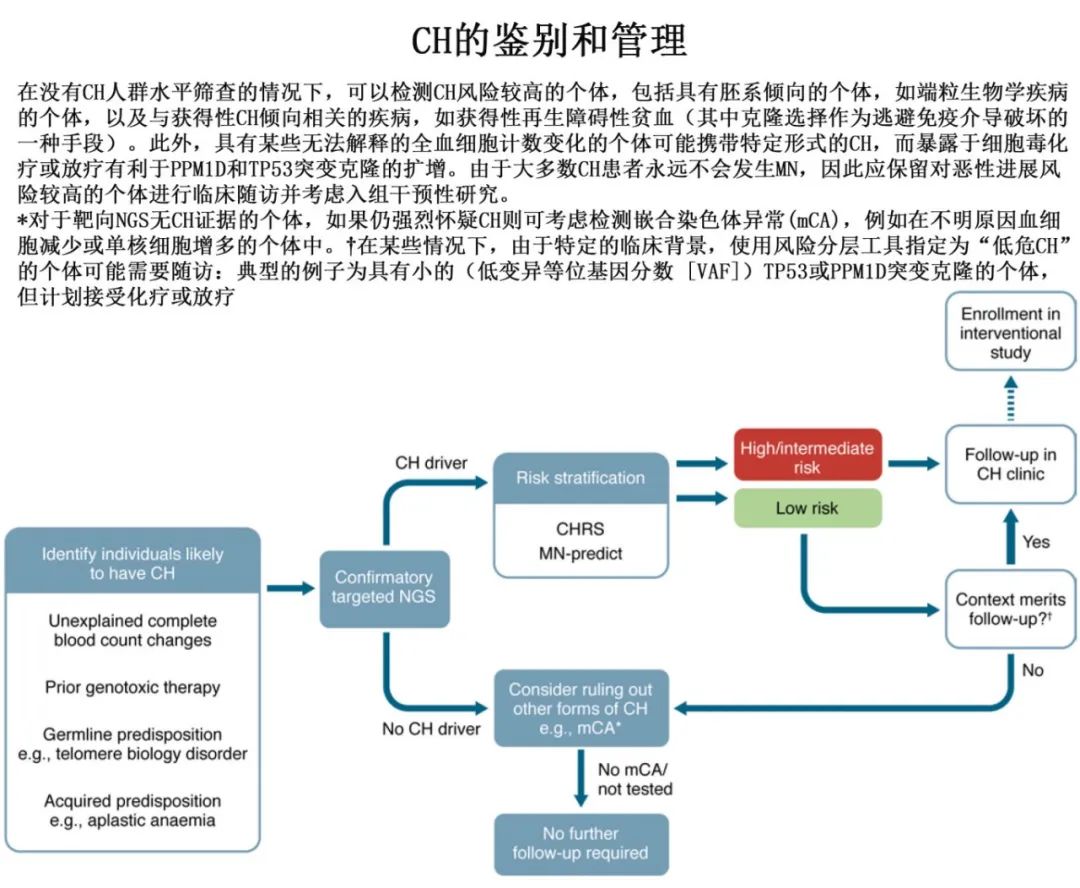
未解答的问题和挑战
尽管在过去十年中取得了巨大的进步,但在驱动基因CH和骨髓癌预防领域仍有许多未知因素。一个尚未解决的关键问题在于如何大规模检测CH。目前CH是通过NGS来识别,这种方法既昂贵又不切实际,无法大规模应用于未选择的人群,以识别MN高危的少数个体。为了解决这个问题,已经努力降低针对CH的NGS的成本,但在无症状个体中大规模应用这种方法仍然具有实际挑战性。另一种方法为,在更简单、更可扩展的检测基础上,针对具有较高风险的高危CH或CCUS个体进行NGS检测。由于已知CH会扰乱血液指标,如红细胞分布宽度和平均细胞体积,这样的方法可利用全血细胞计数数据来识别可能携带CH的个体,这些个体可以优先进行基因检测。
尽管在CHRS和MN-predict风险分层工具方面取得了进展,但预测从CH到de novo AML的进展仍然具有挑战性。例如,MN-predict对AML的预测性能低于MDS和MPN,可能反映出CH向不同MN亚型进展的不同轨迹,转化为de novo AML的速度更快。由于AML的预后仍然很差,改进风险分层工具以专门提高de novo AML的预测可能是未来几年的优先事项。
最后,虽然通过将NGS应用于大型队列已经确定了复发性驱动突变,但许多这些突变对突变HSC产生fitness优势的确切机制尚不清楚,而这对于设计靶向治疗以避免CH向MN发展至关重要。最引人注目的是,剪接因子突变的fitness效应尚未确定,剪接因子突变可驱动克隆快速扩增,并在干扰一个关键的细胞过程的同时带来较高的进展风险:自相矛盾的是,这些克隆在体外或体内都不能很好地扩增,而且随着造血变得越来越寡克隆,它们似乎在高龄时优先扩增。确定破坏关键分子过程(RNA剪接和DNA甲基化,其使细胞克隆性扩增)的机制,可能是为预防髓系肿瘤制定合理策略的关键一步。
参考文献
Dunn WG, et al. Clonal hematopoiesis and hematological malignancy.J Clin Invest . 2024 Oct 1;134(19):e180065. doi: 10.1172/JCI180065.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#髓系肿瘤# #克隆性造血#
17