精准肿瘤学的斯芬达克斯之谜
2024-08-18 小药说药 小药说药 发表于上海
探讨精准肿瘤学未来十年需解决的六个难题,包括治疗时机、突变致病性、组织嗜性、肿瘤克隆、患者因素、免疫治疗时机,以优化实体瘤治疗。
前言
保罗·埃尔利希(Paul Ehrlich)在大约一个世纪前构想出的针对微生物的神奇子弹,这一概念正被运用于现代肿瘤学:瞄准肿瘤以及周围促进生长的微环境,而不会对正常组织造成伤害。过去三十年取得的技术进步,即下一代测序(NGS)技术以及相关生物信息学算法计算能力的进步,使得这一目标正在成为实现。
2001年,人类基因组的第一次测序耗时约13年,耗资约27亿美元,而现在,测序只需几小时就能完成,而花费只需其中的很小一部分。这使得测序能够用于识别个体患者甚至肿瘤中不同克隆群体的致癌基因驱动因素,从而针对性地选择药物,这显著改善了某些癌症的预后。
然而,尽管我们在癌症治疗方面取得了实质性进展,甚至能够通过利用基因组学和精准肿瘤学治疗为一些癌症类型找到“灵丹妙药”。然而,实体癌的精准靶向尚未产生任何普遍反应性的结果,而且反应也不那么持久。精准肿瘤学未来的十年需要面对六个必须解决的难题,以优化精准肿瘤学在实体瘤中的应用,这也是我们都需要面对的斯芬达克斯之谜。
谜题1:如何掌握治疗的时机?
伊马替尼是治疗慢性粒细胞的有效药物,然而伊马替尼在应用于终末期CML的急变期时,应答率仅为10%,中位生存期约为1年。伊马替尼在这一阶段的低效性是因为发生了克隆进化,尽管BCR–ABL仍然是一个驱动因素,但出现了额外的分子异常并作为共同驱动因素。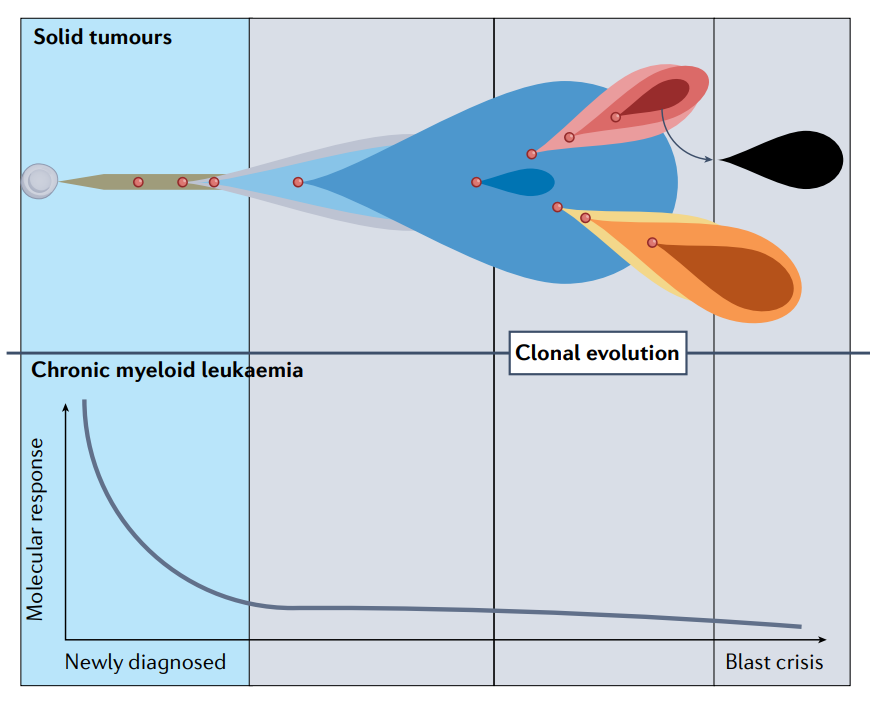
今天,实体瘤的精准靶向疗法应用于表现出多种共同驱动因素的晚期肿瘤,几乎所有针对实体癌的靶向治疗都是针对接受了大量预处理的晚期转移性疾病患者。尽管这些患者中的一些有反应,但反应往往是短暂的。在恶性肿瘤发生复杂克隆进化之前,在病程早期应用治疗可能对提高实体癌靶向治疗的成功率至关重要。因此,分析肿瘤中的分子遗传损伤应被视为所有癌症患者的一线策略,以确保早期和准确的治疗:在正确的时间为正确的患者提供正确的药物。要回答这个谜,需要精心设计的临床试验,在实体瘤发病早期进一步研究匹配的靶向药物。
谜题2:有害突变何时致病?
这个关键的谜题与恶性转化有关,即获得将健康细胞转化为癌细胞的体细胞突变。目前,已经有大量的癌症基因组和转录组学研究,出乎意料的是,在非恶性疾病中可以看到有害的基因组的变异,这使我们在治疗恶性肿瘤时应针对哪些分子异常产生困惑。
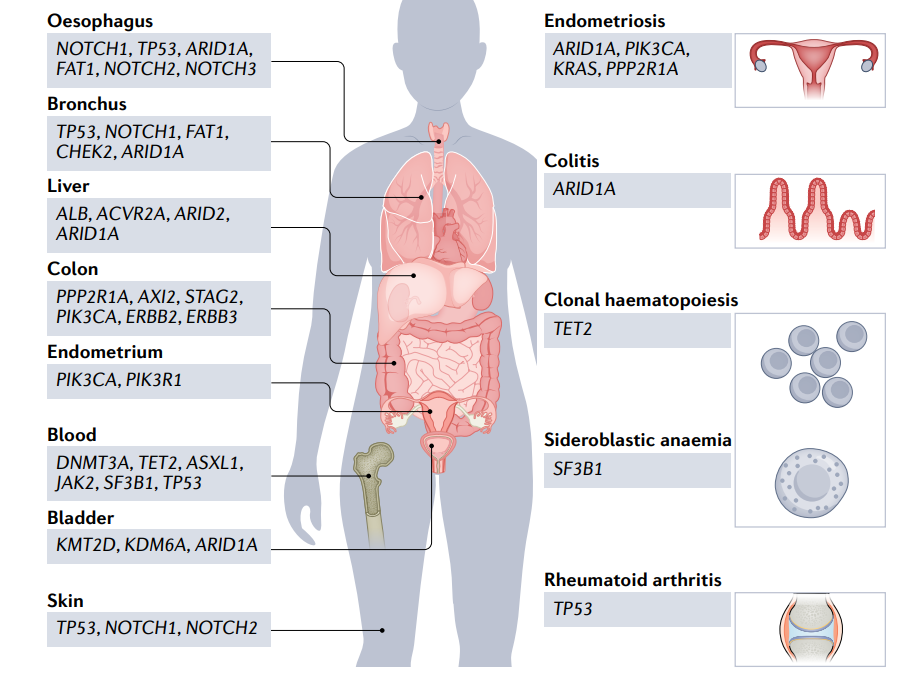
因此,必须谨慎确认有害突变在导致癌症中的作用。新的数据表明,对突变致病性的解释超出了确定突变是否导致有害功能改变的范围。例如,已经证实,在健康组织中也发现了癌症驱动基因的有害突变。对50至60岁患者的健康结肠隐窝进行的全基因组测序研究显示,约有3000个替换突变和300个缺失突变,相比之下,大多数结肠直肠癌的平均替换数为10000–20000个,缺失突变为1000–2000个。此外,BRAFV600E突变是另一个引人注目的例子。这些突变是大约50%的黑色素瘤和许多其他癌症的标志,并且是一种致病性驱动因素,然而,令人困惑的是,它们也存在于约80%的良性痣中,癌症转化的风险可忽略不计。
因此,在基本的科学层面上,上述观察提出了一个问题,即细胞转化为恶性癌细胞实际上需要哪些分子事件?这充分强调了在评估治疗目标时判断基因组改变的复杂性,需要充分理解与有害突变协同导致癌症的环境。
谜题3:癌症突变是否具有组织嗜性?
精准肿瘤学最有趣的特点之一是其组织不可知的方法。在特定组织中发现的几种突变已成功靶向其他部位的癌症。事实上,肿瘤的分子畸变可能与其起源组织一样重要,甚至更重要。
BRAF突变通常被认为是组织不可知范式的一个例外,因为靶向这些突变是毛细胞白血病和黑色素瘤的有效策略,而BRAF突变的结直肠癌对BRAF抑制剂的反应较差。然而,BRAFV600E结直肠癌中对BRAF抑制的反应较差是由于EGFR介导的MAPK通路的再激活,当靶向共激活通路时,BRAF抑制剂在结直肠癌中有效。这一发现最终导致批准了BRAF抑制剂encorafenib与EGFR抑制剂cetuximab联合治疗BRAF突变的结直肠癌。因此,分子畸变可能是新的癌症病理学的基础。
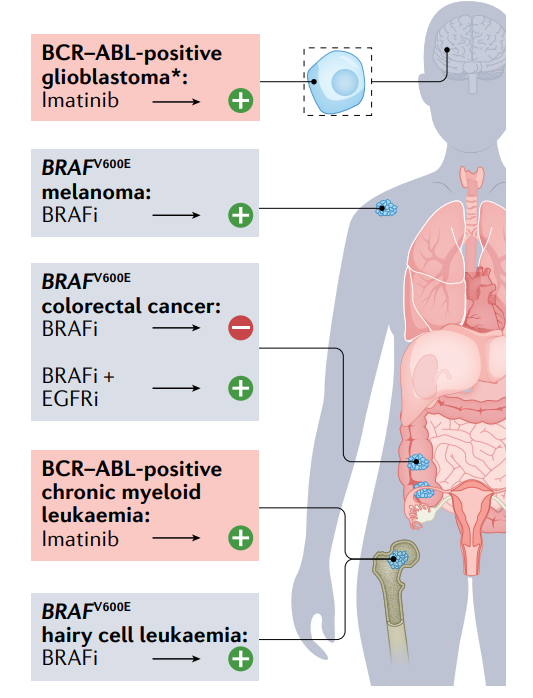
另外一个例子是BCR–ABL易位,这是CML的标志,除费城阳性急性白血病外,很少在其他癌症中发现。然而,最近一份引人注目的报告描述了BCR–ABL抑制剂伊马替尼对患有BCR–ABL突变的胶质母细胞瘤的患者的有益治疗。总的来说,上面的例子表明,仅根据起源部位预测单个癌症的潜在基因组基础是非常困难的。因此,每个肿瘤的通用NGS检测是合理解决方案。
谜题4:应该针对哪个肿瘤克隆?
克隆进化是癌症最重要的特征之一,目前尚不能进行治疗。在这一过程中,DNA完整性监测机制的丧失,如TP53突变所造成的机制,是恶性进展的一个重要特征。治疗压力下的克隆生长是复发和治疗抵抗的主要原因,因此是一个重要的治疗挑战。
从精准肿瘤学的角度来看,这一概念特别重要,因为通过基因组检测确定的可操作目标通常代表仅存在于一小部分肿瘤细胞中的亚克隆事件,在大块组织NGS中鉴定的基因组改变可能与肿瘤的某些部分无关。因此,精准肿瘤学的成功很大程度上取决于在避免治疗相关毒性的同时,可以同时靶向多少克隆。
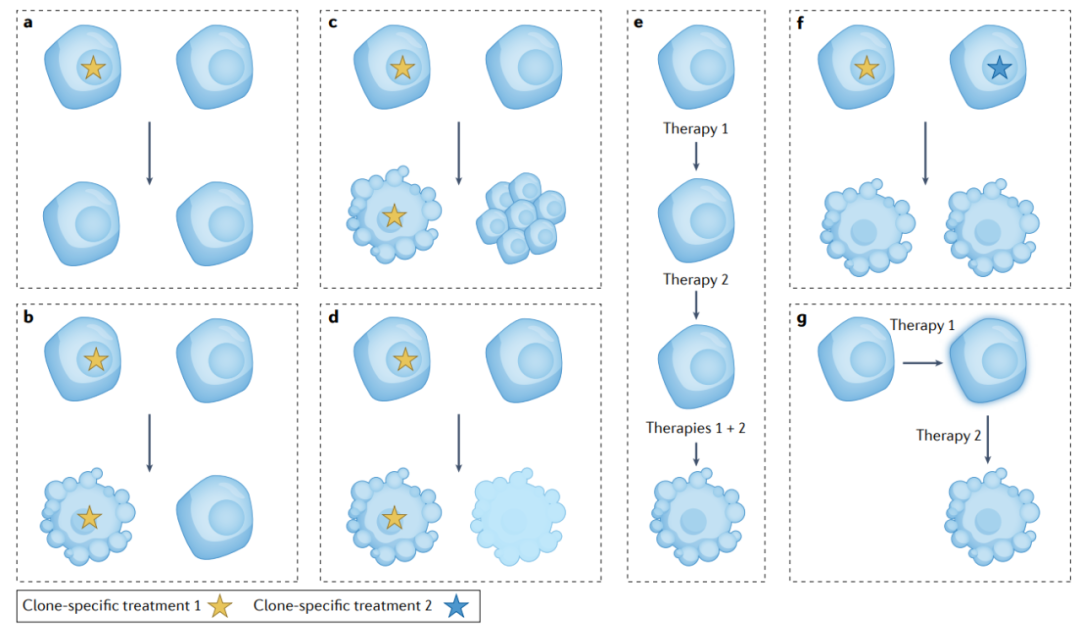
靶向由多个克隆组成的肿瘤中的单个克隆对姐妹克隆的影响尚不清楚。可以想象,一旦一个临床靶向克隆被清除,姐妹克隆之间对氧气或营养的竞争就可以得到缓解,这可能会加速未靶向克隆的生长,从而从竞争优势中获益,从而促进整个肿瘤的生长。这种混合反应是精准肿瘤学中的一个重要难题。
靶向特定突变对肿瘤整体表型的影响仍有待完全阐明。骨髓增生性肿瘤的研究表明,一组给定突变的获得顺序强烈影响疾病表型结果,因此在一种或多种基因组畸变的靶向治疗中可能很重要。此外,层级的概念意味着具有较高等位基因频率的突变可能比具有较低等位基因的突变对肿瘤更重要。
最后,由于不同的克隆可能具有重叠的和不同的分子变化,靶向会聚途径的概念可能会受到质疑,因为不同克隆中激活的突变不可能趋同。单细胞分子分析可能有助于揭示在同一细胞中同时发生或源自不同细胞的改变。在后一种情况下,治疗方案可能涉及直接靶向改变的基因产物或优化用于破坏关键恶性克隆的药物组合。
谜题5:对患者,我们还需要考虑什么?
肿瘤学家已经开始更仔细地考虑患者的人口统计学,因为越来越清楚的是,癌症发病率和肿瘤的遗传景观在不同的遗传背景和地理位置上有很大差异,这可能是由于不同的种系倾向和暴露于不同的传染性和毒性物质。此外,考虑生物学性别和年龄对于优化精准肿瘤学至关重要,因为治疗应答率和发病率在不同性别之间存在差异,但这些因素的治疗意义尚未得到充分认识。最后,个人特定的生活方式,如与吸烟或特定的西方饮食相关的生活方式可能会从根本上增加患癌症的风险,这些生活方式的后果应在肿瘤遗传景观和测序方面进行深入研究。
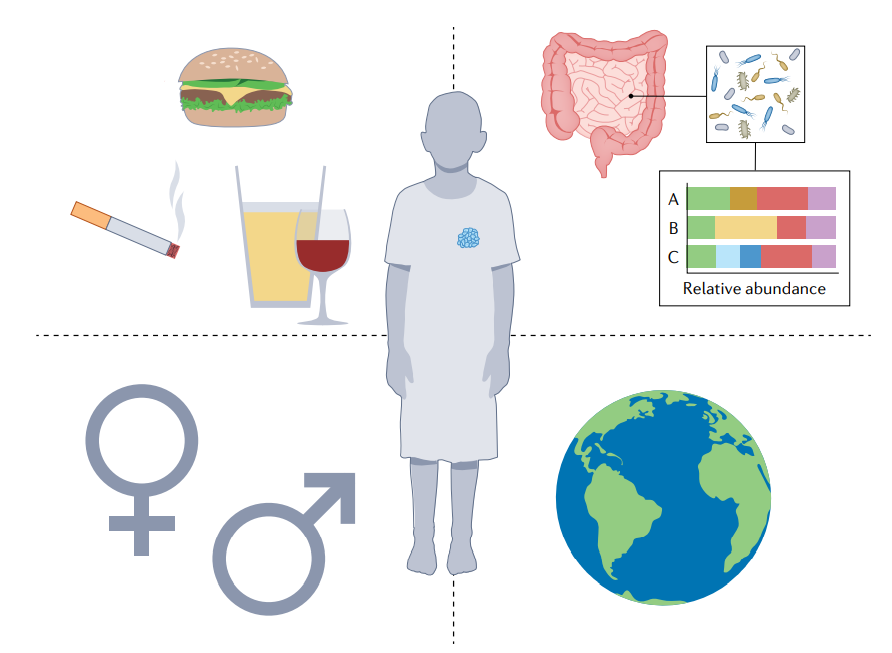
另一个关键的肿瘤外变量是微生物群。已经发表了许多与癌症相关的关联,然而将特定微生物群物种与表型联系起来的功能性研究仍然很少。此外,微生物群可能在确定特定基因组异常的结果中发挥作用,例如TP53突变的影响,根据局部菌群不同,TP53突变可能发挥促肿瘤或抑肿瘤作用。肠道微生物群也可能影响检查点阻断和嵌合抗原受体T细胞免疫治疗的结果。如今,微生物群对免疫疗法疗效的重要性已被越来越多地接受。
谜题6:免疫治疗的正确时机是什么?
癌症免疫治疗的一项关键成就是批准了抗PD1抗体pembrolizumab治疗具有高肿瘤突变负担(TMB)和微卫星不稳定性/错配修复遗传缺陷的肿瘤,这些肿瘤最有可能对免疫检查点阻断做出反应。高TMB肿瘤反应性背后的潜在生物学可能是,多个突变只能通过利用使免疫系统失活的检查点而存在,并且一旦该检查点被抑制剂阻断,免疫系统就会被重新唤醒。此外,突变负荷较高的肿瘤可能呈递更多的突变衍生的新抗原,从而增加肿瘤的免疫原性。然而,我们缺乏对其他因素的准确理解,这些因素可能在实现癌症的有效免疫治疗中发挥重要作用。
尽管TMB和PD-L1的高表达在临床决策中很重要,但免疫疗法的使用应伴随着完善的诊断标准,以确保针对正确的检查点。突变衍生的新抗原必须具有免疫原性,患者的主要组织相容性复合体必须能够充分呈递新抗原,必须能够识别所呈递的新抗原。
检查点阻断在高TMB癌症中的疗效与基因靶向治疗的效果形成对比,基因靶向疗法似乎在由单个基因改变驱动的CML等癌症中最为成功。然而,免疫疗法与基因靶向疗法结合可以显示出很高的疗效。目前尚不清楚在这些情况下,免疫疗法是否与其他疗法协同作用,或者不同的患者亚群是否受到这些组合药物的不同影响。
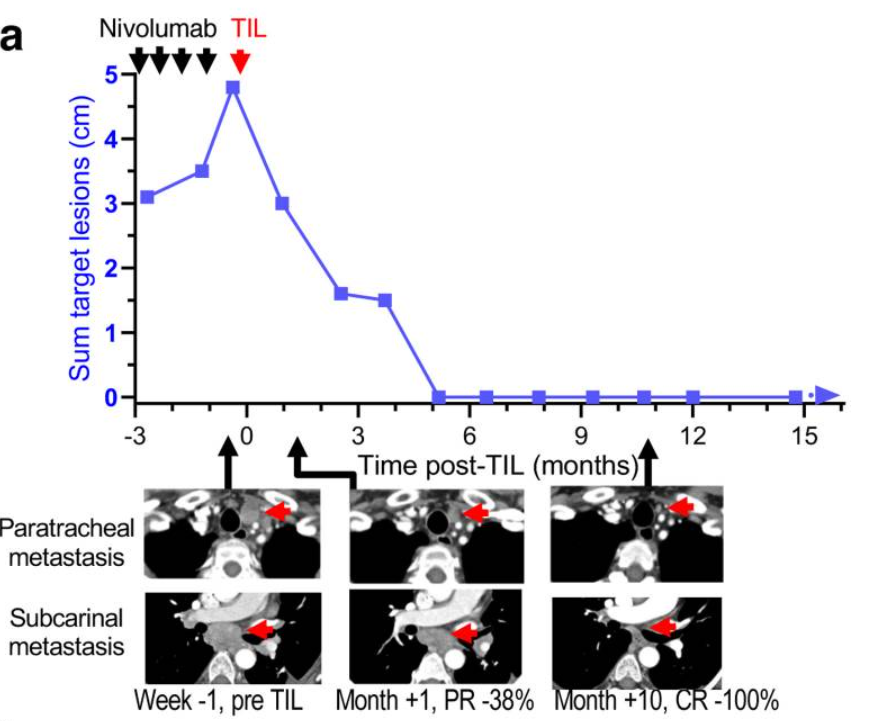
最后,一线免疫疗法正被批准用于越来越多的癌症类型。在最近一项研究中,使用抗PD1抗体dostarlimab作为直肠癌患者的新辅助治疗,所有12名患者都获得了完全缓解,这表明将免疫疗法应用到疾病早期需要更多的研究。
小结
癌症治疗的关键目标是开发专门针对癌细胞而不会对正常组织造成伤害的疗法。两种主要方法已经开始实现这一目标:基因靶向疗法和免疫疗法。这些方法在策略和最易受其影响的癌症类型上是不同的,因此,未来精准治疗的成功将需要在正确的时间给正确的患者服用正确的药物。
随着我们对癌症基因组的研究不断深入,困惑也随之出现。例如,在各种非恶性疾病中都发现了致癌驱动因素,这就引出了如何确定有害基因改变是否真的具有致病性的问题。此外,癌症背景下的其他关键问题还涉及起源组织在癌症中的作用,它如何影响基因组突变的生物学意义,宿主的基因组和其他特征如何影响治疗结果,以及哪些克隆是最佳靶向。
对这些问题的全面回答需要我们对宿主和癌症进行个体化的功能和表型表征,以利用先进的分析工具来确定如何最佳地靶向肿瘤,同时最大限度地减少对患者正常组织的损害。未来的十年,对这么问题的回答将引导我们开辟精准肿瘤学的新领域,在癌症治疗方面取得新突破。
参考文献:
1.The coming decade in precision oncology: six riddles. Nat Rev Cancer.2022 Nov 24.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#实体瘤# #精准肿瘤学#
46