《自然·医学》:科学家首次证实,病理学应答可以作为新辅助治疗的生存替代终点!
2023-11-14 衡道病理 衡道病理 发表于上海
在临床试验中,要评估一种疗法治疗癌症的效果,其金标准是能够改善患者的总生存期,但收集此类生存数据通常需要数年时间。对于针对早期阶段癌症的试验来说,这一时间将可能长达10年。
目前,新型新辅助疗法获批的替代终点可以是无事件生存期(EFS)。但这一终点在影像学评估(如实体肿瘤疗效评价标准RECIST)方面存在局限性,尤其是在早期疾病的背景下。因此,需要一套可在治疗早期阶段进行测量且与生存结果相关联的可靠度量标准,以便为治疗决策提供支持并加快临床试验的进程。
越来越多的数据显示,病理学缓解能够严谨、客观地反映癌症治疗的效果,有望成为新疗法批准的替代终点,但尚未确定最具临床意义和实用性的病理学缓解标准。
在免疫新辅助治疗临床研究中,病理学完全缓解(pCR;原发肿瘤[PT]+淋巴结[LN]中,0%残存活性肿瘤[RVT])和主要病理缓解(MPR;≤10%RVT)作为替代终点。然而,当%RVT超过pCR和MPR后,其预后价值目前尚未深入探索。
近日,由美国约翰·霍普金斯大学医学院的Janis M. Taube团队发表在学术期刊Nature Medicine中的一篇文章对这一问题进行了初步的探索,这项研究提供首个前瞻性证据支持%RVT可作为免疫新辅助治疗的生存期替代终点,并证实免疫新辅助治疗后残留活性肿瘤越少,患者无事件生存期越长。
研究人员通过对一项评估纳武利尤单抗联合化疗作为新辅助疗法治疗可切除性肺癌的3期临床试验(CheckMate 816)的各项数据进行分析,发现与影像学缓解和循环肿瘤DNA(ctDNA)清除率相比,残余活肿瘤(residual viable tumor,RVT)百分比与EFS的相关性最高,支持病理学缓解作为生存期的一种替代终点。
该试验证实了纳武利尤单抗联合化疗相比于单纯化疗能够显著改善可切除性非小细胞肺癌患者的EFS和病理学完全缓解率(pCR),并使该联合疗法作为新辅助治疗获得了监管批准。

论文首页截图
研究详情
研究人员开发了一个标准化的泛肿瘤评分系统来捕捉病理缓解的特征,包括免疫介导的肿瘤消退。该系统使用免疫相关病理反应标准irPRC进行评估,与病灶所处的位置无关,如原发肿瘤(PT)、淋巴结(LN)或远处转移,并对RVT评分(%)进行评估,分值为0-100%。
结果显示,在两个治疗组中,原发肿瘤为0%RVT(即pCR-PT)的患者无事件生存期(EFS)都得到显著改善。但是,化疗组中仅有4%人(n=5)达到pCR-PT,而纳武利尤单抗+化疗组中有32.6%人(n=46)达到pCR-PT。
对于接受纳武利尤单抗+化疗治疗的患者,pCR-PT与EFS改善相关,HR为0.18(95%CI 0.07-0.46);每增加1%RVT-PT,EFS的HR增加0.017(HR 1.017,95%CI 1.010-1.025)。
RVT-PT可预测纳武利尤单抗联合化疗的EFS(AUC=0.74):RVT为0%-5%、>5%-30%、>30%-80%以及>80%的患者的2年EFS率分别为90%、60%、57%和39%。患者的RVT每增加1%,EFS的HR就增加0.017。结合PT+LNs的病理缓解将有助于区分患者的结局。
没有观察到%RVT-PT与组织学亚型、PD-L1表达或肿瘤突变负荷、治疗相关不良事件发生率、淋巴结受累等临床特征相关。
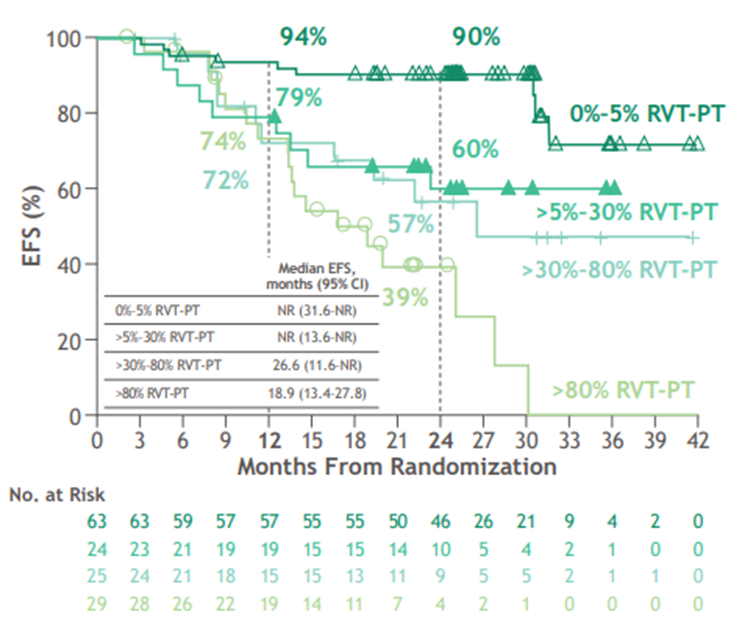
%RVT-PT与患者生存
在纳武利尤单抗+化疗组中,淋巴结受累的患者如果在治疗后淋巴结完全缓解(pCR-LN),那么其2年EFS率与从未淋巴结受累的患者相当(86% vs 77%)。
另外,研究团队发现,与单独评估原发肿瘤病理学相比,对淋巴结进行病理学评估能够提供额外的预后信息。具体来说,原发肿瘤和淋巴结都为0%RVT的患者2年EFS率为92%,其中一个部位为>0%RVT或两个部位都为>0%RVT的患者,2年EFS率分别为76%和49%。
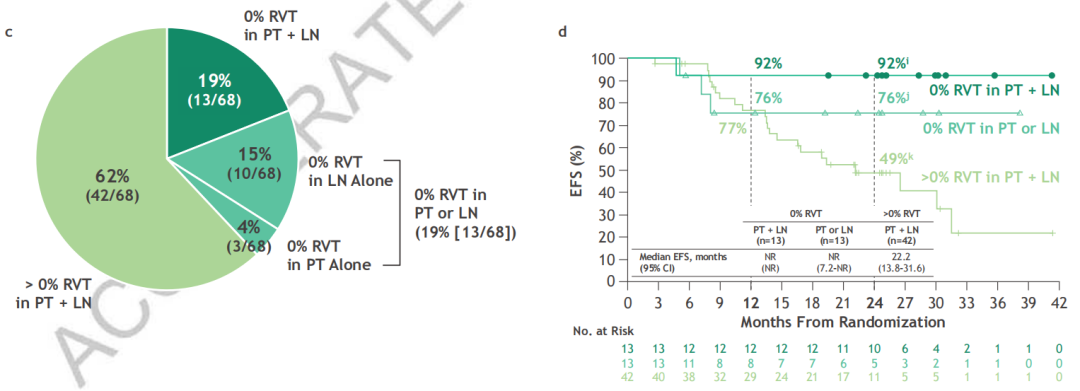
%RVT-PT+LN的预后价值
值得注意的是,影像学检查未能准确反映肿瘤病理学应答,部分患者在病理学上表现出缓解,但在影像学上未见明显变化,反之亦然。当循环肿瘤DNA清除率、影像学检查结果、病理学应答作为EFS的替代终点时,病理学应答为更优解。
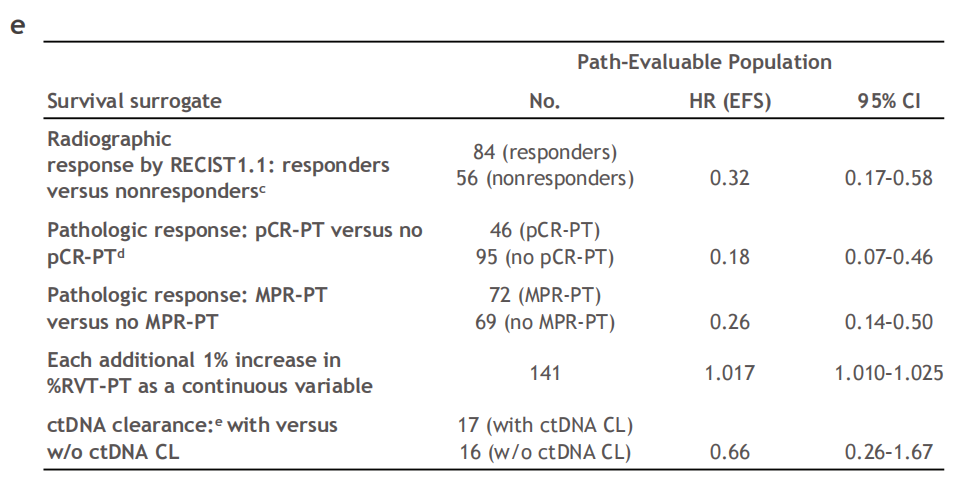
几种替代终点的对比
总而言之,该研究提供了在新辅助治疗中利用病理缓解作为评估肿瘤治疗效果的证据,并通过一个标准化的泛肿瘤评分系统对%RVT进行了全面的评估,有助于加速临床试验的设计和有效治疗方案的制定,为病理学应答作为新辅助治疗中的生存期替代终点提供了首个前瞻性证据。鉴于%RVT的预后价值,及其可以通过常规外科病理学工作流程进行评估、且评分系统适用于多种实体肿瘤类型的优点,%RVT或将成为指导术后辅助治疗的生物标志物,有助于确立更精细的病理学反应终点,并最终在临床诊断中建立新的标准。
衡道医学拥有国内体量规模领先的高端病理技术平台,成熟的病理诊断中心运营管理能力,覆盖十余个亚专科的病理诊断医生和专家团队,规范的质量管理和项目管理体系,以及领先的临床试验信息管理系统Starlims。可为申办方提供乳腺癌、肠癌、肺癌等多个癌种的新辅助治疗pCR病理学评估服务,助力推动精准医疗,提升研发效率、降低研发成本、增加研发成功率。
根据《中国乳腺癌新辅助治疗专家共识(2022年版)》,对于进行了新辅助治疗的乳腺癌病例,新辅助治疗前的粗针穿刺标本的病理学诊断需要准确和全面,除了应尽量明确肿瘤的组织学分型和分级,并通过免疫组化和/或原位杂交的方式检测ER、PR、HER2和Ki67,明确治疗前肿瘤的分子分型以指导新辅助治疗方案的选择外,还要求临床提供肿瘤的位置,肿瘤的大小和数量,以及有无钙化,这样便于确定治疗后肿瘤的缓解情况。
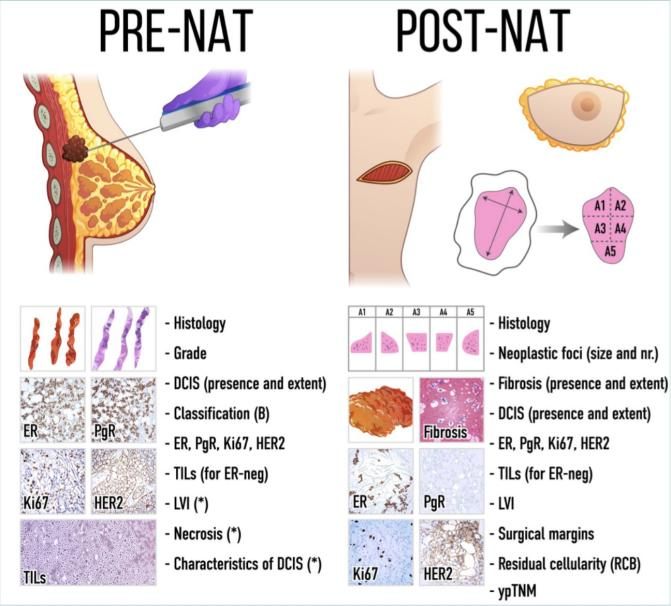
图1:新辅助治疗前后需要报告的病理内容。引自意大利乳腺病理研究小组的新辅助治疗前后乳腺癌标本病理检查的建议。
新辅助治疗后乳腺癌标本的取材可参考取材流程图(图2)。对于不同的标本类型和评估方式,取材方式不同。对于瘤床大体检查可见,将瘤床最大截面全部取材,体积过大这选取最大截面5块代表性组织镜下评估。如果大体检查不能识别瘤床,根据治疗前病灶部位,每1cm间距将瘤床截面全部取材,体积过大这间距1-2cm选取每个截面5块代表性组织镜下评估。
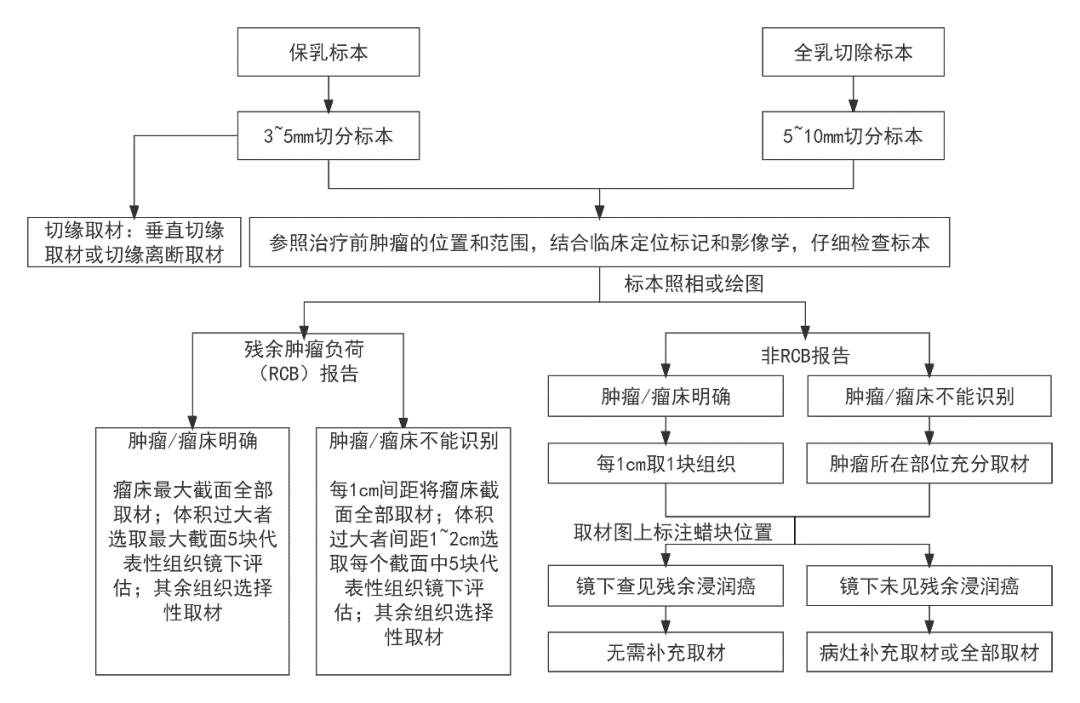
图2.乳腺癌新辅助治疗后乳腺标本取材流程
治疗效果的病理评估系统:
虽然评估新辅助治疗后病理学反应的标准各不相同,但大部分研究发现新辅助治疗后病理反应的程度与患者的预后密切相关。因此,准确评估新辅助治疗后的病理反应并予以报告非常重要。目前各项研究提出的新辅助治疗病理评估系统超过 15 个,常用的评估系统包括 Miller‑Payne(MP)系统、RCB 系统、Sataloff系统和AJCC ypTNM分期等。这些评估系统大多将治疗后反应分为pCR和非pCR两大类;而对于非pCR的患者,不同的评估系统按缓解程度进一步分类。以上病理评估系统各有优缺点,可以结合项目情况选择一种病理评估系统对乳腺癌的新辅助治疗疗效进行评估。
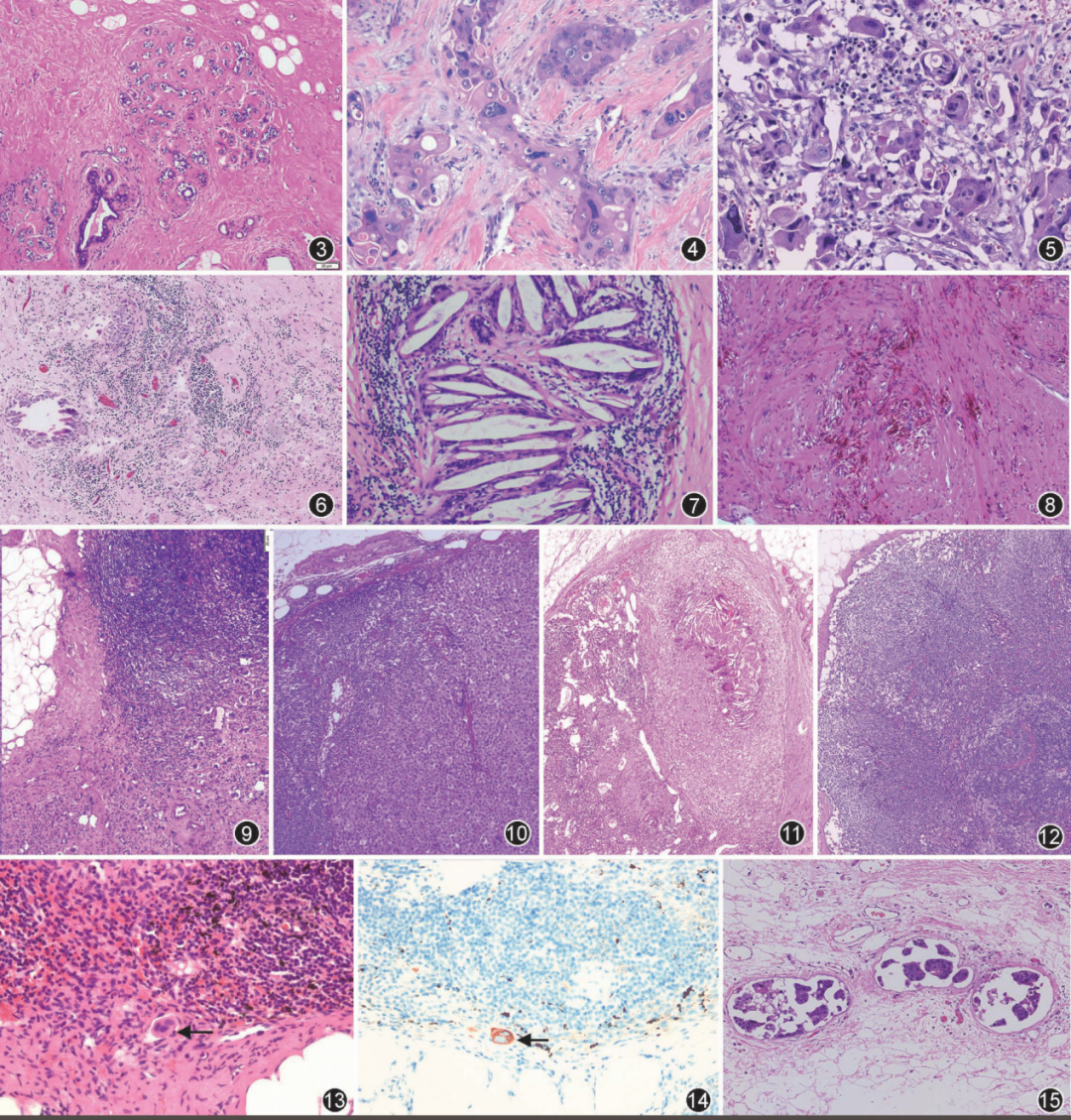
图3.正常终末导管小叶单位内腺泡萎缩、基底膜显著硬化;
图4.肿瘤细胞胞质嗜酸性变、空泡变,细胞核增大;
图5.治疗后出现的奇异型巨核或多核瘤巨细胞;
图6.瘤床淋巴细胞、浆细胞浸润,泡沫细胞沉积伴钙化;
图7.瘤床炎性细胞浸润伴胆固醇结晶及肉芽肿反应;
图8.瘤床纤维组织增生伴含铁血黄素沉着;
图9.伴治疗反应的淋巴结转移癌;
图10.缺乏治疗反应的淋巴结转移癌;
图11.伴治疗后改变的阴性淋巴结;
图12.缺乏治疗反应的阴性淋巴结;
图13.淋巴结中的孤立性肿瘤细胞(箭头);
图14.淋巴结中孤立性肿瘤细胞呈CKpan阳性染色(箭头)非生物素标记Multimer检测;
图15.新辅助治疗后乳腺组织残余脉管内肿瘤。
衡道医学是国内领先的综合病理服务机构,旗下拥有上海衡道和北京衡道两大中心实验室,现已通过国际ISO15189 CNAS认证,满分通过多项CAP PT室间质评,具备国际标准的质量体系建设能力。
深耕病理,赋能医药,衡道医学作为经备案的“中方单位”,在处理国内的临床试验样本时具备很大的优势。此外,作为国内头部的病理诊断机构,衡道医学所出具的报告都是由阅片经验丰富的执业病理医生签发,已成为众多国内外制药及医疗器械企业首选合作方,在百余项药物及器械注册临床试验中承担着“病理中心实验室”(Pathology Central Lab)的重要角色,为临床试验中的病理诊断和检测提供真实、准确、完整、可追溯的结果与记录。
参考文献:
https://www.nature.com/articles/s41591-023-02660-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







