腺样囊腺癌,不寻常的头颈部肿瘤
2023-10-27 大乘医学资讯 大乘医学资讯 发表于上海
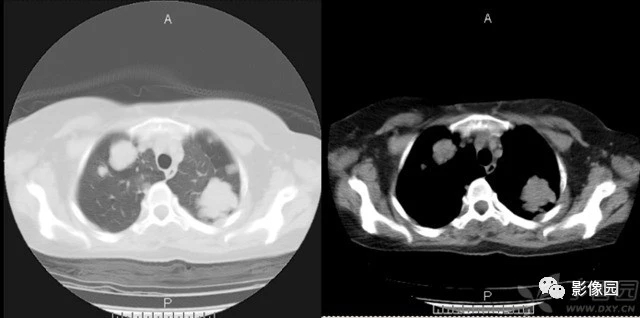
腺样囊性癌是一种较为少见的肿瘤,仅占头颈部肿瘤的3-5%,唾液腺肿瘤的10%。涎腺是ACC最常见的原发部位,但泪腺、鼻窦、乳腺、皮肤和生殖器官也可发生。
对于绝大多数人来说,相信这是第一次听说有腺样囊腺癌这一类肿瘤。腺样囊性癌(Adenoid cystic carcinoma, ACC)是一种较为少见的肿瘤,仅占头颈部肿瘤的3-5%,唾液腺肿瘤的10%。涎腺是ACC最常见的原发部位,但泪腺、鼻窦、乳腺、皮肤和生殖器官也可发生。这种肿瘤的特点是进展相对缓慢,但具有侵袭性生长,患者的5年和10年生存率分别约为60%和50%。值得注意的是,由于局部高复发率和高比例的延迟远处转移率,20年生存率仅为20%。肺是最常见的转移部位,而神经周围浸润是ACC局部进展的特征,因此临床上早期即可出现疼痛、麻木或面瘫等症状。神经周围浸润(PNI)已被证明是一个不良的预后因素,而组织学分级对预后的影响不明。
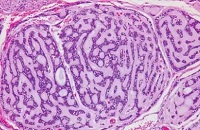
根据肿瘤细胞类型和排列方式分为三种组织类型:
①腺性(筛状)型:主要特点是肿瘤细胞团块内含有筛孔状囊样腔隙,与藕的断面相似;筛孔内充满嗜酸或嗜碱性黏液样物质,腔隙周围有基底膜样结构;
②管状型:主要特点是以肿瘤细胞形成小管状或条索状结构为主;管状结构的内层衬有导管细胞,外层为肿瘤性肌上皮细胞;
③实性型:肿瘤细胞排列成大小不等的上皮团,大的团块中心组织可变性坏死,管状和筛孔状结构较少。实性型通常比其他类型容易复发和早期转移,预后差。
治疗方式
无论原发肿瘤位于何处,腺样囊性癌(ACC)最常见的治疗方法是完全手术切除±术后放疗。当根治性切除(R0)风险过高或可能导致致命并发症时,R1切除(近缘切除)加辅助治疗是可接受的,可获得较好的预后。
顺铂、阿霉素和环磷酰胺(CAP)联合用药是ACC最常见的治疗方案,有时与5-FU联合用药。在5项研究中,27%的患者(12/43)出现了客观反应。CAP+5-FU方案治疗的患者客观反应持续时间最长。然而,这种治疗毒性太大,不能被认为是标准治疗。顺铂、阿霉素联合博莱霉素治疗,9例患者中3例客观缓解。环磷酰胺、长春新碱和5-FU联合应用后,客观反应持续时间较长。
在90%的ACC肿瘤中证实c-Kit高表达。但单一药物伊马替尼(靶向c-Kit)在ACC中无客观反应。达沙替尼,也针对c-Kit,没有显示任何客观反应。在一项试验中,顺铂和伊马替尼联合治疗,显示3例(10%)部分缓解。ACC中表皮生长因子受体(EGFR)表达增加。然而,EGFR抑制剂的临床试验(如西妥昔单抗、吉非替尼、拉帕替尼)并没有提供积极的治疗反应。
在约76%的ACC患者中,血管内皮生长因子(VEGF)高表达,增加了VEGF功能可能与复发和转移相关的可能性。也有研究表明,MYB过表达促进了包括VEGF在内的几个靶基因的表达。因此,VEGF受体(VEGFR)可能被认为是ACC潜在的治疗靶点。Chen和他的同事在一项临床前研究中显示了瑞戈非尼regorafenib的有效性,在2个病人来源的异种移植(PDX)小鼠模型中,它导致了肿瘤生长和转移的延迟。为了观察转移治疗的效果,他们将标记的ACC细胞植入斑马鱼胚胎中。与对照组相比,Regorafenib治疗抑制ACC细胞迁移和血管内侵袭。一些靶向vVEGFR的药物正在进行临床试验。舒尼替尼、瑞戈非尼和nintedanib均未观察到客观缓解,但索拉非尼、阿西替尼和Lenvatinib的客观缓解率为9-16%。这些数据表明,vegfr靶向治疗的疗效有限。特别地,Tchekmedyian及其合作者表明,lenvatinib可导致最长的中位无进展生存期(mPFS)为17.5个月。
复发性t (6; 9) (q22-23;p23-24)易位是ACC中一种常见的染色体异常,导致原癌基因(MYB)与转录因子基因(NFIB)融合。在大约50%的ACC肿瘤中观察到MYB-NFIB基因融合。有趣的是,35%的MYB-NFIB基因融合阴性ACC有MYBL1基因改变。大约80%的ACC存在MYB或MYBL1基因的改变,MYB样信号可能参与了ACC的肿瘤发生和维持。
全反式维甲酸(All-trans Retinoic Acid, ATRA)已经被证明对MYB有抑制作用。在MYB易位阳性ACC的PDX模型中,ATRA和维甲酸激动剂可抑制肿瘤生长。通过检测ACC异种移植瘤的凋亡(cleaved caspase-3)和增殖(Ki-67)指数,发现ATRA治疗可诱导肿瘤细胞死亡,但对肿瘤细胞增殖无显著影响。
DNA损伤传感器激酶ATR是MYB的下游治疗靶点,在原发性ACCs和ACC患者来源的异种移植(PDXs)中过表达。ATR激酶抑制剂VX-970可诱导MYB阳性ACC细胞凋亡和ACC PDXs的生长抑制。ATR应该是MYB下游一个可操作的靶点。
针对MYB的免疫调节治疗是另一个正在进行的研究领域。TetMYB疫苗是一种针对MYB的DNA疫苗。它是使用来自破伤风毒素的两个强有力的CD4表位结合的全长MYB互补DNA (cDNA)生成的,然后克隆到DNA疫苗载体pVAX1。在多项研究表明TetMYB疫苗对结直肠癌具有肿瘤抑制作用后,一项针对结直肠癌或腺样囊性癌的I期临床试验目前处于活跃状态。
NOTCH信号是一种进化保守的细胞命运决定通路,在许多成人组织中调节干细胞,以及在病理条件下,如癌症。最近的数据证实了NOTCH1信号与癌症干细胞之间的相关性。在CD133+细胞中,NOTCH1的表达高于CD133-和未排序的细胞。在低附着培养条件下,NOTCH1的沉默抑制了球体的形成。NOTCH1信号也表明患者预后不良。NOTCH1突变导致NOTCH1的激活,这是由带有HES1启动子的荧光素酶报告基因所证明的,HES1是NOTCH1的转录靶点。NOTCH1突变在大约13-14%的ACC患者中被发现。与NOTCH1野生型肿瘤相比,具有NOTCH1突变的患者具有更强的实体亚型的侵袭性组织学,更短的无复发生存期和更短的总生存期。尽管器官累及肺外的远处转移患者预后较差,但NOTCH1突变患者在肝脏和/或骨中发生转移的可能性更高。
notch通路可以被泛notch抑制剂靶向,如γ -分泌酶抑制剂或Notch1抑制剂。临床前研究证实了Notch抑制剂的显著活性(例如:brontictuzumab, Notch1抑制剂;AL101, pan-Notch抑制剂)在NOTCH1突变体ACC PDX中的表达。在这两项研究中,brontictuzumab和AL101对缺乏Notch1激活突变的肿瘤没有显著影响。对于AL101,也进行了联合顺铂或依维莫司(mTOR抑制剂)的研究,但这种联合治疗对Notch1突变阳性肿瘤没有额外的好处。这些临床前研究表明,在使用Notch抑制剂治疗患者时,选择并治疗表现出NOTCH1突变的患者可能更有效。一些新出现的数据显示,Notch抑制剂对ACC患者有益。在一项BMS-986115(泛notch抑制剂)I期研究中,显示了一些临床益处,包括2例ACC患者的稳定疾病(SD)。在一项关于crenigacestat(泛notch抑制剂)的I期研究的扩展中,纳入了一组22名ACC患者。在该队列中,14例(64%)患者的Notch免疫组化阳性,但未给出突变状态。在该试验中,1例患者出现未证实的部分缓解(PR)(15%), 15例患者出现SD (SD)。在一项I期试验中纳入的12例患者中,使用brontictuzumab治疗也显示了2例PR患者和3例SD患者的临床获益。Bronticutuzumab(特异性Notch1抑制剂)有望降低与肠隐窝Notch抑制相关的全身毒性(如腹泻)。然而,腹泻的频率和级别与其他泛notch抑制剂的报道具有可比性。目前,AL101 (Gamma Secretase Inhibitor)的一项II期临床试验正在招募NOTCH1突变的ACC患者(NCT03691207),另一项I/IIA期研究正在招募包括ACC在内的晚期或转移性实体瘤患者(CB-103,靶向NOTCH转录复合物在细胞核中的组装)
NOTCH信号是一种进化保守的细胞命运决定通路,在许多成人组织中调节干细胞,以及在病理条件下,如癌症。最近的数据证实了NOTCH1信号与癌症干细胞之间的相关性。NOTCH1突变在大约13-14%的ACC患者中被发现。与NOTCH1野生型肿瘤相比,具有NOTCH1突变的患者具有更强的实体亚型的侵袭性组织学,更短的无复发生存期和更短的总生存期。尽管器官累及肺外的远处转移患者预后较差,但NOTCH1突变患者在肝脏和/或骨中发生转移的可能性更高。
Notch通路可以被泛notch抑制剂靶向,如γ-分泌酶抑制剂或Notch1抑制剂。临床前研究证实了Notch抑制剂在NOTCH1突变的ACC PDX中的显著活性(例如:brontictuzumab, Notch1抑制剂)。在一项BMS-986115(泛notch抑制剂)I期研究中,显示了一些临床益处,包括2例ACC患者的稳定疾病(SD)。
抑制PD-1/PD-L1通路在ACC中的治疗潜力尚不清楚。一项PD-1抑制剂派姆单抗(pembrolizumab)的临床试验,在ACC患者中未观察到客观反应。派姆单抗联合放疗并没有导致肿瘤消退。即使vorinostat和派姆单抗联合治疗,ACC的治疗效果也仅为8%(1/12),派姆单抗无其他治疗效果。研究者发现ACC患者CD8+、GrB+、TIL、CD1a和CD83的比例较低,CTLA-4和PD-1在其免疫微环境中表达缺失。
术后辅助放疗并不显著影响患者的生存结果。粒子疗法,包括质子和碳离子疗法,已经在ACC中进行了研究。与基于适形光子的计划相比,可能允许进一步减少对正常结构的剂量。由于ACC患者常采用颅底治疗,质子对耳蜗、脑干和颞叶等关键结构的剂量降低,起到更好的保护作用。对于不可切除的ACC,粒子治疗最终显示出24%-57%的5年局部控制率,总生存率为26.5%-87%。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言