论文解读| Min Deng/ Ye-Xiong Li/Zhenkun Lou教授团队揭示胰腺癌中AMPK激活的新机制
2024-09-17 Genes and Diseases Genes and Diseases 发表于上海
该研究揭示了ECM硬度通过Hippo激酶信号通路调控AMPK活性的新机制,并探讨了这一机制在PDAC治疗中的潜在应用。1、AMPK活性与ECM硬度的关系
胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)是一种高度恶性的肿瘤,其特点是肿瘤微环境中细胞外基质(Extracellular matrix, ECM)的硬度较高。细胞外基质的硬度不仅影响细胞的行为,还与肿瘤的进展和预后密切相关。AMPK(Adenosine monophosphate-activated protein kinase)是细胞能量代谢和肿瘤进展中的关键调控分子,其活性受到多种信号通路的调控。然而,ECM硬度对AMPK活性的影响尚不明确。
来自中国医学科学院肿瘤医院/北京协和医学院的Min Deng/ Ye-Xiong Li教授团队以及美国Mayo Clinic的Zhenkun Lou教授团队在本刊发表了题为“Regulation of AMPK activation by extracellular matrix stiffness in pancreatic cancer”的研究论文。该研究揭示了ECM硬度通过Hippo激酶信号通路调控AMPK活性的新机制,并探讨了这一机制在PDAC治疗中的潜在应用。
1、AMPK活性与ECM硬度的关系
研究团队发现,在低ECM硬度条件下培养的细胞显示出增加的AMPK活性,并且细胞的糖酵解代谢受到抑制。此外,敲除 AMPKα 亚基的细胞失去了ECM刚度诱导的 ACC1 磷酸化和代谢转换,表明 AMPK 在ECM刚度介导的代谢转换中发挥着重要作用(图1)。
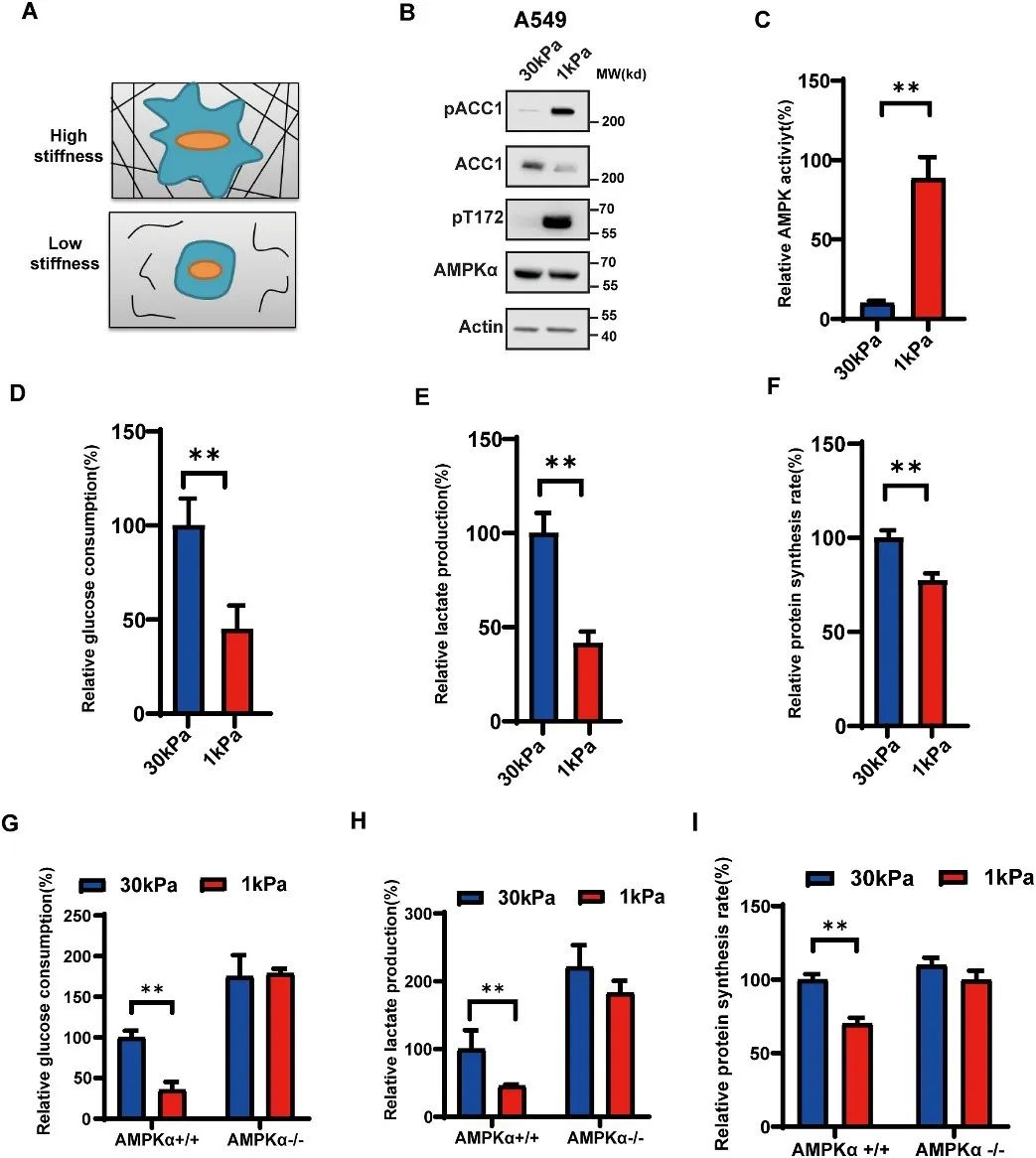
图1 AMPK在低ECM刚性条件下被激活,并介导细胞的代谢转换(原文中Figure 1)。
2、AMPK活性的调控不依赖于LKB1和CaMKKb
AMPK的经典激活途径是通过LKB1 激酶和 CaMKKb 激酶磷酸化AMPKα亚基 Thr172 位点。然而,研究团队发现,在低刚度ECM条件下,细胞的 ADP/ATP 比率未增加,且缺乏内源性LKB1表达的A549和HeLa细胞中AMPK仍然被激活。此外, CaMKKb的沉默对低刚度ECM诱导的AMPK磷酸化没有影响,提示存在其他激酶参与调控(图2)。
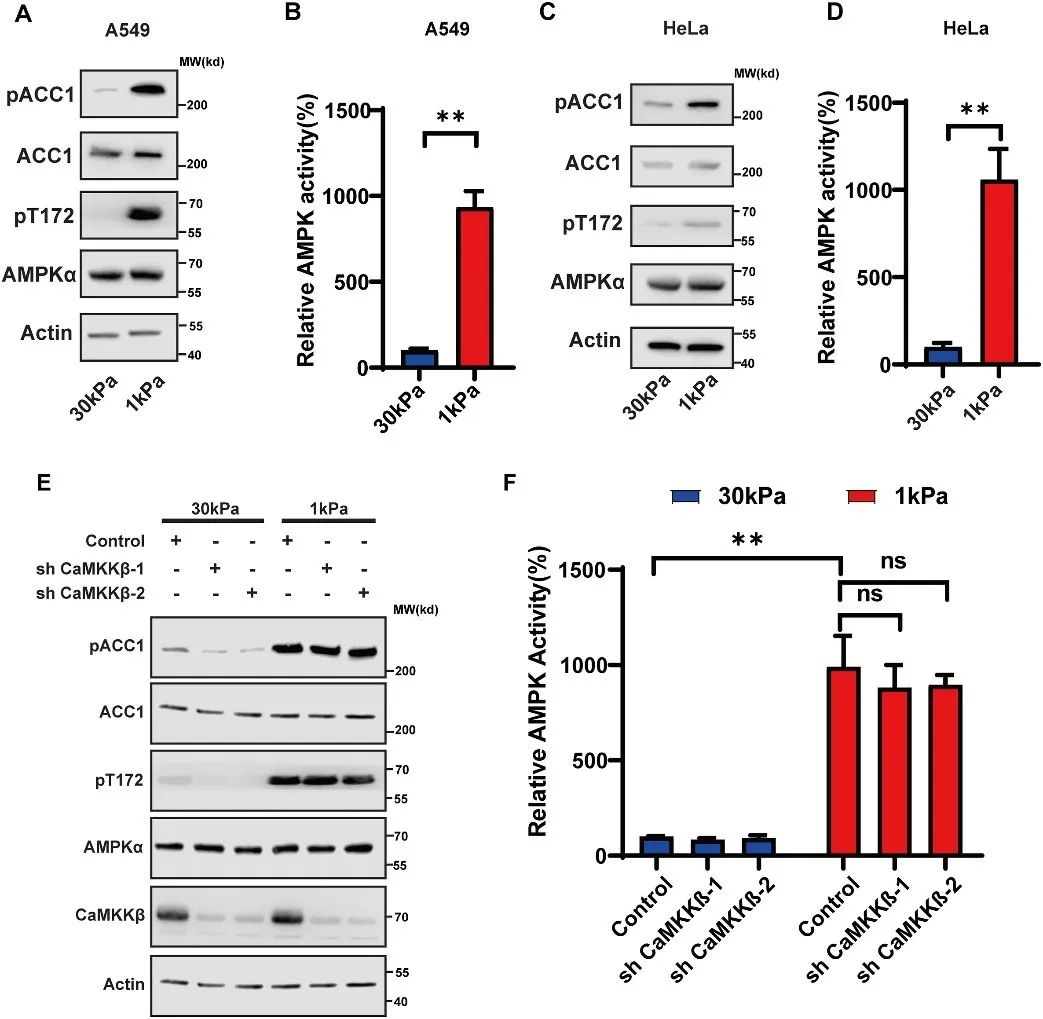
图2 低ECM刚性诱导AMPK激活,此过程不依赖于CaMKKβ和LKB1 (原文中Figure 2)。
3、Hippo激酶在AMPK激活中的作用
通过体外激酶筛选实验,研究团队发现Hippo激酶家族成员能够直接磷酸化AMPKa的Thr172位点,从而激活AMPK。在Hippo 激酶敲除细胞系中进一步证实了Hippo激酶在低ECM硬度诱导的AMPK活化中的关键作用(图3)。
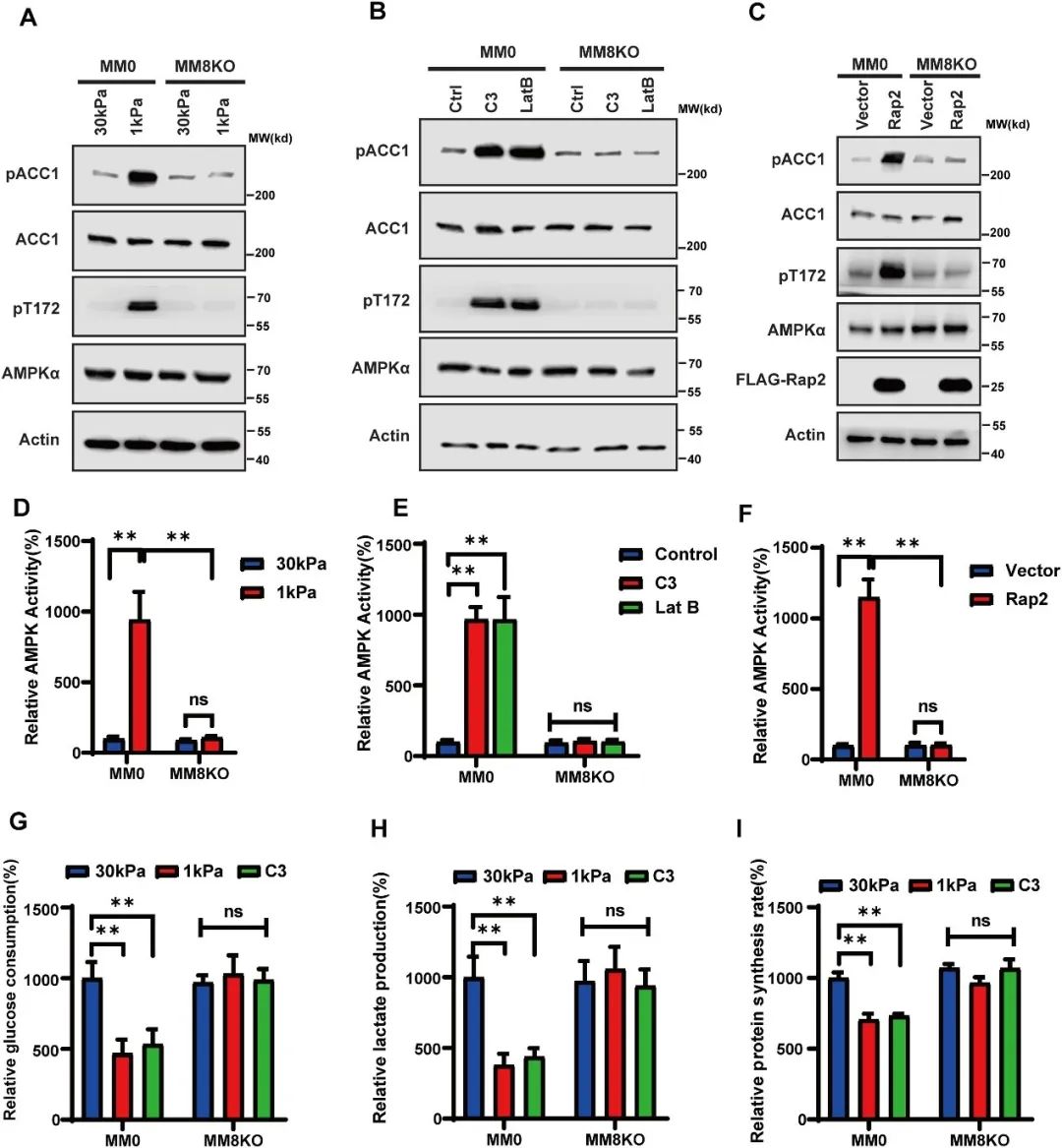
图3 Hippo激酶介导低ECM刚性诱导的AMPK激活和细胞代谢转换(原文中Figure 4)。
4、pAMPK与a-SMA表达水平与胰腺癌患者生存的关系
对90位PDAC患者的临床样本分析显示,pAMPK的表达水平与ECM的硬度标志物a-SMA的表达水平呈负相关,并与患者的总体生存率相关。
5、同时靶向ECM硬度-Hippo激酶-AMPK和低葡萄糖-LKB1-AMPK信号通路的治疗效果
研究团队发现,ROCK 激酶抑制剂 Y-27632 和线粒体抑制剂二甲双胍的联合治疗可以显著抑制 PDAC细胞生长和异种移植肿瘤的生长,并激活 AMPK,表明同时靶向ECM刚度-Hippo 激酶-AMPK 和低葡萄糖-LKB1-AMPK 信号通路可以抑制 PDAC 生长(图4)。
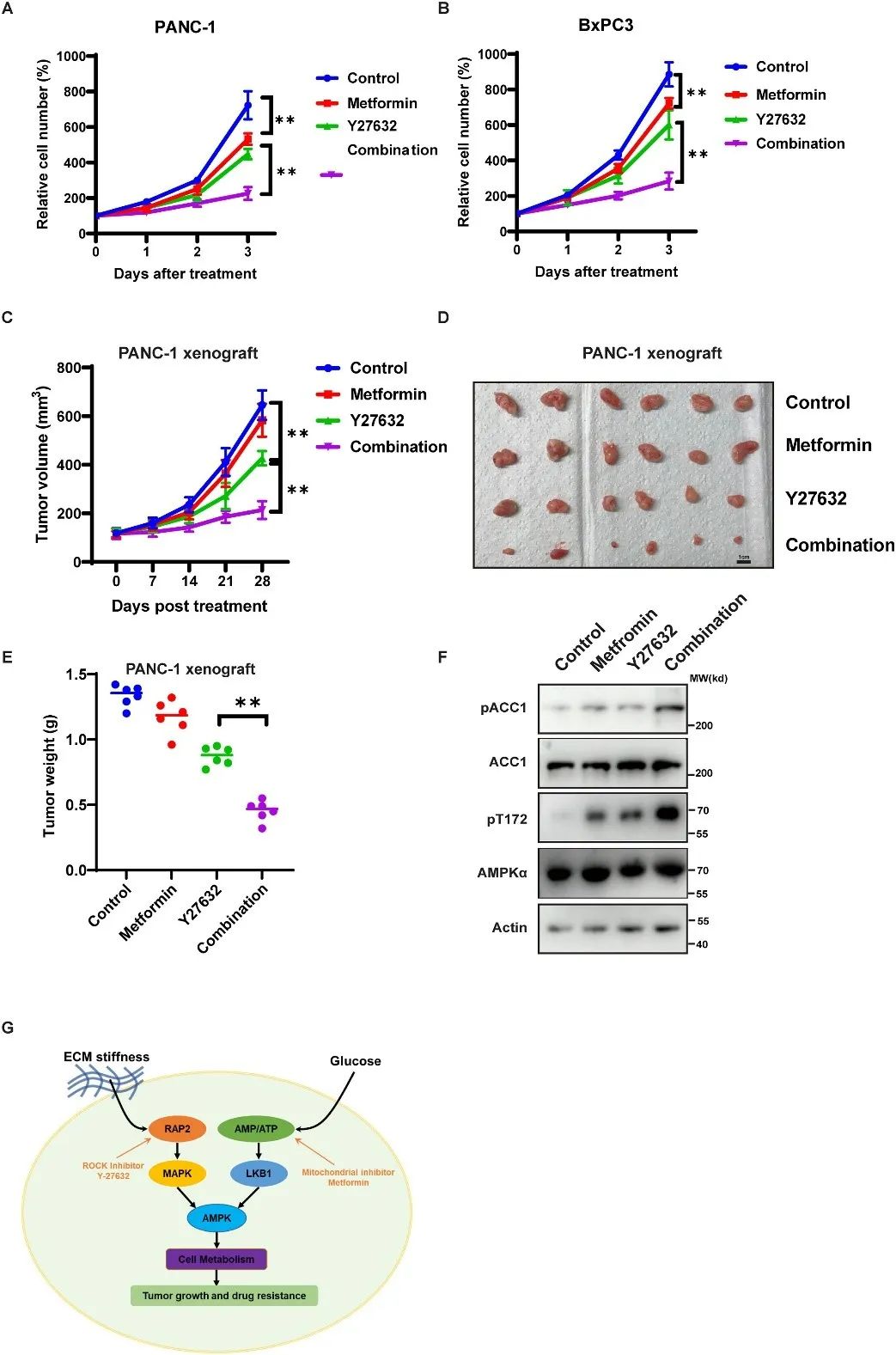
图4 联合使用二甲双胍和ROCK抑制剂Y27632抑制胰腺导管腺癌的生长(原文中Figure 6)。
6、总结
该研究不仅揭示了ECM硬度通过Hippo激酶信号通路调控AMPK活性的新机制,而且为PDAC的临床治疗提供了新的策略。通过同时靶向ECM硬度-Hippo激酶-AMPK和低葡萄糖-LKB1-AMPK信号通路,有望有效地抑制PDAC的生长,为胰腺癌患者的治疗带来新的希望。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304223003057
引用这篇文章:
Xu X, Fang Y, Nowsheen S, Li YX, Lou Z, Deng M. Regulation of AMPK activation by extracellular matrix stiffness in pancreatic cancer. Genes Dis. 2024;11(3):101035.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺癌# #AMPK激活#
63