Cell子刊:靶向p53突变新机制!中国科学技术大学魏海明团队揭示了p53调节肿瘤免疫微环境的潜在机制!
2024-09-26 iNature iNature 发表于上海
该研究表明白细胞介素-34介导的肿瘤相关巨噬细胞重编程是p53失活驱动的肿瘤免疫逃逸所必需的。
作为癌症中最常见的基因改变,超过一半的人类癌症都有p53突变,导致转录失活。然而,p53如何调节免疫景观以创造免疫逃逸的利基仍然是难以捉摸的。
2024年9月24日,中国科学技术大学魏海明团队在Immunity在线发表题为“Interleukin-34-orchestrated tumor-associated macrophage reprogramming is required for tumor immune escape driven by p53 inactivation”的研究论文,该研究表明白细胞介素-34介导的肿瘤相关巨噬细胞重编程是p53失活驱动的肿瘤免疫逃逸所必需的。
该研究发现癌症干细胞(CSCs)在p53失活的肝癌中建立了一个白介素-34 (IL-34)介导的生态位,以促进肿瘤发生。在机制上,Il34是一个被p53转录抑制的基因,p53缺失导致CSCs分泌IL-34。IL-34诱导CD36介导的脂肪酸氧化代谢升高,驱动泡沫样肿瘤相关巨噬细胞(TAMs)的M2样极化。这些IL-34介导的TAMs抑制CD8+ T细胞介导的抗肿瘤免疫,促进免疫逃逸。阻断IL-34-CD36轴引发抗肿瘤免疫,并与抗PD-1免疫治疗协同,导致完全应答。该研究揭示了p53调节肿瘤免疫微环境的潜在机制,并为p53失活的癌症免疫治疗提供了潜在的靶点。

免疫检查点抑制剂(ICIs)已经彻底改变了癌症治疗,并改善了临床生存结果。然而,只有少数患者获得长期、持久的反应。ICIs的疗效是由肿瘤免疫微环境(TIME)决定的。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)是TIME细胞中数量最多的免疫群体,具有很强的免疫抑制能力TAMs支持癌细胞生长和转移,介导对TIME适应性免疫细胞的免疫抑制作用。TAMs可通过多种机制抑制T细胞的抗肿瘤活性,包括免疫检查点分子PD-L1的表达、白细胞介素-10 (IL-10)和转化生长因子-β (TGF-β)等抑制性细胞因子的分泌以及L-精氨酸等代谢物的消耗。
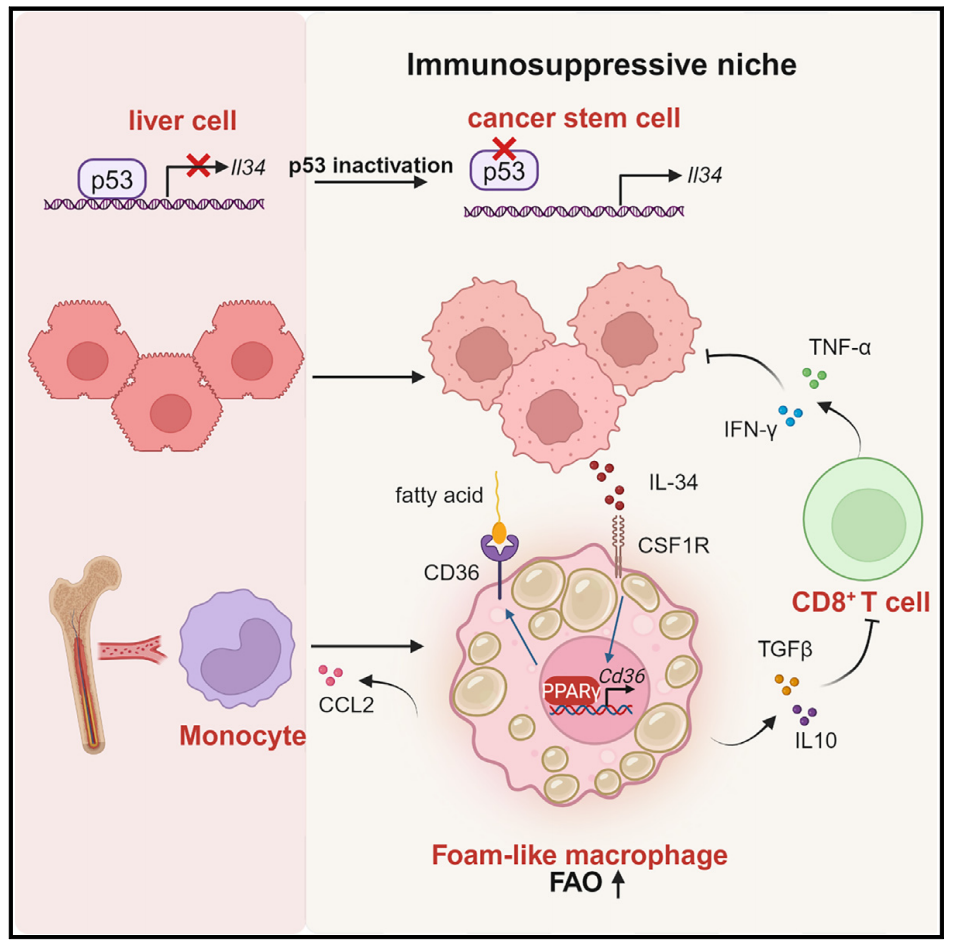
机理模式图(图源自Immunity)
TP53(编码p53蛋白)是人类癌症中最常见的突变基因。大多数TP53突变发生在中心DNA结合域,导致转录因子功能失活,p53功能的丧失被认为是许多类型肿瘤的驱动事件。作为一种转录因子,p53是一种序列特异性的DNA结合蛋白,可直接激活大量基因的转录,包括CDKN1A和MDM2也可直接抑制许多基因的表达,如CPS1和NANOG。p53因其在诱导应激细胞的细胞周期阻滞和细胞凋亡中的作用而被称为“基因组守护者”。在小鼠模型中,p53的再激活被证明是一种有效的癌症治疗方法,可以导致许多不同类型的肿瘤消退。值得注意的是,p53的再激活导致肿瘤消退需要免疫系统的参与。然而,目前关于p53调控TIME的知识是有限和碎片化的。p53如何调节免疫环境以创造免疫逃逸的生态位仍有待发现。
该研究发现p53直接调控IL-34的表达。在p53失活的CSCs中,异常高的IL-34分泌诱导CD36+泡沫样前肿瘤巨噬细胞群体建立免疫抑制生态位,从而促进肿瘤免疫逃逸。因此,IL-34塑造时间是p53失活肿瘤的共同特征,阻断IL-34信号传导可能作为针对p53泛突变的治疗策略。该研究揭示了p53失活和IL-34信号激活之间的分子机制,并表明阻断IL-34信号是一种潜在的免疫治疗p53突变肿瘤患者的方法。
参考消息:
https://www.cell.com/immunity/fulltext/S1074-7613(24)00415-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#p53# #肿瘤免疫微环境#
35