【综述】放射治疗后颈动脉狭窄的分子机制研究进展
2024-10-20 中国脑血管病杂志 中国脑血管病杂志 发表于上海
笔者拟重点总结和讨论放射治疗后颈动脉狭窄发病机制研究的最新进展,以期为该领域的进一步研究和临床实践提供有益启示。
摘要:近年来,放射治疗在头颈部肿瘤治疗中的广泛应用,显著提高了患者的生存期。然而,放射治疗引发的颈动脉狭窄问题日益受到关注。放射治疗后颈动脉狭窄具有多发、长节段及病变不稳定等特点,传统治疗手段难以应对。作者系统性总结了放射治疗引发颈动脉狭窄的病理特征及机制,探讨了内皮细胞、平滑肌细胞和滋养血管损伤在其中的作用,并对其未来研究方向及防治策略进行了展望。
缺血性卒中是全球主要的致死和致残原因之一,其发病率逐年上升,给社会和医疗系统带来了沉重负担。动脉粥样硬化引起的颈动脉狭窄是缺血性卒中的主要原因之一,约占缺血性卒中的15%~20%。流行病学数据显示,在全球范围内,30~79岁男性颈动脉狭窄的患病率约为1.8%,女性为1.2%。随着放射治疗技术的不断进步和恶性肿瘤综合治疗模式的优化,放射治疗已成为大多数头颈部恶性肿瘤的标准治疗手段,头颈部肿瘤患者的生存期因此得以延长。然而,放射治疗可能对颈部血管产生不良影响,引发放射性血管疾病。研究表明,射线照射可直接损伤颈动脉,诱发或加速动脉粥样硬化进展,最终导致颈动脉狭窄。尽管放射治疗后颈动脉狭窄的临床特点和危害性已得到广泛认识,但其发病机制尚未完全阐明。深入探究放射损伤诱导颈动脉狭窄的分子机制,对于指导有效的预防和治疗策略至关重要。因此,笔者拟重点总结和讨论放射治疗后颈动脉狭窄发病机制研究的最新进展,以期为该领域的进一步研究和临床实践提供有益启示。
1 放射治疗所致颈动脉狭窄的高危人群筛查与治疗分析
2023年,欧洲血管外科学会发布了最新的指南,建议对具有高风险因素如吸烟史、高血压病、高血脂症、肥胖和糖尿病等的特定高危人群进行颈动脉彩色多普勒筛查(证据级别:ⅡB);然而,该指南并未将放射治疗列为需要进行颈动脉狭窄筛查的“高危因素”。
目前,放射治疗头颈部肿瘤是一种被广泛应用的治疗技术。头颈部肿瘤是全球第7大常见恶性肿瘤,每年新发患者超过66万例,死亡患者达32.5万例。在中国,头颈部肿瘤的发病率位居所有恶性肿瘤的第9位,每10万人中有10.1人罹患该疾病,其中,男性发病率位列第6位,病死率位列第7位。头颈部肿瘤包括鼻咽癌、喉癌和口腔癌等多个癌种,其中鼻咽癌在我国尤为常见;流行病学数据显示,我国鼻咽癌发病率和病死率分别为38.29%和40.14%,明显高于全球平均水平(发病率为12%,病死率为7%)。
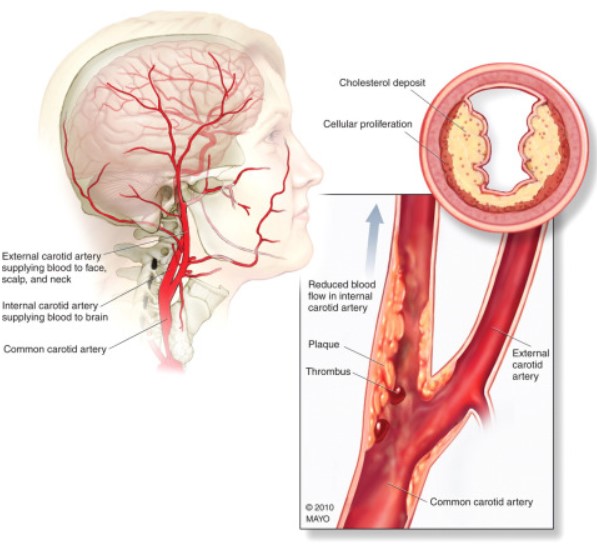
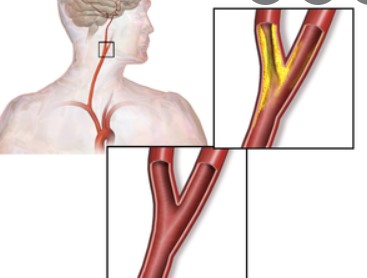
研究表明,放射治疗显著增加了头颈部肿瘤患者颈动脉狭窄的发生风险。一项系统综述和荟萃分析显示,与未接受放射治疗的颈部恶性肿瘤患者(374例)相比,接受放射治疗后颈部恶性肿瘤患者(534例)颈动脉重度狭窄(狭窄率>70%)和轻中度狭窄(狭窄率<70%)的发生率均更高(重度狭窄:12.6%比1.0%,RR=7.51, 95% CI:2.78~20.32, P<0.01;轻中度狭窄:19.6%比7.0%,RR=2.74,95% CI:1.75 ~ 4.30, P<0.01)。Chang等的研究进一步证实,与未接受放射治疗的头颈癌患者(98例)相比,接受放射治疗的头颈癌患者(192例)在各程度颈动脉狭窄的发生率均更高(颈动脉狭窄率50%~70%:19.8%比0%,P<0.01;颈动脉狭窄率>70%:11%比0%,P=0.002)。此外,放射治疗还可加速颈动脉狭窄进展,并导致双侧颈动脉累及。与单纯动脉粥样硬化性狭窄相比,放射治疗后颈动脉狭窄具有独特的病理特征。除了典型的动脉粥样硬化表现,如脂质沉积、炎症反应和血栓形成外,放射治疗后颈动脉狭窄还伴有明显的内膜增生、中膜坏死和外膜纤维化。此外,放射治疗后颈动脉狭窄斑块常呈现多发、长节段、不稳定和进展迅速等复杂病变特点,增加了治疗难度。
2 射线对血管内皮细胞损伤的机制
颈动脉血管壁由内膜层、中膜层和外膜层3个同心层构成。内膜层由内皮细胞和内膜下结缔组织层组成,在调节血管渗透性、抑制炎症反应、维持血管张力和促进血管生长等方面发挥重要功能;中膜层由平滑肌细胞和细胞外基质组成,平滑肌细胞收缩调节血流和血压,并被内外弹力膜包裹;外膜层是血管壁最外层,含有毛细血管网,为血管组织提供营养和氧气。
射线照射可通过直接损伤和加速动脉粥样硬化进展损害颈动脉血管壁,其中内皮细胞是最易受累的结构。血管内膜层由覆盖动脉、静脉和毛细血管的单层细胞组成。血管内膜层在许多生理过程中发挥着关键作用,包括通过调节血管收缩剂、前列腺素、内皮源性超极化因子和血管舒张剂的产生来控制血管张力。射线暴露后,内皮细胞发生广泛的分子改变,这些改变相互协同促进放射性损伤的发展。新近研究表明,射线照射可破坏细胞间连接,导致内皮屏障功能受损,血管通透性增加。内膜层完整性依赖于内皮细胞与基底膜和相邻细胞之间的紧密连接,其中黏附连接蛋白如血管内皮钙黏蛋白(vascula rendothelial cadherin, VE-cadherin)发挥关键作用。VE-cadherin位于内皮细胞之间的连接处,提供了内皮细胞间的稳定连接,确保内膜层的机械支撑。Kabacik和Raj研究显示,射线照射可激活内皮细胞中金属内肽酶10,诱导VE-cadherin降解和重定位,导致血管通透性增加,促进动脉粥样硬化斑块形成,增加心血管疾病发生风险。此外,内皮特异性受体Robo4参与调控内皮细胞迁移、增殖、血管生成和血管完整性。Adzraku和Wang研究表明,射线照射可上调内皮细胞Robo4表达,导致细胞间连接分子破坏,进一步降解内膜层屏障功能。敲除Robo4可加重射线诱导的VE-cadherin等关键连接蛋白降解,而过表达Robo4则可使这些蛋白稳定分布,增强微血管内皮细胞间连接完整性,降低通透性。
血管内皮细胞氧化还原状态的失衡是射线损伤的另一重要机制。在生理条件下,内皮细胞氧化还原平衡由抗氧化酶系统精细调控;射线照射可破坏氧化和抗氧化过程的平衡,诱导氧化应激,抑制一氧化氮介导的内皮依赖性血管舒张,导致血管收缩。一氧化氮由内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS)持续产生。研究显示,未经放射治疗的人组织样本免疫组织染色可见eNOS阳性染色,经放射治疗的人组织标本中免疫组织染色未检测到eNOS表达,且与未经放射治疗的人组织样本比较,经放射治疗的人组织标本的内皮依赖性舒张功能显著降低[最大反应:(33±6)%比(100±4)%,P<0.01]。此外,射线照射后内皮细胞活性氧和氧化应激产物明显增加(P<0.05),这是诱导脂质过氧化的主要因素之一,可激活细胞死亡通路,加重内膜层损伤。射线诱导的eNOS解耦也参与内皮细胞活性氧生成。eNOS是一种Ca2+依赖性二聚体黄素蛋白,催化L-精氨酸生成NO,需要还原型辅酶Ⅱ和O2参与,当四氢生物蝶呤等辅因子缺乏时,eNOS可发生解耦,将电子转移至O2而非L-精氨酸,导致O2-生成增加和NO合成减少。Berbee等研究显示,与对照组(未处理小鼠)相比,受8.5Gy(每日12h)全身照射后第3天,实验组小鼠的主动脉内皮四氢生物蝶呤水平显著下降(P=0.03)。
射线还可激活多种信号通路,介导内皮细胞损伤和氧化应激反应。为应对射线诱导的氧化应激和DNA损伤,内皮细胞启动各种生化过程抵御射线毒性。然而,当损伤超出细胞稳态调节能力时,内皮细胞可能发生衰老或凋亡。研究表明,射线可诱导内皮细胞衰老和凋亡。内皮细胞衰老可由多种因素引起,如端粒缩短(复制性衰老)、癌基因表达增加或DNA损伤等。与复制性或癌基因诱导的衰老不同,射线诱导的衰老主要与DNA损伤有关,而非表观遗传改变。射线引起内皮细胞严重DNA损伤和氧化应激,导致衰老表型出现,表现为形态改变、细胞周期抑制因子p21/waf1表达增加、sirtuin1表达降低以及衰老相关β-半乳糖苷酶活性增加等。Dong等研究显示,射线诱导的DNA损伤通过激活核因子-κB必需调节因子/核因子-κB信号通路引发内皮细胞衰老,核因子-κB必需调节因子小分子抑制剂可阻断该过程。衰老内皮细胞过度积累,超出机体清除能力,可引起炎症因子、趋化因子和基质金属蛋白酶分泌增加,形成“衰老相关分泌表型”,进而促进动脉粥样硬化等血管疾病发生。除诱导衰老外,射线还可引发内皮细胞凋亡。内皮细胞凋亡与急性放射综合征相关,但其在放射性慢性损伤中的作用尚不明确。Li等的研究显示,微波辐射(频率在300 MHz~300 GHz的电磁波辐射)通过激活微血管内皮细胞内质网应激凋亡通路导致血管损伤。此外,研究表明,射线还可通过p53介导的凋亡通路和鞘磷脂代谢途径诱导内皮细胞凋亡,促进动脉粥样硬化斑块形成。
3 射线对血管平滑肌细胞(vascular smooth muscle cells,VSMC)损伤的机制
射线照射不仅损伤血管内皮细胞,还可影响VSMC的正常生理功能。VSMC是高度分化的细胞,主要功能包括调节血管张力、管径、血压和血流分布等。研究表明,与对照组(接受长期西方饮食喂养小鼠的载脂蛋白E敲除小鼠)相比,实验组[接受致死剂量辐射(1200cGy)的载脂蛋白E敲除小鼠]小鼠的动脉粥样硬化斑块中的VSMC数量减少,并诱导VSMC衰老表型,加速了动脉粥样硬化进程,表现为斑块内出血(P=0.0003)和坏死核心面积(P=0.0082)增加。Zheng等研究显示,射线可通过激活核因子-κB通路,增强CCCTC结合因子与衰老标志物p16的结合,进而诱导VSMC衰老。Kim等研究显示,射线通过激活p21诱导G1和G2期细胞周期阻滞,抑制VSMC增殖和存活,p21敲除小鼠细胞增殖速度大于对照组(P<0.01),提示VSMC对射线诱导的细胞周期阻滞反应减弱,证实p21在VSMC射线损伤反应中发挥关键作用。此外,射线还可诱导VSMC表型转化,即从以收缩功能为主的收缩型表型向以分泌功能为主的合成型表型转变,这是动脉粥样硬化形成的重要环节之一。因此,射线通过诱导VSMC衰老、抑制增殖以及促进表型转化等多种机制,加速动脉粥样硬化进展,最终导致颈动脉狭窄。
4 射线对血管外膜损伤的机制
射线照射对血管壁滋养血管的损伤不容忽视。滋养血管位于血管壁外膜层,负责供应营养和氧气,维持血管壁的正常代谢。射线照射可引起滋养血管内皮细胞和VSMC的凋亡和坏死,导致血管壁弹性组织和平滑肌坏死,逐渐被纤维组织所替代,同时随着照射剂量和时间的累积,血管中膜层胶原含量增加,血管壁顺应性下降,刚性增加。此外,内膜增生和外膜纤维化还可能对血管壁施加额外的向心性压力,导致血管腔狭窄,血流灌注不足,进一步加重血管壁的缺血性坏死。射线诱导的滋养血管损伤和血管壁缺血是放射性血管病变的重要病理环节之一。深入研究其与内皮和VSMC损伤的相互关系,有助于评估放射性血管并发症的风险,优化防治策略。
5 展望
放射治疗后颈动脉狭窄是一种常见的临床并发症,可导致严重的后果,但其发病机制尚未完全阐明。既往研究表明,放射性血管损伤涉及多种复杂的病理生理过程,包括血管内皮细胞损伤、炎症反应、纤维化和血栓形成等。与单纯动脉粥样硬化性狭窄相比,放射性颈动脉狭窄具有独特的病理特征,表现为斑块多发、狭窄节段长、病变不稳定且进展迅速。未来的研究可以从分子水平、细胞水平和整体组织水平入手,深入阐明放射治疗后颈动脉狭窄的具体发病机制,以期为预防和治疗提供更有效的策略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#颈动脉狭窄# #放射治疗#
54