JEM:傅阳心/彭华合作开发新一代肿瘤特异性anti-PD-1-IL-15免疫治疗药物
2022-10-09 “生物世界”公众号 “生物世界”公众号
肿瘤免疫治疗作为近些年迅速发展起来的肿瘤治疗新方法,通过调动机体自身的免疫系统来对抗肿瘤,使得肿瘤治疗的局面焕然一新。特别是免疫检查点阻断治疗,造福了大量的癌症患者。
肿瘤免疫治疗作为近些年迅速发展起来的肿瘤治疗新方法,通过调动机体自身的免疫系统来对抗肿瘤,使得肿瘤治疗的局面焕然一新。特别是免疫检查点阻断治疗,造福了大量的癌症患者,其发现者们也因此于2018年获得了诺贝尔生理医学奖。尽管如此,免疫检查点阻断治疗还存在着应答率低、肿瘤复发等问题,因此仍需更多更有效的免疫治疗手段。
细胞因子作为机体免疫调控网路中的重要分子,在机体抗肿瘤反应中也具有非常重要的影响。其中,白细胞介素15(IL-15)能够有效地促进效应细胞,包括效应CD8+T细胞和NK细胞的增殖和胞毒作用,因而在抗肿瘤治疗中具有很大的潜力。但是IL-15在循环系统给药治疗过程中,常伴随着严重的毒副作用,大大限制了IL-15在临床上的应用。
因此,寻找到有效的修饰或改造方法使得IL-15能够安全有效地发挥抗肿瘤功能是解决IL-15应用困境的关键。针对这个问题,基本的改造策略是:在外周组织限制IL-15的活性以避免严重的毒性,而选择性地在肿瘤组织释放出IL-15的活性以发挥有效的抗肿瘤作用。
中科院生物物理所彭华研究组之前提出的"pro-cytokine"前药策略能够有效地降低毒性(Cell Res, 2021)。
近日,清华大学医学院傅阳心教授团队与中科院生物物理所彭华研究员团队合作,在 Journal of Experimental Medicine 期刊发表了题为:An engineered concealed IL-15-R elicits tumor-specific CD8+T cell responses through PD-1-cis delivery 的研究论文。
该研究提出了不同于"pro-cytokine"的另一种全新的改造策略,根据对IL-15及其受体相互作用的结构分析,将IL-15置于抗体Fc的羧基端,形成空间位阻,使Fc物理性地阻碍IL-15与受体的结合,有效降低IL-15的活性。在给小鼠腹腔注射时,IL-15的毒性显着降低,保证了IL-15使用的安全性。

为了确保遮盖的IL-15能够有效地激活肿瘤内的效应细胞而发挥抗肿瘤作用,研究人员加入了PD-1抗体(aPD-1),构建出aPD-1-IL-15融合蛋白。在系统给药时,aPD-1抗体一方面能够靶向到肿瘤组织,将IL-15更多地带到肿瘤部位;另一方面,aPD-1抗体能够将遮盖的IL-15锚定在瘤内高表达PD-1分子的效应细胞,特别是PD-1+CD8+T细胞。研究人员发现,当aPD-1抗体结合到PD-1+细胞时,遮盖着的IL-15的活性完全恢复。一般情况下,IL-15的毒性和抗肿瘤活性都依赖IL-15本身的活性,因而常常是伴生的,一荣俱荣,一损俱损。研究人员提出的新的改造策略,将IL-15的毒性和抗肿瘤活性有效地在空间上分割开,以物理遮盖形成空间位阻的方法降低IL-15的活性进而降低在外周组织的毒性,以PD-1辅助靶向和辅助结合的方式特异性地恢复IL-15在瘤内PD-1+CD8+T细胞上的活性进而有效地发挥抗肿瘤功能。
受限于有限的融合蛋白结构信息,遮盖的IL-15重新获得活性的机制尚不清楚。研究人员也提出两种假设,一种是在aPD-1抗体结合到细胞上PD-1分子时,Fc与IL-15之间的结构发生构象改变,使原先遮盖的IL-15不再被遮盖,IL-15的活性完全释放。另一种是aPD-1抗体将IL-15锚定在细胞表面,提升融合蛋白的局部浓度,增强IL-15与受体的结合概率,活性因而得到大幅恢复。改造的aPD-1-IL-15融合蛋白在多种小鼠肿瘤模型中展现出显着抑制肿瘤生长的能力,并且完全不会产生毒副作用。机制上,肿瘤内预先存在的CD8+T细胞是融合蛋白发挥抗肿瘤功能的主要效应细胞,融合蛋白能够显着促进CD8+T细胞的增殖、增强CD8+T细胞的效应能力,不仅能够抑制原位肿瘤的生长,还能抑制肿瘤的远端转移,并提供长久的机体免疫记忆保护。
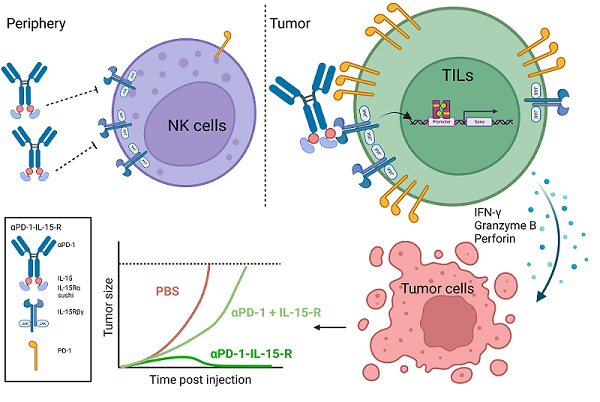
Anti-PD-1-IL-15-R通过PD-1顺式递送IL-15-R,特异性地结合并激活肿瘤内PD-1+CD8+T细胞发挥抗肿瘤功能的模式图
中国科学院生物物理研究所的博士生申姣和邹壮志是本论文的共同第一作者;清华大学医学院的傅阳心教授和中国科学院生物物理研究所的彭华研究员是本论文的共同通讯作者。该研究得到国家科技重大专项的资助。生物物理所实验动物平台为该研究提供了重要的技术支持。
原始出处:
Jiao Shen, et al. An engineered concealed IL-15-R elicits tumor-specific CD8+T cell responses through PD-1-cis delivery. J Exp Med (2022) 219 (12): e20220745.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言