Science:中性粒细胞其实也需要精准分型
2024-09-06 网络 网络 发表于威斯康星
中性粒细胞作为人体中最常见的免疫细胞类型之一,通常被认为是对抗感染和组织损伤的“前线防御者”。然而伴随着对肿瘤微环境认识的深入,中性粒细胞的角色逐渐从单一的炎症细胞转变为肿瘤发
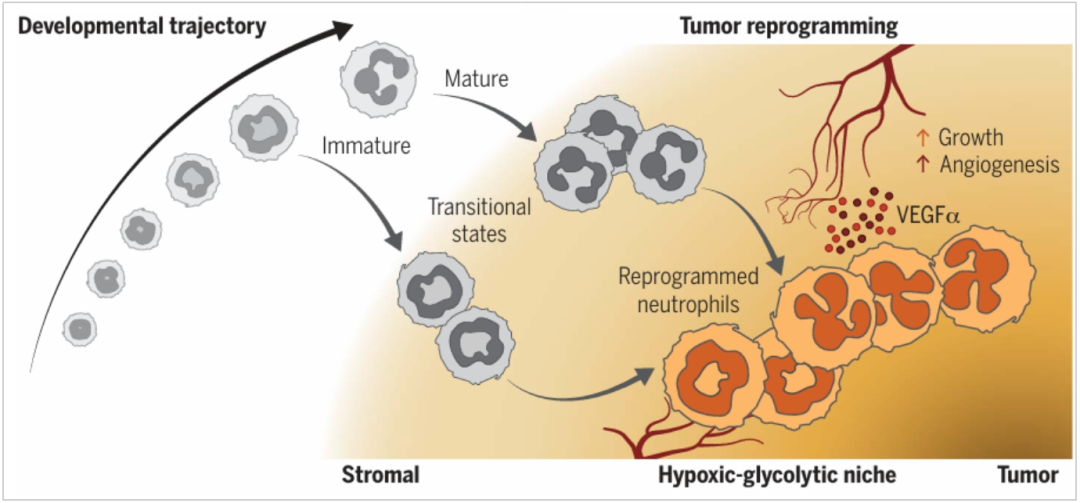
中性粒细胞作为人体中最常见的免疫细胞类型之一,通常被认为是对抗感染和组织损伤的“前线防御者”。然而伴随着对肿瘤微环境认识的深入,中性粒细胞的角色逐渐从单一的炎症细胞转变为肿瘤发展过程中的关键调控细胞。近期来自上海市免疫治疗创新研究院的黄来源(Lai Guan Ng)团队在《Science》发表了题为“Deterministic reprogramming of neutrophils within tumors”的研究。本研究采用了单细胞测序、空间转录组、MICS循环染色成像等技术深入探讨了中性粒细胞在肿瘤微环境中的重编程,发现了3种中性粒细胞亚群T1-T3,以及T3亚群促进肿瘤生长的生物过程。

肿瘤相关中性粒细胞的亚型分析
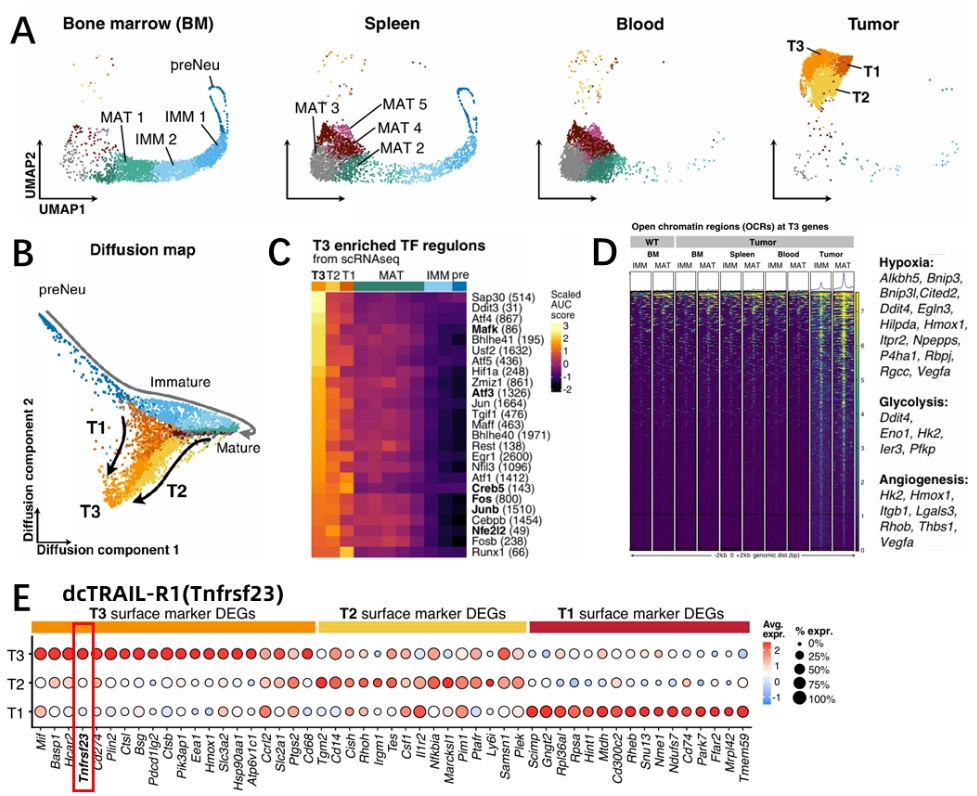
为剖析肿瘤微环境的中性粒细胞异质性,研究人员在此建立了胰腺导管腺癌(PDAC)的小鼠模型,并针对骨髓(BM)、脾脏、血液和肿瘤中的中性粒细胞进行单细胞测序分析。UMAP结果显示,多种样本的中性粒细胞根据其发育状态出现聚集。其中来自肿瘤样本的中性粒细胞出现完全独特的转录谱,并形成了3个不同的细胞簇(图1A)。研究人员通过扩散图分析研究中性粒细胞的分化轨迹,其中肿瘤中性粒细胞偏离了正常的中性粒细胞发育轨迹。同时T1和T2中性粒细胞出现向T3群体分化的情况,这预示着T3亚群可能是终末分化期(图1B)。研究人员同时分析了中性粒细胞群的开放染色质区域(OCR),发现在肿瘤中性粒细胞中缺氧、糖酵解和血管生成相关基因出现上调(图1C-D)。最后研究人员确定了每种肿瘤相关中性粒细胞群体的特征基因,其中T3亚群主要表达dcTRAIL-R1(图1E)。
T3中性粒细胞独特空间位置促进肿瘤生长
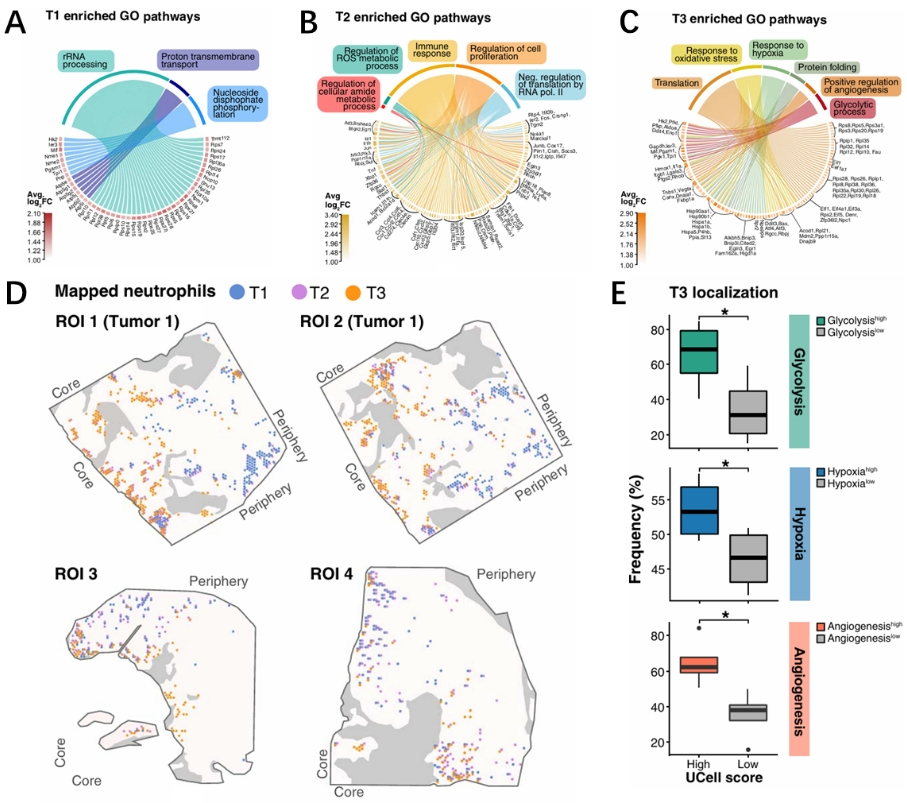
肿瘤免疫微环境中细胞的定位信息至关重要,为了更好的解析肿瘤中性粒细胞的功能,研究人员首先对T1、T2和T3的基因进行了GO分析(基因本体论),结果显示T1中性粒细胞富集了转录和翻译相关的通路,这与其未成熟表型一致。而T3中性粒细胞中富集了细胞应激和存活、缺氧、糖酵解、血管生成等反应(图2A-C)。这表明即便部分肿瘤环境出现了缺氧现象,但是T3中性粒细胞可以适应肿瘤环境,同时T3富含的血管生成基因也为研究人员提供了新的思路。接下来研究人员通过DAPI和泛细胞角蛋白(Pan-CK)对小鼠肿瘤组织进行染色,从而确定肿瘤细胞区域(Pan-CKhighDAPIhigh)、纤维化区域(Pan-CKhighDAPIlow)和边缘基质区域(Pan-CKlowDAPIhigh)。通过空间转录组中每个spot表达基因的强度预测其可能归属的细胞类型,结果发现了T3中性粒细胞主要分布在肿瘤核心区域,而T1则分布在边缘区域,同时T3所在区域具有较高的糖酵解、缺氧、血管生成的基因表达信号(图2D-E)。
重编程中性粒细胞位于缺氧和糖酵解生态位
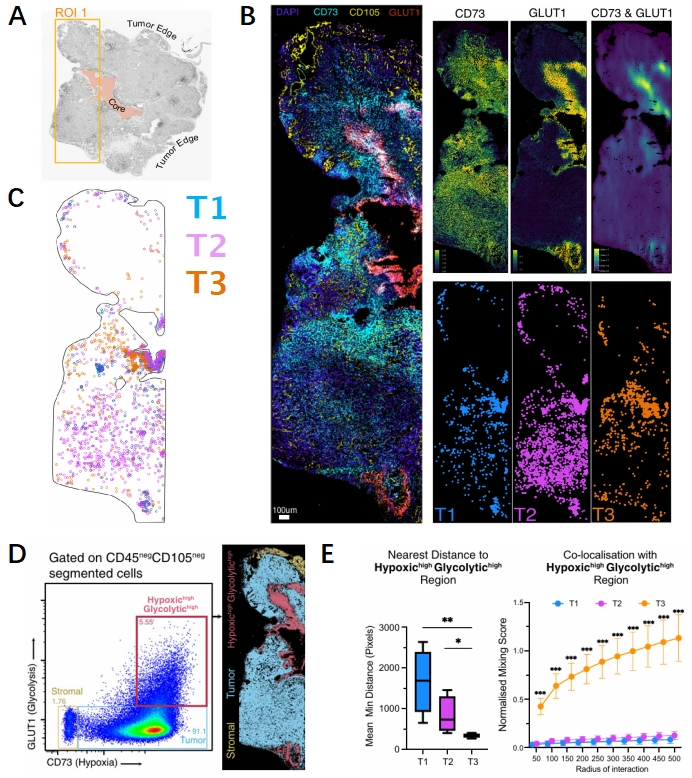
空间转录组的结果预示着T3中性粒细胞可能位于肿瘤缺氧和糖酵解富集的位置,然而考虑到空间转录组在分辨率和细胞定义上的局限性,研究人员通过可以实现空间单细胞分割的MICS循环染色成像技术来验证这些结果。研究人员使用CD105来标记肿瘤内血管、CD73来定义缺氧生态位、GLUT1来定义糖酵解生态位。并通过Ly6G、CD101和dcTRAIL-R1来鉴定T1、T2和T3中性粒细胞。成像结果显示T1和T2中性粒细胞以两种不同的模式分布在肿瘤实质中,而T3中性粒细胞更多的富集在GLUT1highCD73high区域(图3A-C)。接下来研究人员通过CD73和GLUT1的表达情况将肿瘤组织划分为基质、肿瘤实质和缺氧肿瘤三种生态位。通过空间像素定量分析了三种中性粒细胞与缺氧和糖酵解程度高区域的空间距离,研究人员证实了T3中性粒细胞与缺氧糖酵解的肿瘤生态位的距离最近(图3D-E)。
体内外确定肿瘤微环境驱动中性粒细胞重编程
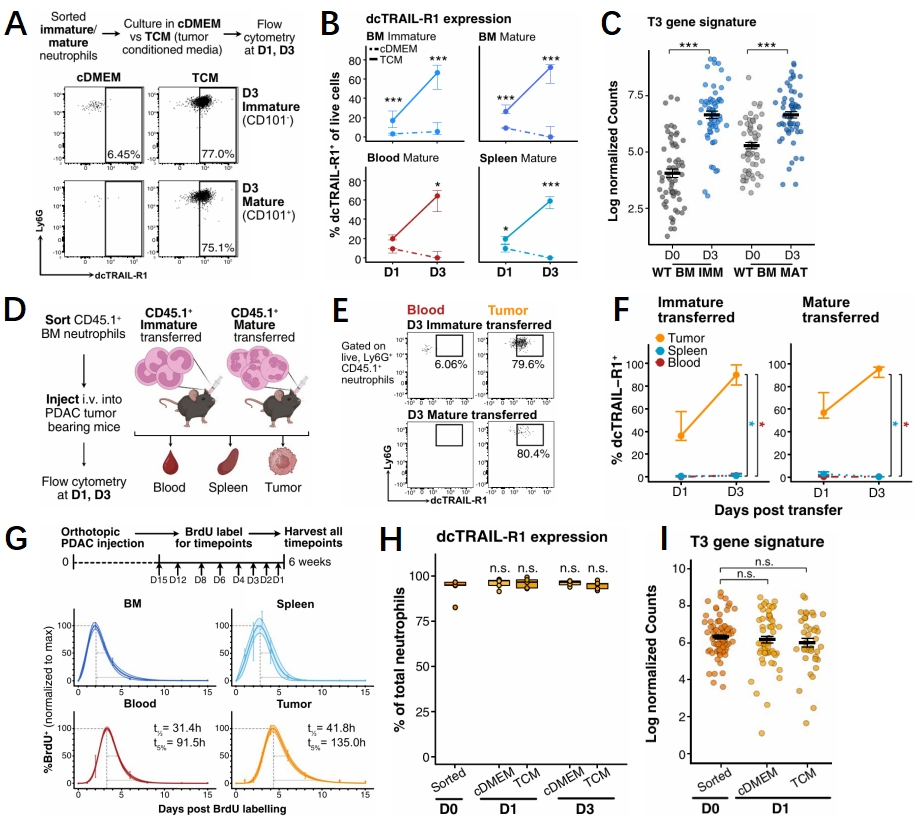
中性粒细胞的重编程在肿瘤微环境中具有重要的作用,但其具体机制仍然不清楚。研究人员构建了肿瘤条件培养基(TCM),通过分离小鼠中未成熟和成熟粒细胞进行体外培养。结果显示肿瘤条件培养基中成熟和未成熟中性粒细胞均出现了T3中性粒细胞的表型获得(图4A-C)。同时研究人员进一步在荷瘤小鼠体内检测了中性粒细胞的变化情况,结果显示体内dcTRAIL-R1的上调与体外相同,同时这种中性粒细胞的重编程依赖于肿瘤微环境(图4D-F)。在此研究人员还确定了T3中性粒细胞的状态是否可以维持,结果显示T3中性粒细胞不仅具有较长的半衰期,同时这种分化状态是稳定维持的,而非短暂获得(图4G-I)。
T3中性粒细胞促进血管生成从而促进肿瘤生长
基于前期研究中性粒细胞在肿瘤中可能促进血管生成,但是具体机制不清楚,研究人员发现了血管生成因子VEGFα主要存在于T3中性粒细胞亚群中(图5A-B)。结合先前研究,确定了T3中性粒细胞可能促进肿瘤血管生成。通过同注射PDAC细胞和中性粒细胞,研究人员发现在T3中性粒细胞共注射的分组中,肿瘤生长迅速,并且具有最大的质量(图5C-E)。同时研究人员使用了CD31染色构建了可视化瘤内3D血管网络,发现T3共注射时,血管生成在肿瘤核心区域更多(图5F)。最后研究人员通过来自TCGA和PACA-AU两个数据库中独立胰腺癌队列进行了生存分析,结果显示T3中性粒细胞特征基因高表达的患者在两个数据集中的总生存期较差(图5G),这预示着T3中性粒细胞可能作为肿瘤内病理性血管生成的全新靶点。
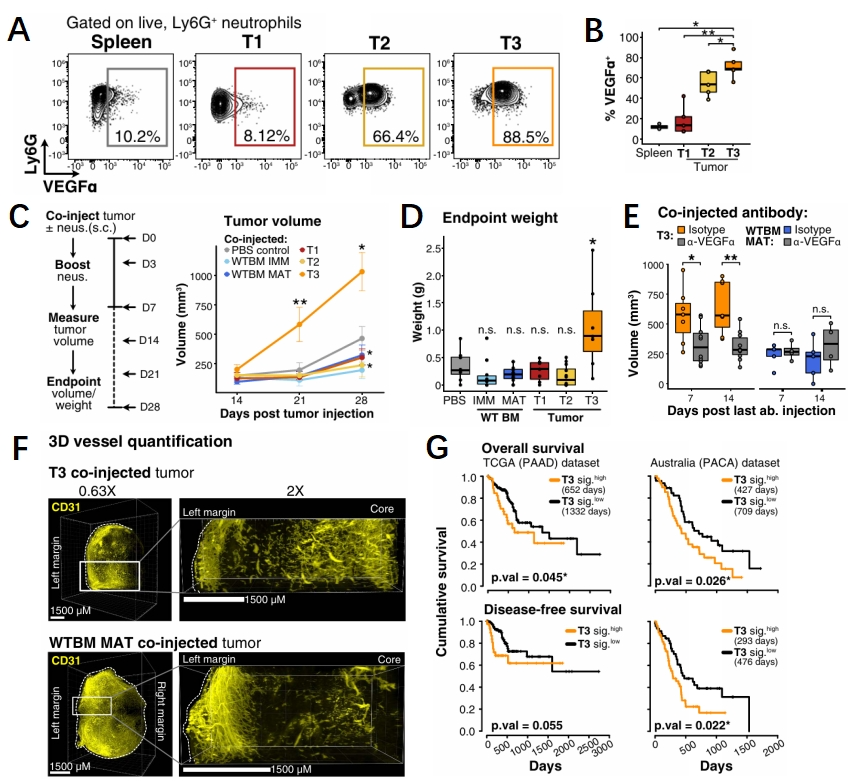
图5 T3中性粒细胞促进肿瘤生长
总结与讨论
本研究深入剖析了胰腺肿瘤微环境中性粒细胞的异质性和空间分布,描绘了肿瘤微环境促进中性粒细胞的重编程过程。并通过空间组学确定了中性粒细胞T3亚群的特殊空间位置及其促进肿瘤生长的原因。最后与临床队列结合确定了T3亚群与患者生存的高度相关性。这项研究不仅阐述了肿瘤微环境的中性粒细胞分化过程,同时结合空间位置发现了其促进血管新生的机制,为癌症免疫治疗提供新的靶点和研究思路。
原始出处:
Ng MSF, Kwok I, Tan L, Shi C, Cerezo-Wallis D, Tan Y, Leong K, Calvo GF, Yang K, Zhang Y, Jin J, Liong KH, Wu D, He R, Liu D, Teh YC, Bleriot C, Caronni N, Liu Z, Duan K, Narang V, Ballesteros I, Moalli F, Li M, Chen J, Liu Y, Liu L, Qi J, Liu Y, Jiang L, Shen B, Cheng H, Cheng T, Angeli V, Sharma A, Loh YH, Tey HL, Chong SZ, Iannacone M, Ostuni R, Hidalgo A, Ginhoux F, Ng LG.Deterministic reprogramming of neutrophils within tumors,Science . 2024 Jan 12;383(6679):eadf6493. doi: 10.1126/science.adf6493
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















学习学习。
57
#中性粒细胞#
56