西湖大学王怀民团队《Sci. Adv.》: 基于模块化多肽组装体的可吸入SPRAY纳米颗粒用于急性肺部炎症治疗
2024-09-20 BioMed科技 BioMed科技 发表于上海
西湖大学团队研发模块化多肽分子 BLKR 及可吸入纳米颗粒 SPRAY-BLKR-NPs,可靶向肺泡巨噬细胞,抗菌抗炎促组织修复,为治疗革兰氏阴性菌致肺损伤提供新思路。
急性肺损伤(ALI)是以肺泡炎症反应为特征的急性呼吸衰竭,死亡率可达38.5%。革兰氏阴性菌感染是造成急性肺损伤的主要原因之一。革兰氏阴性菌外膜的组成成分脂多糖(LPS)会快速激活肺泡巨噬细胞(AlvMs)中的TLR4信号通路,并将其极化为促炎的M1型,造成炎性细胞向肺泡腔水肿液内的浸润,并随后导致严重的上皮层和内皮层的损坏。针对革兰氏阴性菌所致肺损伤,临床上通常依赖于含有吸氧,肺通气支持,抗菌治疗和抗炎治疗的联合治疗手段。现有的抗生素治疗所能到达的肺部药物积累较低,不利于杀灭耐药细菌,且抗生素治疗促进了LPS的泄露,恶化炎症情况。现有的抗炎策略通常依赖于免疫抑制性的药物治疗,包括糖皮质激素和托珠单抗等。该类药物的使用难以推动促组织修复的免疫微环境的形成,且抑制了呼吸道的先天免疫系统对外界病原体的防御能力,易造成联合感染。
为了克服这些治疗难题,西湖大学理学院化学系王怀民研究员团队基于模块化设计的多肽自组装体,提出了一种可吸入的SPRAY纳米颗粒制剂,并通过前期多肽分子药效筛选,无菌性肺损伤和耐药革兰氏阴性菌所致肺损伤模型验证了其可有效靶向肺泡巨噬细胞,随后调控IL-17、Toll-like受体信号通路等有效抑制促炎M1型分化,并诱导抗炎M2型分化以促进组织修复。同时,SPRAY纳米颗粒可通过破坏细菌的细胞膜快速杀灭定植于下呼吸道的革兰氏阴性菌,为抵御无菌性和细菌感染所致的肺泡炎症提供了新的治疗思路。近日,该研究以题为“Inhalable SPRAY nanoparticles by modular peptide assemblies reverse alveolar inflammation in lethal Gram-negative bacteria infection”的论文在线发表在Science Advances. 本论文的第一作者为西湖大学博士研究生陈鼎灏。

[设计筛选模块化多肽分子BLKR用于高效抗菌和巨噬细胞抗炎活化]
为设计基于单分子组装的模块化多肽分子用于对巨噬细胞的快速抗炎活化(modular self-assembly peptides for rapid anti-inflammatory programming, SPRAY),研究者将疏水性的膜渗透序列(membrane-permeable motif, MPM)与正电抗炎候选多肽序列共价结合(图. 1)。MPM序列含有联苯基和两个苯丙氨酸残基,可通过增强π-π作用促进自组装,并可促进多肽分子于细菌细胞膜磷脂双分子层的作用。首先,研究者构建了一个含有16种分子的候选多肽库,并通过评价诱导M2巨噬细胞的活化能力、对肺上皮细胞和巨噬细胞的毒性、溶血性和对个革兰氏阴性菌的抗菌能力,最终通过截短人工合成抗菌肽SAAP-148的七肽序列LKRVWKR(LKR)并与MPM序列结合得到兼具抗炎抗菌能力的最优SPRAY分子,名为BLKR。BLKR可将接近28.67% CD11b+F4/80+骨髓来源巨噬细胞(BMDMs)诱导为抗炎M2型,对于多重耐药大肠杆菌(MRE)的最小抑菌浓度为16 μM,且对于多种人源及鼠源细胞未见明显毒性。后续研究表明,BLKR同时具有杀灭肺炎克雷伯氏菌(Klebsiella pneumoniae)和铜绿假单胞菌(Pseudomonas aeruginosa)能力,有望用于多种革兰氏阴性菌所致肺部感染的治疗。
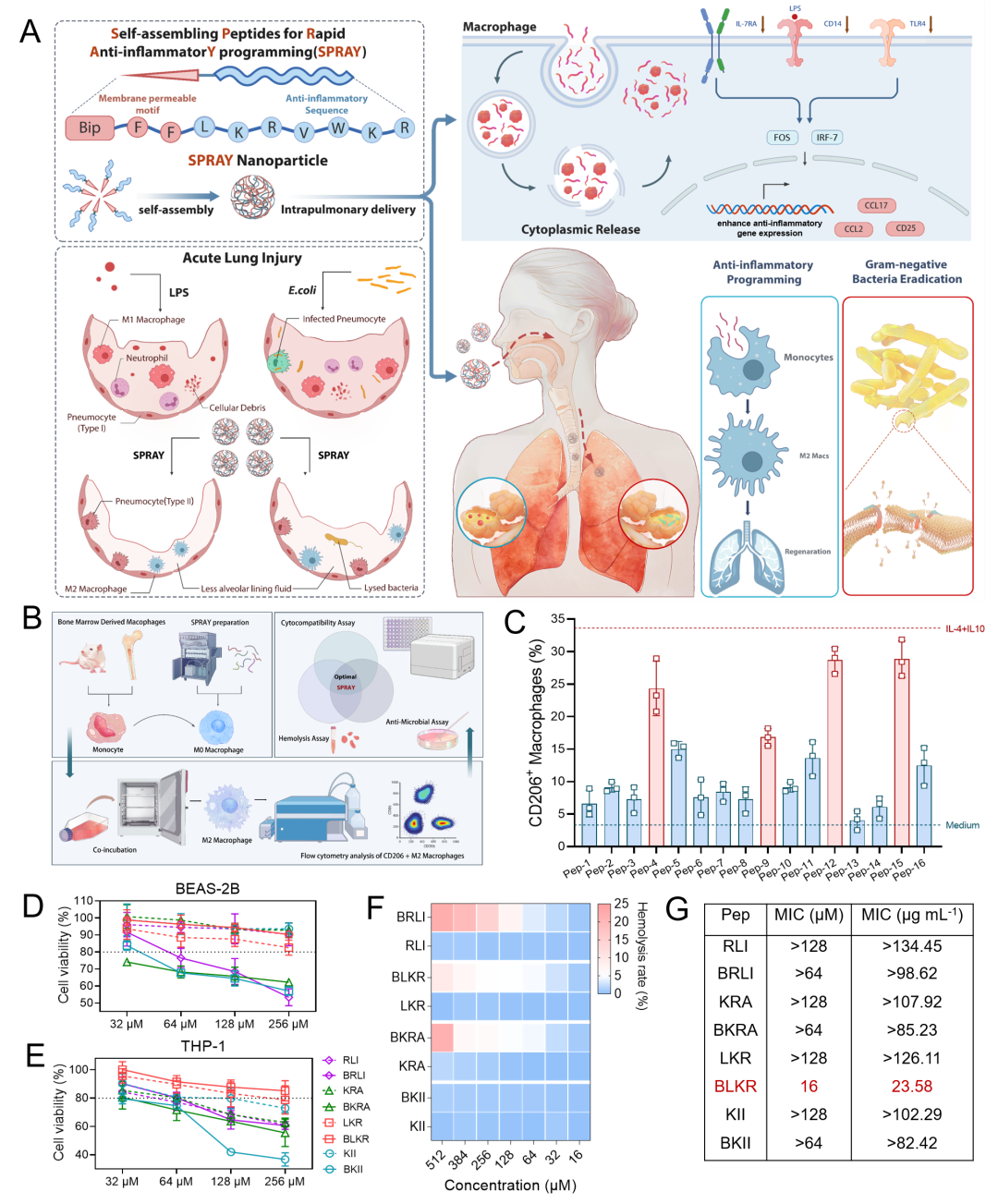
图. 1 模块化设计和筛选具有M2巨噬细胞极化和抗革兰氏阴性菌活性的生物相容SPRAY多肽分子。
[BLKR诱导巨噬细胞M2型分化的机制探索]
为进一步探索BLKR对于巨噬细胞的活化机制 (图. 2),作者观察到经BLKR刺激后,BMDMs呈现纺锤形转变,M2型分化标志物CD206高度表达于细胞膜表面,M1型分化标志物CD86的表达未见明显提升。PCR结果显示BLKR显著提升细胞内抗炎基因(Arg-1, YM-1, Fizz-1)的mRNA表达量,且提升BMDMs分泌Th2细胞因子(IL-4,IL-10)能力。随后,收集BLKR刺激24小时后的BMDMs进行转录组学分析。KEGG通路富集分析显示差异基因主要富集于IL-17,MAPK和Toll-like受体通路。基因本体论(GO)分析显示BLKR可显著调控Th1/Th2细胞因子的生物合成过程。通过对基因表达量进行归一化后发现BLKR可能通过下调IL-17和FOS基因水平致使下游CD25,CCL2和CCL17表达量增加,以促进Th2 细胞因子分泌. 同时,BLKR显著下调CD14表达量,这有助于降低TLR4对于LPS的识别,从而降低LPS将M2巨噬细胞重新计划位M1表型的概率。有趣的是,如缺少多肽N末端的疏水MPM修饰,原正电七肽序列LKR未显现出明显的巨噬细胞调控能力。
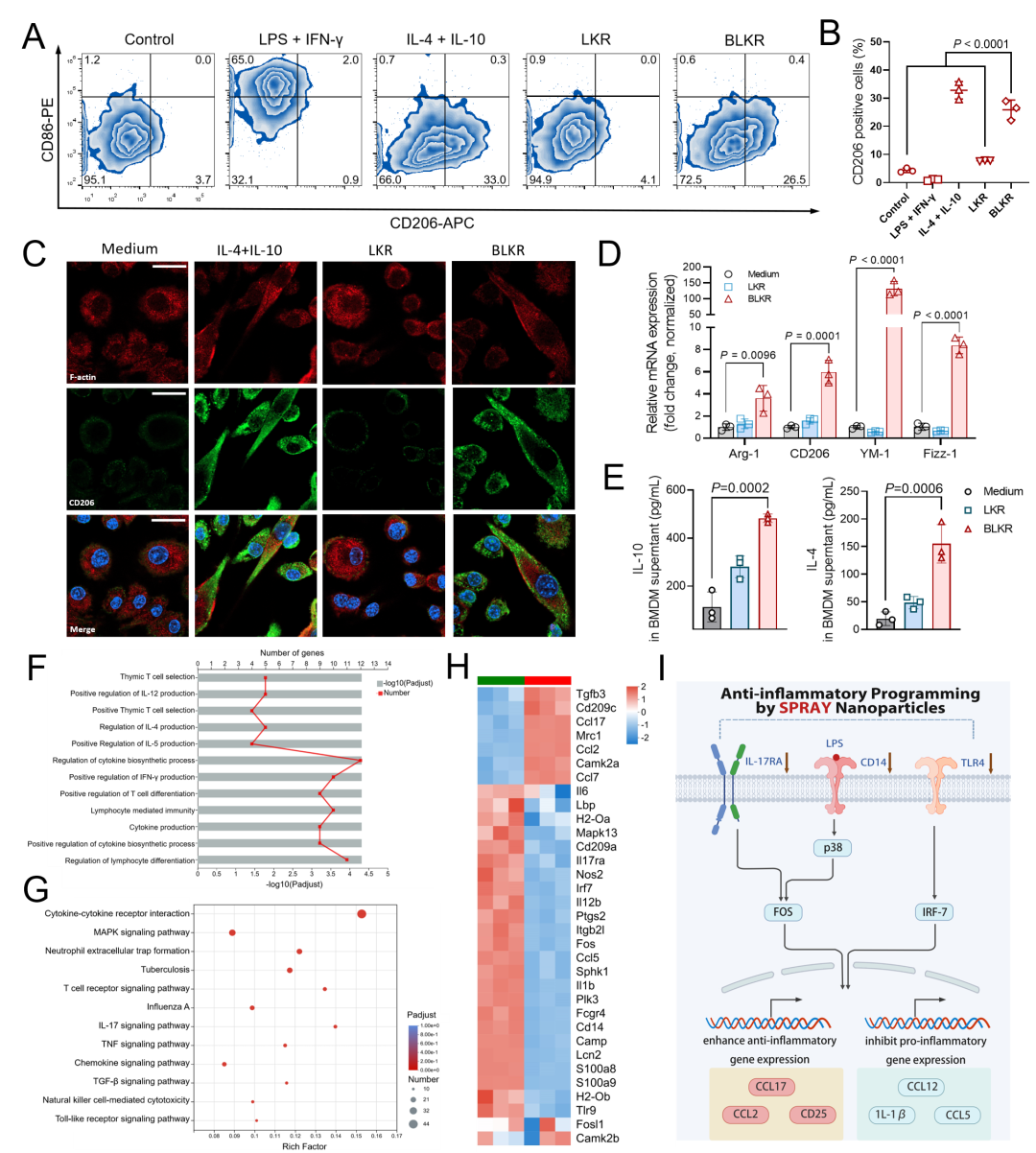
图. 2 N末端修饰增强BLKR的巨噬细胞M2活化能力及相关机理分析。
[N端修饰提升BLKR自组装能力并促进胞质递送过程]
随后研究表明,N末端MPM修饰通过促进BLKR自组装过程,增加BLKR组装体被巨噬细胞吞噬的含量,并促进BLKR分子的溶酶体逃逸过程来最终实现高效的胞质递送,确保了后续的胞内调控过程 (图. 3)。首先,MPM修饰改变了原序列(LKR)的二级结构,确保了BLKR的自组装能力, 呈现临界胶束浓度为89μM。组装形成的纳米颗粒(SPRAY-BLKR-NPs)具有20 nm左右的半径;稳定测试表明该纳米颗粒形貌在肺损伤小鼠肺泡灌洗液(BALF)中可稳定存在1.5小时左右,足以保证肺泡巨噬细胞对SPRAY-BLKR-NPs的摄取。在形成组装体后,BLKR可快速被巨噬细胞吞噬,共孵育5分钟后BLKR的吞噬量约为LKR的30倍; 在吞噬2小时至4小时内BLKR分子破坏内涵体膜结构的完整性从而渗漏到细胞之中。内吞机制研究表明,单独添加Filipin III时,细胞内BLKR阳性信号强度较未添加抑制剂时减少43.01%;同时添加Filipin III,chlorpromazine和EIPA时,仅33.47% 细胞呈现BLKR阳性信号。该结果表明MPM修饰激活了多种不同的内吞途径,包括胞膜小窝介导的胞吞、网格蛋白介导的胞吞和巨胞饮作用。
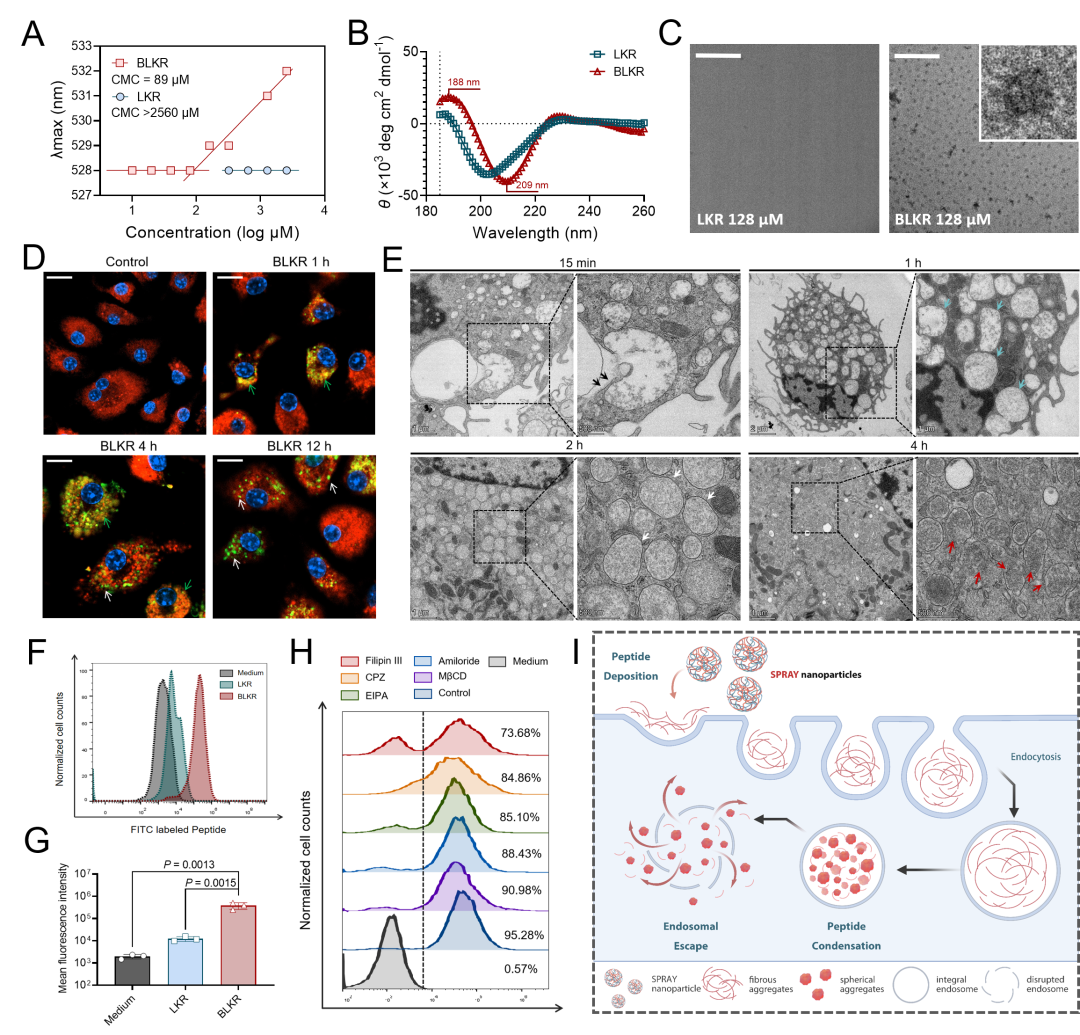
图. 3 BLKR自组装形成纳米颗粒(SPRAY-BLKR-NPs)并增强巨噬细胞对SPRAY分子的吞噬作用和细胞质内的释放过程。
[BLKR的靶向肺部巨噬细胞和代谢过程]
为最大程度确保SPRAY分子在肺部的药物累计,研究人员后续采用经气管的局部给药方式实现SPRAY-BLKR-NPs的局部递送,并进行后续体内分布的研究(图. 4)。荧光共聚焦成像表明,仅少量BLKR分子分布于肺上皮细胞和内皮细胞中,多数BLKR分子呈现与CD68+巨噬细胞呈现共定位。经流式细胞术表明,髓系免疫细胞倾向于摄取BLKR,其中超过51.01%的肺泡巨噬细胞在给药后1小时内呈现BLKR阳性信号。少于10% 中性粒细胞,树突状细胞和嗜酸性粒细胞摄取BLKR。值得一提的是,LKR分子的分布累计几乎不可见,这与细胞实验中LKR的低摄取量是相吻合的。随后,我们对BLKR的肺部残留进行了药代动力学分析。超过83.54% BLKR 分子在给药15分钟后滞留于肺组织中;在给药后24小时内,肺组织中BLKR的AUC比肝和肾中高出47.90和154.13倍,这表明BLKR主要在肺组织中代谢。少量BLKR分子穿过气血屏障后被肝富集,并可在多个哺乳动物的肝微粒体中快速降解。
[SPRAY-BLKR-NPs逆转无菌性肺损伤的炎症进展]
为探索SPRAY的气道递送逆转肺部炎症的效果,研究者通过气道内滴注LPS构建了无菌性小鼠ALI模型,并后续实施SPRAY-BLKR-NPs的局部给药作为治疗(图. 4)。在连续两次给药后(0.38 mg Kg-1),血液和BALF中的中性粒细胞比例分别在第二天和第六天得到改善。对浸润于肺组织中的炎性细胞进行统计后发现,SPRAY-BLKR-NPs于第四天起显著降低炎性浸润。后续肺部巨噬细胞免疫荧光表明,SPRAY-BLKR-NPs在肺组织内实现了显著的M2表型的分化,增加BALF中抗炎细胞因子的水平(IL-4)并成功促进下游肺泡II型巨噬细胞的分化,有助于加速损伤肺组织修复。
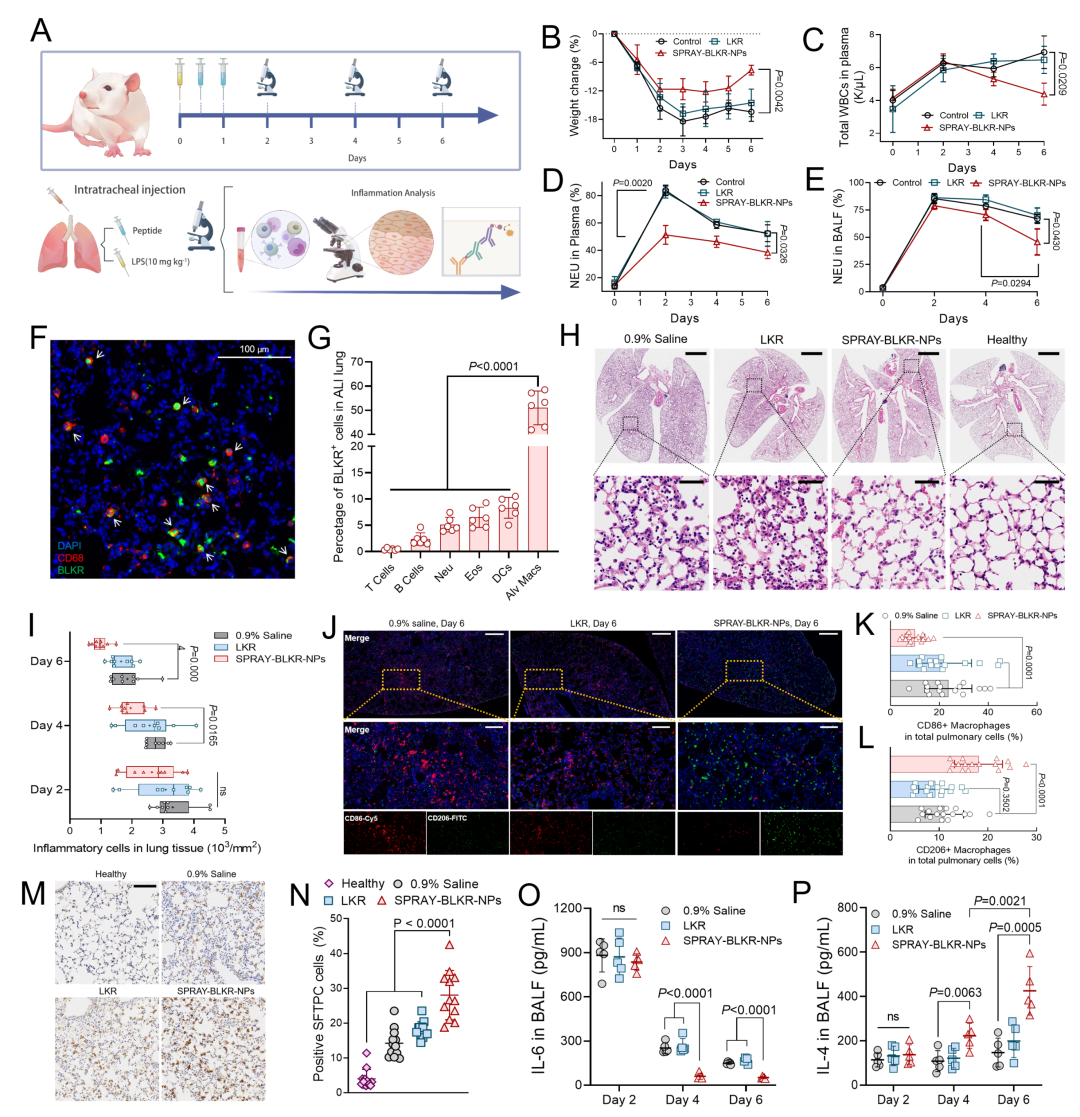
图. 4 SPRAY-BLKR-NPs通过高效靶向肺泡巨噬细胞逆转无菌性肺损伤。
[SPRAY对于肺部巨噬细胞浸润的调节和生物安全性评价]
研究者详细评估了在不同给药剂量下,SPRAY-BLKR-NPs对于健康小鼠中分布巨噬细胞浸润的潜在调控(图. 5)。结果表明在两次给药后,低于0.76 mg Kg-1(256 μM, 50 μL)的给药组别未见明显肺泡巨噬细胞(AlvMs)和间质巨噬细胞(IMs)比例的改变,同时外周血单核细胞比例及相应血液学指标未见明显改变。当给药剂量达到1.51 mg Kg-1(512 μM, 50 μL)时,肺泡处出现轻微免疫细胞浸润。我们随后就0.76 mg Kg-1给药剂量于健康小鼠进行了14天连续给药,证明SPRAY-BLKR-NPs不影响小鼠肺功能和肺部免疫微环境。
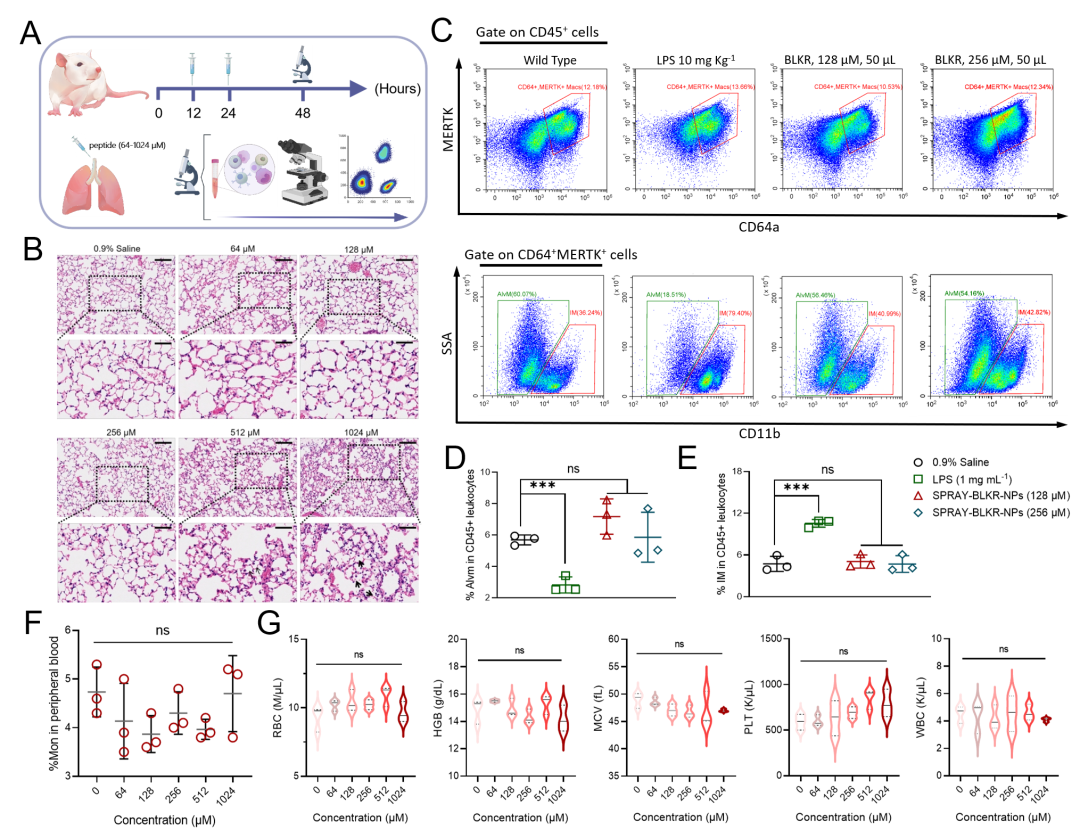
图. 5 SPRAY-BLKR-NPs对健康小鼠肺部巨噬细胞浸润的调控和潜在副作用。
[BLKR破坏革兰氏阴性菌细胞膜并挽救细菌感染所致肺损伤]
研究者首先证明了SPRAY-BLKR-NPs在健康小鼠和肺损伤小鼠的肺泡灌洗液中均具备良好的杀菌性能。同时,SPRAY-BLKR-NPs可清除MRE形成的生物膜。为直观展示杀菌表型,SEM和TEM结果显示经SPRAY-BLKR-NPs处理后,细菌细胞膜出现了明显的破损痕迹。研究者使用NPN荧光分子的泄露水平和DiSC3(5)探针评价细菌的摸通透性和膜电位情况。结果表明,SPRAY-BLKR-NPs处理可大幅增加MRE的膜电位和膜通透性,证明正电BLKR分子与负电细胞膜产生互作导致细胞膜的破碎。机理研究表明,BLKR分子在接触人造菌膜互作后发生了构象转变。为探索SPRAY-BLKR-NPs治疗革兰氏阴性菌所致肺损伤的药效学。研究者肺部感染MRE的小鼠进行了连续两天给药(共4次,0.76 mg Kg−1),随后发现在最后一次给药结束后,SPRAY-BLKR-NPs清除了98.76% 肺部细菌。同时,SPRAY-BLKR-NPs展现出强大的抗炎和组织修复能力,成功降低血压中性粒细胞的数量,提升肺部Th2细胞因子(IL-4)的分泌,改善肺组织损伤情况,并将6日生存率从13,7%提升至73.3%。
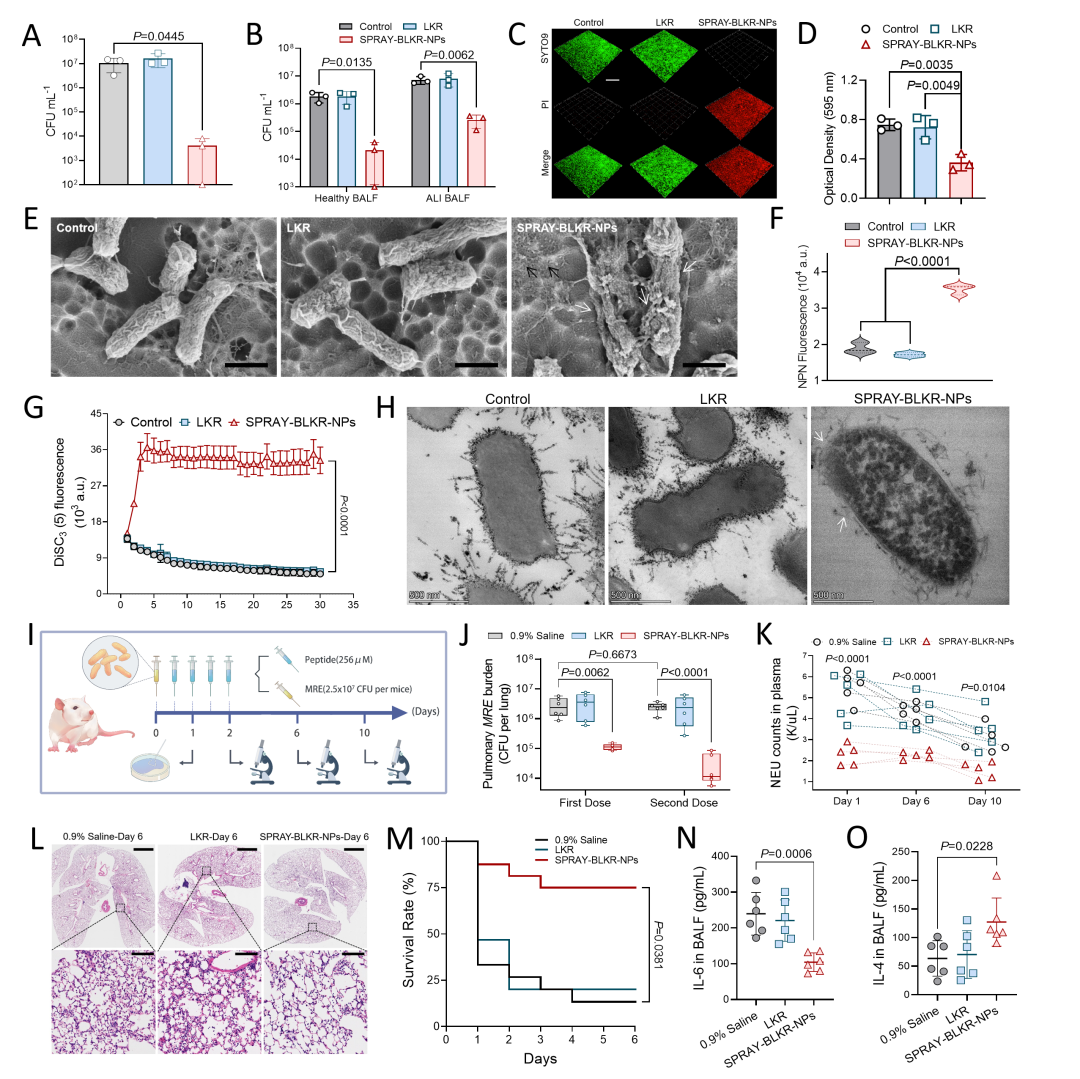
图. 6 SPRAY-BLKR-NPs通过膜破坏机理实验杀菌作用并高效清除呼吸道内的革兰氏阴性菌。
[小结]
总之,研究团队研发了具有抗炎抗菌双效功能的模块化多肽分子BLKR,其自组装形成的可吸入纳米颗粒制剂SPRAY-BLKR-NPs可实现快速的巨噬细胞胞吞和胞质内释放过程;在气道局部给药后能高效靶向肺泡巨噬细胞,促进巨噬细胞的抗炎M2型分化。在损伤的肺泡微环境中展现良好的杀灭革兰氏阴性菌活性。该类模块化多肽分子和可吸入纳米颗粒可能为临床上革兰氏阴性菌所致急性肺损伤的治疗策略提供新的思路。该研究得到了国家自然基金,西湖大学相关基金的支持。
原文链接:
https://www.science.org/doi/10.1126/sciadv.ado1749
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#革兰氏阴性菌# #急性肺损伤#
39