2024 ASCO|徐瑞华教授:晚期胃/胃食管交界处癌症患者的Ⅰ期临床试验
2024-05-31 医悦汇 医悦汇 发表于上海
一项《针对晚期胃/胃食管交界处癌症患者的Claudin 18.2特异性抗体-药物偶联物CMG901的Ⅰ期临床试验》结果也将在此次会议上公布,接下来小编带您先睹为快!
编者按:第60届美国临床肿瘤学会(ASCO)年会于5月31日到6月4日在芝加哥举办芝加哥举行,主题为“The Art and Science of Cancer Care: From Comfort to Cure(癌症治疗的艺术与科学:从舒适医疗到疾病治愈 )”。在2024 ASCO会议公布的约250项口头报告中,共有57项来自中国学者的临床研究入选。中山大学肿瘤防治中心徐瑞华教授领衔的一项《针对晚期胃/胃食管交界处癌症患者的Claudin 18.2特异性抗体-药物偶联物CMG901的Ⅰ期临床试验》结果也将在此次会议上公布,接下来小编带您先睹为快!
摘要号:434420(全体会议)

研究背景
Claudin 18.2(CLDN18.2)是晚期胃/胃食管交界处(G/GEJ)癌症的有希望的治疗靶点。CMG901是一种针对CLDN18.2的首创抗体-药物偶联物,携带单甲基奥瑞司他汀E(MMAE),在临床前研究中显示出强大的抗肿瘤活性。
研究方法
这项I期试验包括剂量递增阶段(A部分;0.3-3.4 mg/kg)和剂量扩展阶段(B部分;2.2、2.6和3.0 mg/kg),以评估CMG901在晚期G/GEJ癌症及其他实体瘤患者中的安全性、耐受性和抗肿瘤活性。A部分研究入组时不要求CLDN18.2表达,但在B部分,G/GEJ癌症患者要求CLDN18.2表达为≥2+膜染色强度,在≥5%的肿瘤细胞中。CMG901每3周静脉给药一次,直至疾病进展或不可接受的毒性。主要终点为A部分的安全性/耐受性和最大耐受剂量(MTD),B部分为客观反应率(ORR,根据RECIST v1.1)和推荐的II期剂量。这里我们展示来自这项正在进行的试验的G/GEJ癌症数据。
研究结果
在剂量递增期间未达到MTD。截至2023年7月24日,113名G/GEJ癌症患者接受了2.2-3.0 mg/kg剂量的CMG901(A部分6名和B部分107名)。中位先前接受的系统治疗线数为2(范围1-6)。最常见的治疗紧急不良事件(TEAEs)是贫血(62.8%)、呕吐(57.5%)和低白蛋白血症(57.5%)。中性粒细胞计数下降(18.6%)和贫血(13.3%)是最频繁的≥3级TEAEs。在89名可评估的(至少1次治疗后扫描)CLDN18.2阳性患者中,确认的ORR为32.6%(见表)。对于所有93名CLDN18.2阳性患者,中位无进展生存期为4.76个月(95%CI 3.35-6.14),中位随访时间为5.98个月。中位总生存期(OS)未达到,9个月时的OS率为56.4%。
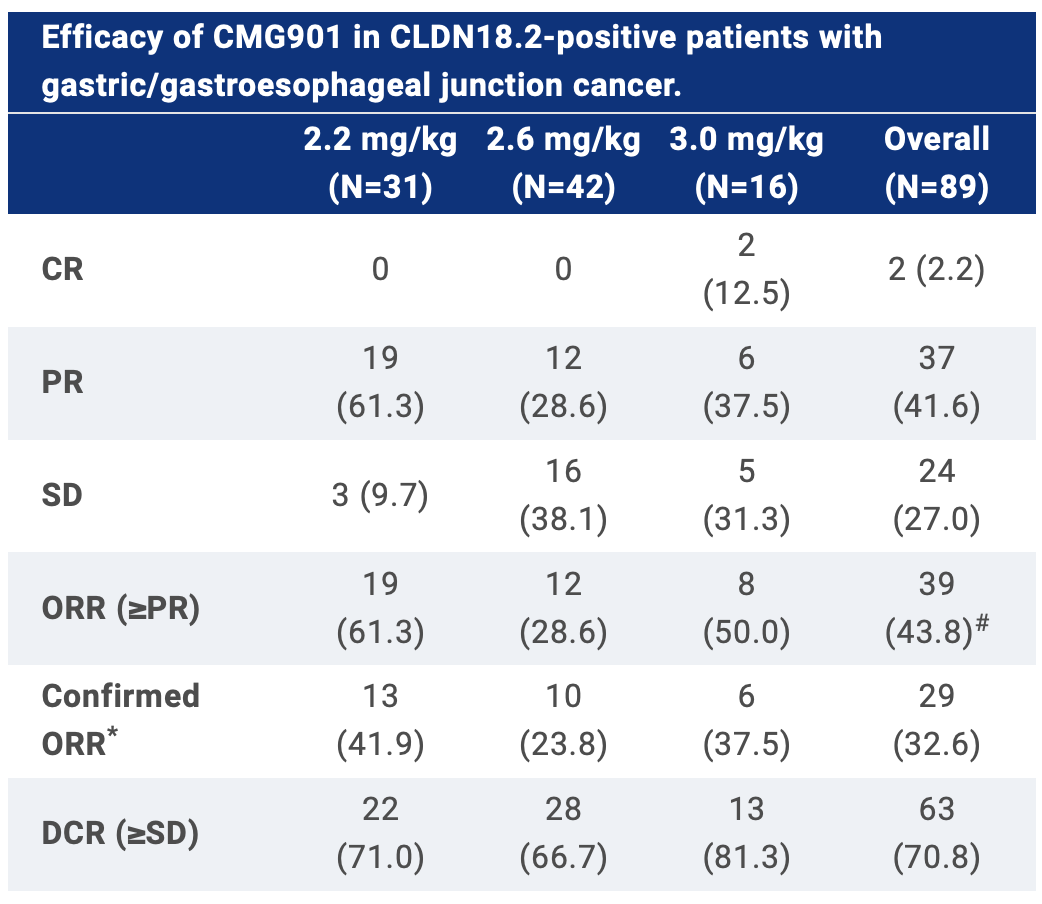
数据以N(%)的形式呈现。CR代表完全缓解;PR代表部分缓解;SD代表疾病稳定。CLDN18.2阳性定义为≥20%的肿瘤细胞表达CLDN18.2的强度达到≥2+。#包括2名有潜力达到确认部分缓解的患者。*计算为连续两次评估显示CR或PR的患者比例。
研究结论
CMG901在CLDN18.2阳性G/GEJ癌症患者中显示出有希望的临床疗效,并且具有可控的安全性。这些结果支持在CLDN18.2阳性G/GEJ癌症中进一步评估CMG901。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#I期临床试验# #晚期胃/胃食管交界处癌#
17