震惊!台州、辽宁、温州三地医学巨头联手揭秘:黄藤素竟能拯救脓毒症脑病小鼠?
2024-07-27 梅斯循证中医药 MedSci原创 发表于上海
文章探讨了黄藤素对SAE小鼠模型的相关作用机制。
脓毒症,是一种由感染诱发的全身性炎症反应综合征,其病程发展可能导致脓毒症休克和多器官功能障碍综合征,发病率与死亡率均居高位。脓毒症相关脑病(SAE)是其常见的神经系统并发症,在ICU中尤为普遍。然而,鉴于SAE的发病机制错综复杂,且目前缺乏精确的医学影像与明确的诊断标准,早期诊断面临极大挑战。因此,深入探究SAE的发病机制,并在此基础上寻找并开发针对SAE的有效治疗药物,具有至关重要的意义。
黄藤素具有广谱的抑菌抗病毒特性,能显著增强白细胞对细菌的吞噬能力,并具备优良的抗炎效果及机体免疫力的增强作用。在调控炎症及改善脓毒症方面,黄藤素表现出其独特的效能。然而,关于黄藤素治疗SAE的确切功能及其潜在的作用机制,目前尚未有明确的科学阐释。
近日,一篇名为“Palmatine ameliorated lipopolysaccharide-induced sepsis-associated encephalopathy mice by regulating the microbiota-gut-brain axis”的学术论文,探讨了黄藤素对SAE小鼠模型的相关作用机制。

图1 论文首页
黄藤素对SAE小鼠脑、肺、小肠、肝、心、脾、肾病理的影响
研究对黄藤素在SAE小鼠组织中的影响进行了评估。结果显示,与对照组相比,LPS组的脑、小肠、肺和心脏组织均呈现出显著的病理形态变化,但肝脏、肾脏和脾脏未观察到类似改变(图2)。具体而言,在SAE小鼠的脑组织中,神经元明显的变性和核固缩现象,同时伴随有显著的炎症细胞浸润(红色箭头指示炎症浸润,绿色箭头指示核固缩)。
LPS组的小肠黏膜微绒毛结构受到显著破坏,表现为微绒毛的缺失、萎缩、变形及坏死(黄色箭头指示潘氏细胞,红色箭头指示绒毛丧失,绿色箭头指示绒毛变性和坏死)。LPS组小鼠的肺组织则显示出肺泡间隔增厚、间质水肿显著以及炎症细胞的浸润(红色箭头指示)。
在心脏组织中,LPS的刺激导致心肌毛细血管出现轻度充血,并伴有心肌细胞间隙内炎症细胞的显著浸润。绿色箭头指示心肌水肿、心肌间质增厚及水肿液积聚的情况。此外,红色箭头还指示了心肌细胞的变性和坏死,以及炎症细胞的局部浸润。值得关注的是,经过给予2.5或5.0mg/kg剂量的黄藤素干预后,上述病理改变均得到了显著的改善。
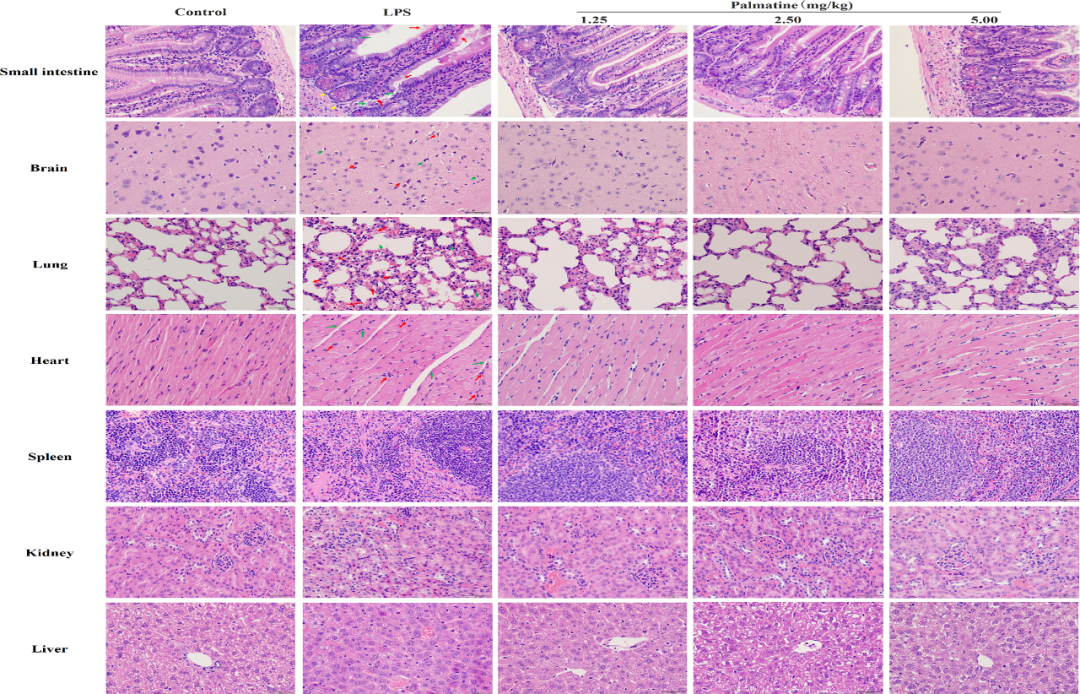
图2 黄藤素治疗后SAE的脑、肺、小肠、肝、心、脾、肾HE染色(×400)
黄藤素调节LPS诱导的SAE小鼠炎症细胞因子水平
为评估黄藤素在抗炎作用方面的表现。经ELISA技术精确测定,研究观察到相较于对照组,LPS组的血清中炎症因子IL-1β、IL-6、TNF-α及IL-10的浓度呈现出显著的上升趋势(p<0.01),这一发现有力指示了炎症反应的活跃状态。然而,在给予小鼠2.5和5.0mg/kg的黄藤素处理后,血清中IL-1β、IL-6和TNF-α的浓度均呈现显著下降(p<0.01),结果表明黄藤素具有有效的抗炎作用。同时,给予小鼠1.25、2.5和5.0mg/kg的黄藤素后,血清中IL-10的浓度显著增加(p<0.01),这进一步验证了黄藤素在调节炎症平衡中的积极作用。
黄藤素对SAE小鼠脑组织细胞凋亡的影响
研究采用TUNEL染色技术,对黄藤素在SAE小鼠脑组织细胞凋亡中的作用进行了严谨评估。结果显示,与对照组相比,LPS组小鼠的凋亡细胞百分比显著上升(p<0.01),而黄藤素则能显著逆转此效应(p<0.01)。进一步统计数据显示,2.5mg/kg剂量的黄藤素在抑制细胞凋亡、提升脑存活率方面,其效果明显优于1.25mg/kg或5.0mg/kg剂量的黄藤素(图3)。
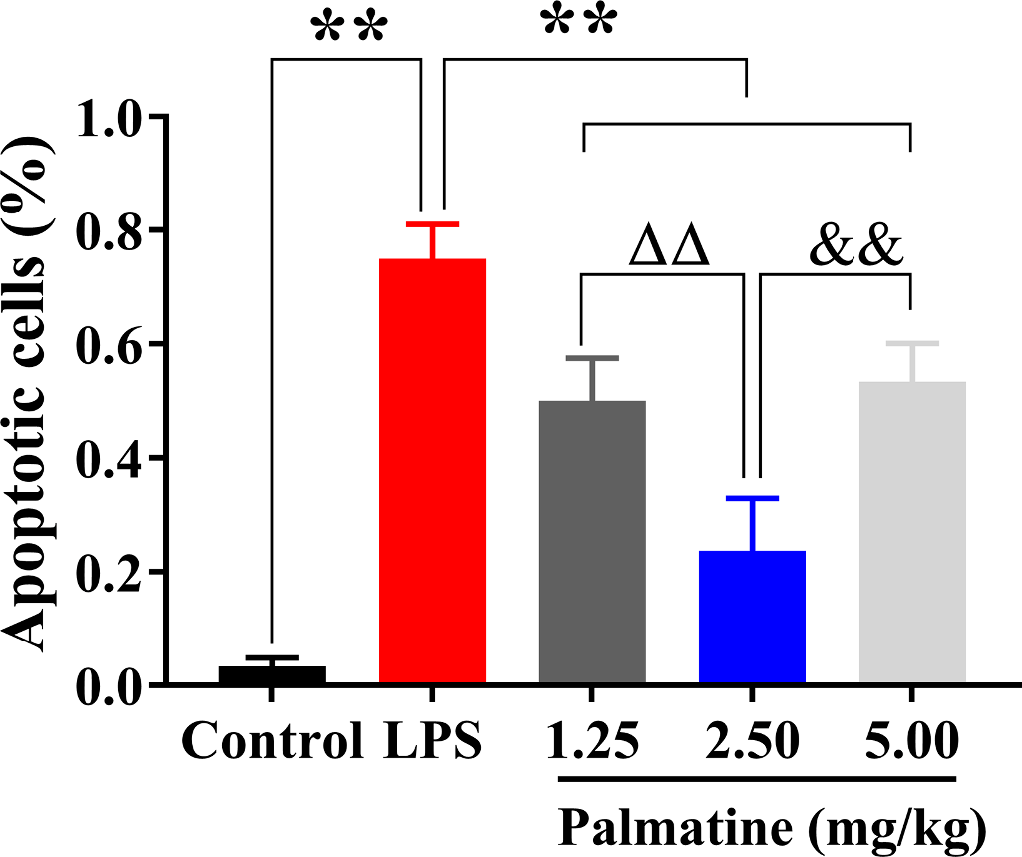
图3 黄藤素对抑制脑组织细胞凋亡的影响
黄藤素对SAE小鼠Notch1/NF-κB信号通路具有抑制作用
LPS组中的Notch1、PARP-1、Caspase-1和NF-κB的蛋白表达量相较于对照组呈现出显著增高(p<0.01)(图4A)。进一步对比模型组,2.5mg/kg黄藤素处理组中上述蛋白的表达呈现出弱阳性趋势,且阳性细胞的数量明显减少(p<0.01)。RT-PCR技术检测显示,LPS组Notch1、PARP-1、Caspase-1和NF-κB的mRNA表达水平较对照组显著上调(p<0.01),而2.5mg/kg黄藤素处理组能够有效逆转这一上调趋势(图4B)。此外,通过WB(Western Blot)分析,LPS组Notch1、PARP-1、caspase-1和p-NF-κB的蛋白表达相较于对照组也呈现显著上调(p<0.01),而2.5mg/kg黄藤素处理组能够逆转这一上调现象(图4C)。
基于分子对接技术的分析,黄藤素与Notch1和NF-κB形成的复合物具有特定的结合能,分别为-6.5kcal/mol和-7.7kcal/mol。黄藤素通过与谷氨酸(GLU,键长:3.45Å)、天冬酰胺(ASN,键长:3.76Å)和丝氨酸(SER,键长分别为3.50Å、3.60Å)形成氢键与Notch1产生结合作用(图4D)。在黄藤素与NF-κB的相互作用中,同样观察到两个氢键的形成,分别与甘氨酸(GLY,键长:3.28Å)和组氨酸(HIS,键长:3.15Å)相连(图4E)。
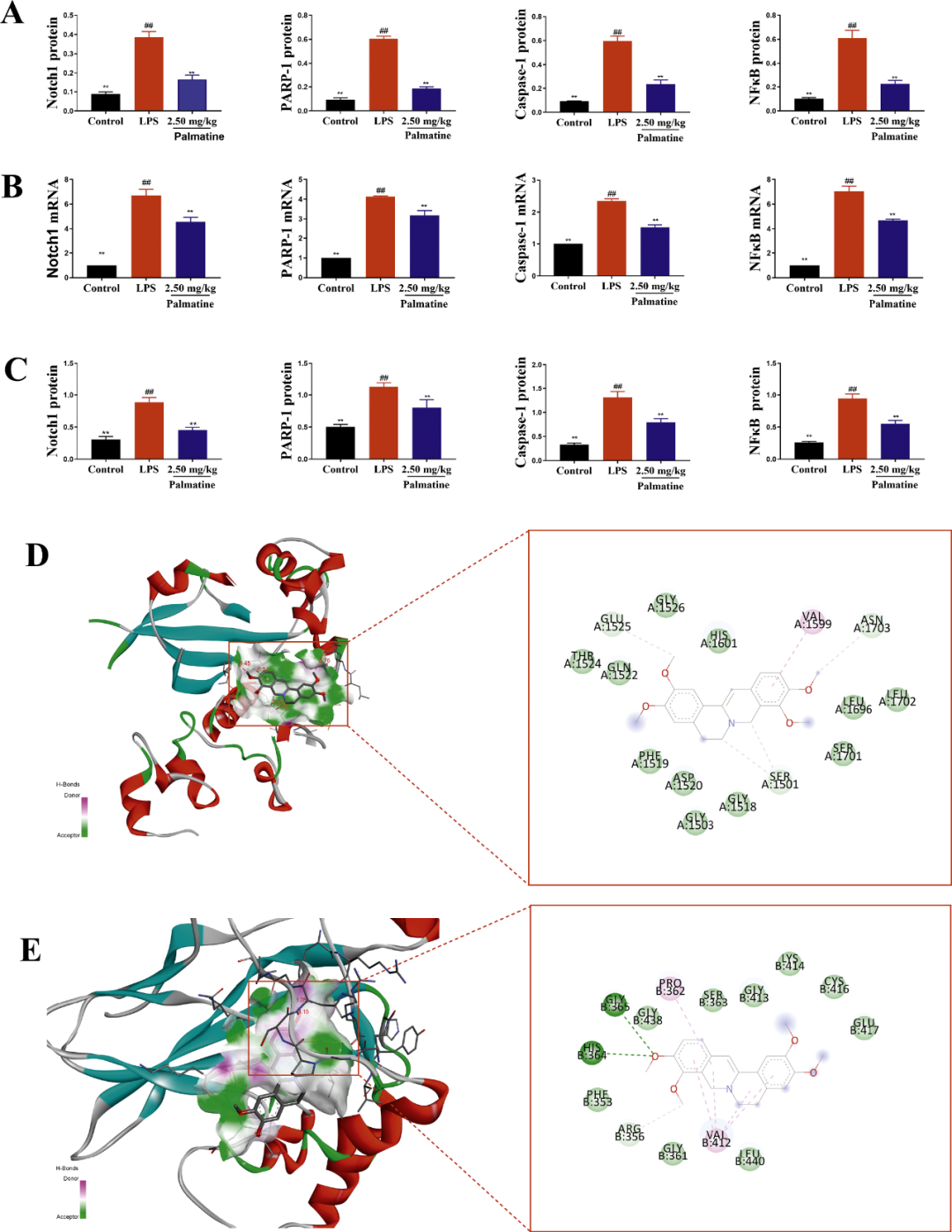
图4 黄藤素对SAE小鼠小肠和脑组织中Notch1、PARP-1、Caspase-1和p-NF-κB的影响
结论
综上所述,研究证明黄藤素因能抗炎,抑制细胞凋亡、提高提升脑存活率,甚至对Notch1/NF-κB信号通路具有明显抑制作用,而在SAE中表现出色,为治疗SAE的新药研发提供了新的思路和策略。
参考文献:
Xu Y, Shen B, Pan X, Liu C, Wang Y, Chen X, Wang T, Chen G, Chen J. Palmatine ameliorated lipopolysaccharide-induced sepsis-associated encephalopathy mice by regulating the microbiota-gut-brain axis. Phytomedicine. 2024 Feb;124:155307. doi: 10.1016/j.phymed.2023.155307
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#脓毒症# #黄藤素#
67