Br J Haematol:早期MRD阴性的成人B-ALL,自体和异基因移植结局无差异
2023-05-20 聊聊血液 网络 发表于上海
早期MRD阴性的成人B-ALL,自体和异基因移植结局无差异。
B-ALL移植结局
异基因造血干细胞移植 (allo-HSCT) 是急性淋巴细胞白血病(ALL)患者缓解后的标准治疗,可降低复发风险,但也伴有较高的治疗相关死亡率 (TRM)。近年来B细胞-ALL (B-ALL)的治疗取得了显著进展,allo-HSCT在首次 CR(CR1) 患者中的作用是一个积极研究的领域,其主导作用受到的挑战包括B-ALL 新型靶向治疗(包括针对特异性肿瘤抗原的单克隆抗体和CAR T细胞)、paediatric-inspired方案、二代和三代TKI (Ph+ ALL)等,这些都是可考虑的替代和毒性较小治疗选择,尤其是对于 MRD 阴性的患者。此外自体 HSCT(auto-HSCT)具有移植相关死亡率低、无移植物抗宿主病 (GVHD) 和生活质量较好等优点。
研究显示,在 TKI 时代首次达到完全分子学缓解 (CMR) 的Ph+ ALL患者中,清髓性 auto-HSCT 和 allo-HSCT 的结局相当,其他几项研究中Ph+ ALL患者 auto-HSCT的结果同样令人惊喜。但关于 auto-HSCT 在 Ph 阴性 B-ALL 中应用的研究结果仍存在争议。而随着对肿瘤生物学的深入了解、残留疾病负荷的灵敏检测和新治疗药物的开发,auto-HSCT也可作为 Ph阴性 ALL 的巩固治疗。
在《British Journal of Haematology》近日发表的一项回顾性研究中,作者基于B-ALL 患者CR1的MRD状态,分析了接受 auto-HSCT后维持治疗和 allo-HSCT 的结局,可以为优化治疗选择提供坚实的基础,本文共同通讯作者为姜尔烈教授和张荣莉教授,第一作者为吕梦楠医生。

作者回顾性分析了天津血研所的临床资料,纳入患者标准如下:年龄15-65岁;根据WHO标准诊断为B-ALL;移植时为CR1;2012年1月1月至2021年12月期间进行HSCT并排除二次移植;清髓性预处理。在每次化疗后评估患者MRD状态,对于3个疗程后 MRD 阳性的患者,建议行allo-HSCT;此外14例患者缺乏具有相同 HLA 类型或单倍体供者的亲缘或无关供者,因此在自愿的基础上采用auto-HSCT。对于 MRD 阴性患者,无匹配同胞供者的患者可提供 auto-HSCT 作为替代选择,结果88例选择了 auto-HSCT。此外auto-HSCT后有维持治疗。
患者特征
CR1 中共有355例 B-ALL 患者入组研究,其中 auto-HSCT 102例,MSD-HSCT 97例,haplo-HSCT 133例和 URD-HSCT 23例。患者临床特征总结见表1。与 allo-HSCT 组相比,auto-HSCT组3个化疗周期后和移植前达到MRD阴性的受者比例更高。auto-HSCT 组的大多数患者为标危,且白细胞计数较低。auto-HSCT 组从诊断到移植的中位时间为9个月,allo-HSCT组为7个月。auto-HSCT 组化疗周期中位数为6个,allo-HSCT组为5个。两组在性别、年龄(中位年龄35岁)、中枢神经系统白血病、血小板计数、腰椎穿刺次数和 TBI 预处理治疗方案方面相当。

造血重建和GVHD
所有患者均达到中性粒细胞重建,但20例患者血小板恢复失败,其中1例为auto-HSCT 组,患者在 auto-HSCT 后1个月内出现血液学复发,后续化疗后未缓解。中性粒细胞植入的中位时间为13 天,血小板恢复的中位时间为18 天。在 allo-HSCT 组,MSD-HSCT组、haplo-HSCT组和 URD-HSCT 组3个月内Ⅱ-Ⅳ度急性 GVHD 的发生率分别为19.6±4.1%、34.1±4.2%和47.8±10.7% (p=0.019),3年内 cGVHD 的发生率分别为40.1±5.1%、30.3±4.9%和23.1±9.4% (p=0.198)。
长期生存
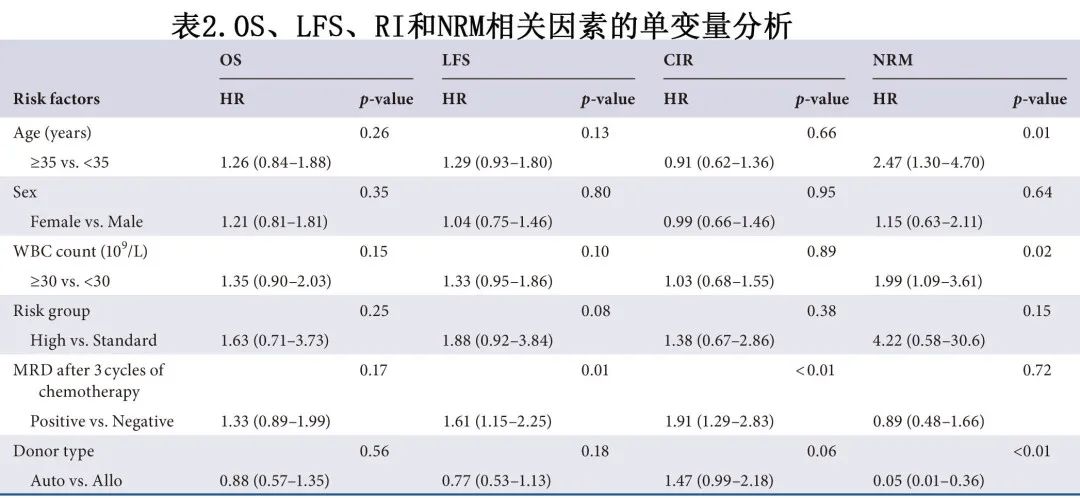
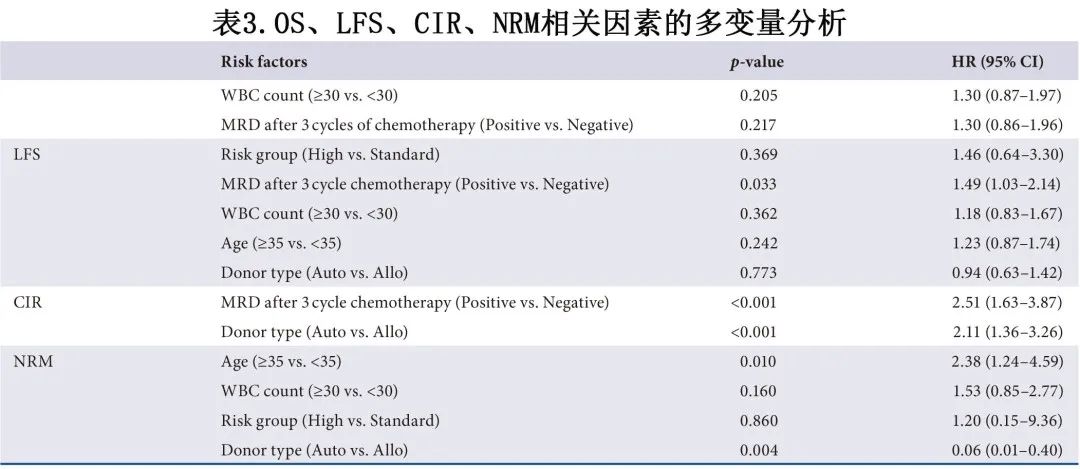
所有355例患者的中位随访时间为移植后22个月。共96例患者死亡(原因包括:54例复发,29例感染,10例aGVHD,1例cGVHD,1例 PTLD 和1例肺出血)。移植后3年 OS 和 LFS 率分别为68.5%和54.9%。auto-HSCT 组3年 OS 和 LFS 率分别为71.1%和59.9%。对于allo-HSCT 组,3组的3年估计 OS 无显著差异,MSD-HSCT后为68.4%,haplo-HSCT后为66.5%,URD-HSCT后为68.5% (p=0.987);3年估计LFS同样没有显著差异,分别为50.0%、53.5%和58.7% (p=0.904)。在单变量和多变量分析后,未观察到供者类型对 OS 和 LFS 的影响,但3个化疗周期后MRD 阳性患者的死亡率和复发风险增加(表2和表3)。
复发和NRM
随访结束时,355例患者中98例在移植后中位时间5个月复发。所有患者第3年的累积复发率 (CIR) 为32.2%,其中auto-HSCT后为39.6%,MSD-HSCT 受者 (30.8%) 的 CIR 与 haplo-HSCT 组 (26.8%) 和 URD-HSCT 组 (26.4%) 相当 (p=0.904)。所有患者3年 NRM 率为13.1%,其中auto-HSCT后为1.1%,MSD-HSCT、haplo-HSCT和 URD-HSCT 组的 NRM 率分别为19.2%、19.8%和13.0% (p=0.750)。多变量分析显示,auto-HSCT 和3个化疗周期后MRD阳性的复发率风险增加,而allo-HSCT 和年龄≥35岁的NRM风险增加(表3)。
auto-HSCT和allo-HSCT的结局相当
由于 auto-HSCT 和 allo-HSCT 患者基线特征的差异,采用基于风险分类和3个化疗周期后 MRD 状态分层的模型评估治疗疗效(表4),包括:标危伴3个化疗周期后 MRD 阴性(组1)、高危伴3个化疗周期后 MRD 阴性(组2)和高危伴3个化疗周期后 MRD 阳性(组3)。结果发现,在标危伴3个化疗周期后MRD阴性组,auto-HSCT 或 allo-HSCT 组患者之间(17例 vs 12例)无显著差异:3年OS [82.5% vs. 74.1%,p=0.364]、LFS [74.5% vs. 74.1%,p=0.904]、CIR [25.5% vs. 17.6%,p=0.648] 和 NRM 率 [0% vs. 8.3%,p=0.234] 。
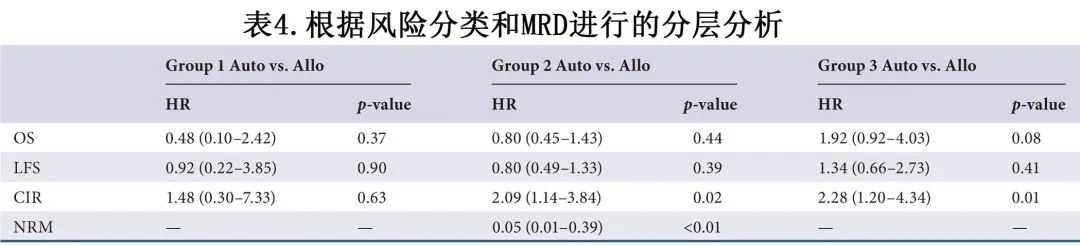
对于184例(71例auto-HSCT,113例allo-HSCT)MRD阴性且有高危因素的患者,3年 OS 和 LFS 率分别为 [72.7% vs 68.5%,p=0.441] 和 [62.8% vs 56.1%,p=0.383],其生存抵消的原因在于,与 allo-HSCT 组相比,auto-HSCT组的 NRM 较低 [1.5% vs. 25.1%,p<0.001] 而CIR较高 [35.7% vs. 18.9%,p=0.018](图1)。
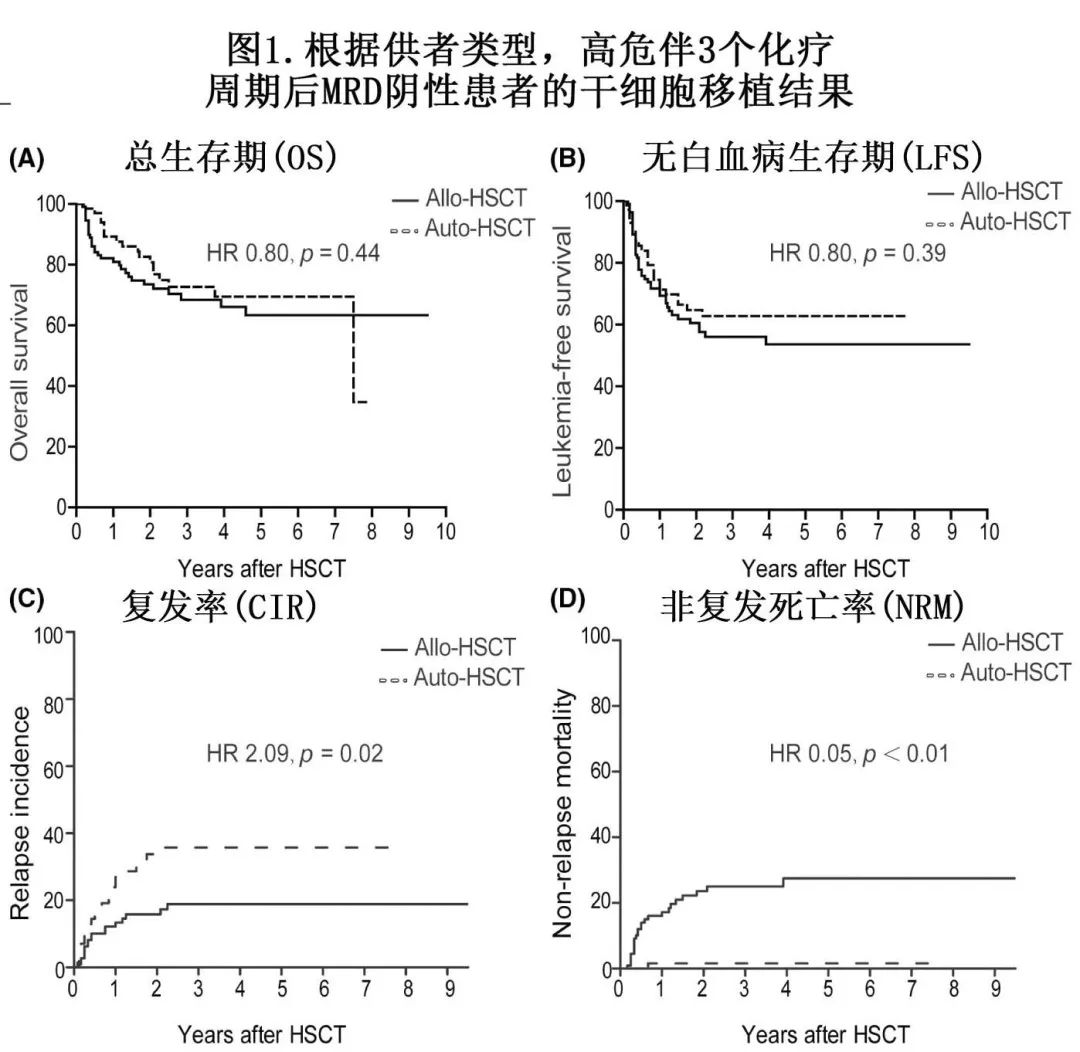
对于其余142例(14例auto-HSCT,128例allo-HSCT)有高危因素伴3个化疗周期后 MRD 阳性的患者,有3年 OS降低的趋势[50.0% vs. 66.0%,p=0.078]且CIR率显著升高 [71.4% vs. 39.1%,p=0.018],而LFS [30.8% vs. 47.1%,p=0.404] 和NRM [0% vs. 14.1%,p=0.100] 无显著差异。
由于样本量有限,在检验中未观察到显著相互作用(表5)。此外应注意的是,6例患者在开始维持治疗前2个月内复发,而其他96例患者接受 auto-HSCT 维持治疗的中位时间为移植后12个月。此外allo-HSCT患者未接受维持治疗。
B-ALL的突变谱
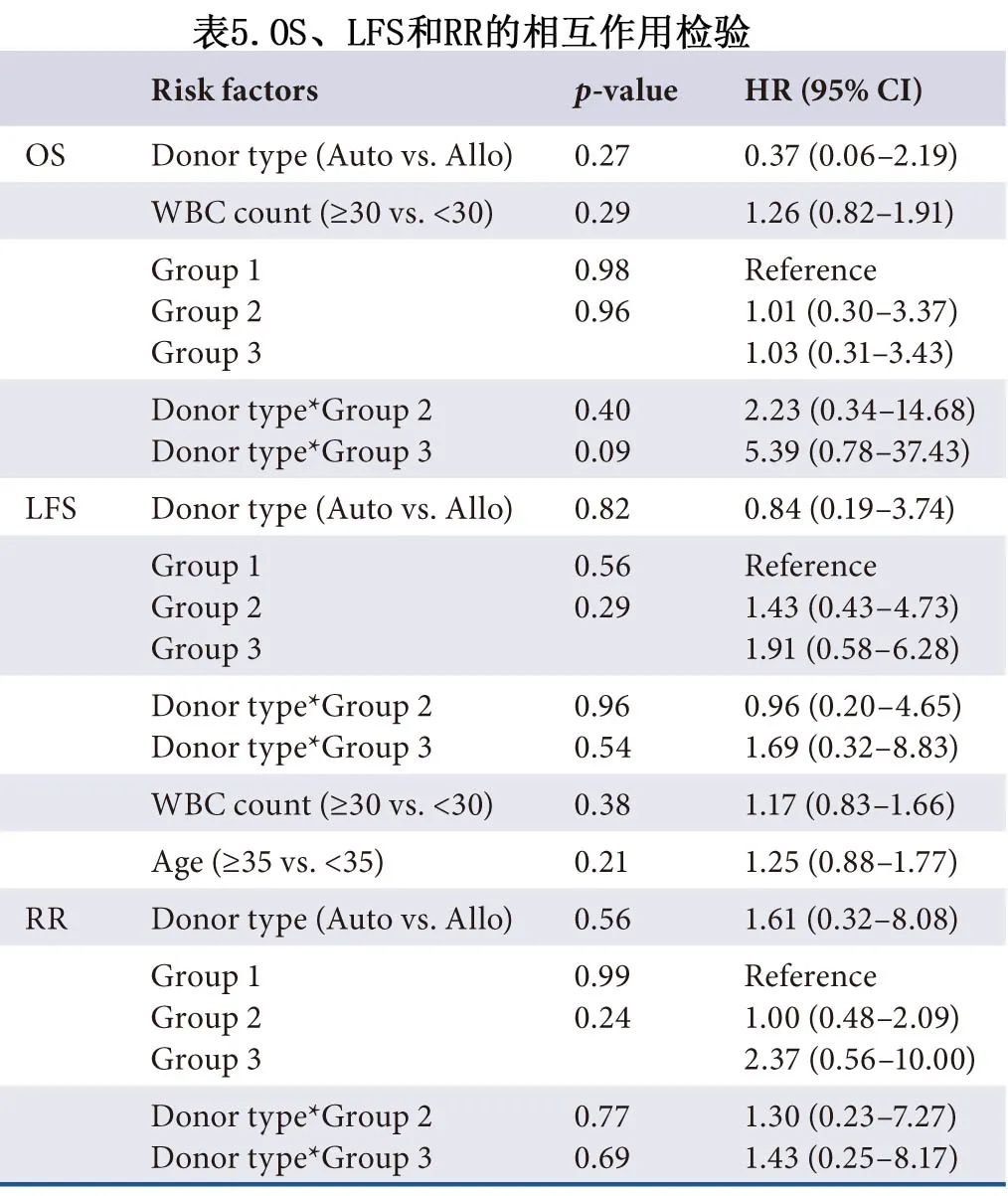
本研究在诊断时使用二代测序对175例患者进行检测,其中12例为阴性,其余163例患者至少有一个基因突变,共87例患者携带至少3种基因突变。最常发生突变的8个基因为KMT2D、FAT1、NRAS、PAX5、KRAS、SETD2、ASXL1、PTPN1。NRAS、KMT2D、KRAS、FAT1、PAX5、PTPN11、FLT3、CREBBP、NOTCH1和 TP53 在 Ph 阴性 ALL 中最常见,而在 Ph 阳性 ALL 中最常见的是KMT2D、FAT1、RUNX1和SETD2。
NGS 基因组中涉及的主要信号通路为转录因子/调节因子、Ras/蛋白磷酸酶/MARK 信号通路、JAK-STAT通路、mRNA加工调节、表观遗传调节剂等。
175例患者的3年 OS 和 LFS 率分别为68.8%和57.3%,3年 CIR 和 NRM 率分别为29.7%和13.0%。JAK-STAT通路突变患者在3个化疗周期后达到阴性 MRD 方面更困难 (p=0.066)。
总结
根据3个化疗周期后的风险分类和MRD状态分层的模型评估疗效。对于 MRD 阴性患者,Auto-HSCT的3年OS率(72.7% vs. 68.5%,p=0.441) 和无白血病生存率 (62.8% vs. 56.1%,p=0.383) 与 allo-HSCT 相当,但较低的非复发死亡率(1.5% vs. 25.1%,p<0.001)被较高的累积复发率 (CIR) 所抵消 (35.7% vs. 18.9%,p = 0.018),尤其是在高危患者中。对于MRD阳性的高危患者, auto-HSCT的3年 OS 有较低的趋势 (50.0% vs. 66.0%,p=0.078),但CIR率显著较高 (71.4% vs. 39.1%,p=0.018)。
总的来说,对于3个化疗周期后 MRD 阴性的患者,auto-HSCT并维持治疗似乎是一种有吸引力的治疗方法,而对于 MRD 阳性患者,allo-HSCT可能更有效。
参考文献
Mengnan Lv, Liangyi Liu, Yi He,et al. Outcomes of allogeneic or autologous stem cell transplantation followed by maintenance chemotherapy in adult patient with B-ALL in CR1 with no detectable minimal residual disease.Br J Haematol . 2023 May 8. doi: 10.1111/bjh.18846.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言