病例分享|一例A型胃炎伴胃多发息肉的诊治经验
2024-09-04 消化界 消化界 发表于上海
本文结合相关文献复习,分享一例A型胃炎伴胃多发息肉的诊疗经过,以提高临床医师及内镜医师对该病的认识。
目前认为A型胃炎是一种由CD4+T细胞介导的自身免疫性萎缩性胃炎,以胃体、胃底为主的黏膜及黏膜内固有腺体萎缩为特点,早期常表现为腹胀、消化不良、非酸反流等非特异性消化道症状,晚期逐渐出现贫血、周围神经病变、脊髓亚急性联合变性等并发症[1]。临床上早期A型胃炎诊断率低,部分患者甚至在出现严重并发症后才得以明确诊断。本文结合相关文献复习,分享一例A型胃炎伴胃多发息肉的诊疗经过,以提高临床医师及内镜医师对该病的认识。
病例简介
基本资料:患者男,55岁,主诉“头昏3年、四肢远端麻木乏力1年”。
现病史:患者3年前无明显诱因出现头昏、心慌、记忆力下降,无头痛、恶心、呕吐,无耳鸣及视力模糊,伴腹胀、消化不良,无腹痛、腹泻、反酸、烧心,多次于当地医院诊疗,症状反复发作,于1年前开始出现四肢远端麻木、伴双下肢乏力、行走不稳,遂就诊于我院。
既往史:体健,无特殊疾病史。
诊疗经过:2023年07月患者先后就诊于我院心内科及血液科门诊,完善血常规:血红蛋白126g/L,红细胞3.35×1012/L,平均血红蛋白浓度(MCHC)340g/L,平均红细胞体积(MCV)110.7fl。贫血三项:血清铁蛋白33.5pmol/L,叶酸54.36nmol/L,维生素B12 104 pmol/L。诊断为巨幼细胞性贫血,予以补充叶酸及维生素B12治疗,患者症状无明显改善。
2023年8月于我院神经内科住院治疗,期间完善肝肾功能、抗核抗体普、风湿系列、TORCH五项、甲功五项、男性肿瘤标志物、脑脊液常规+生化+细菌培养、胸部CT、腹部彩超、头颅MRI、颈部血管超声、经颅多普勒脑血流图均未见明显异常;肌电图诱发电位检查:周围神经病变;颈椎MRI:脊髓亚急性联合变性?其他脱髓鞘病变?胃镜:慢性萎缩性胃炎(0-2),胃体多发息肉,活检示增生性息肉(图1)。诊断为周围神经病变、巨幼细胞性贫血、慢性萎缩性胃炎、胃多发息肉,予以营养神经、补充铁剂、维生素B12、补充消化酶等治疗后症状稍缓解出院。
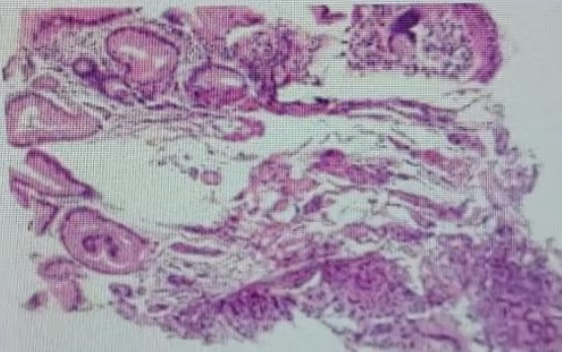
图1 病理提示黏膜慢性炎伴息肉样增生
2023年09月于消化科门诊就诊,完善14C呼气试验阳性,结合之前胃镜检查,诊断为慢性胃炎、幽门螺杆菌感染,予以根除HP治疗,之后患者仍有腹胀、消化不良,间断口服叶酸、维生素B12、铁剂等治疗,期间多次复查血常规提示血红蛋白均波动于正常范围。
2024年7月,患者再次就诊于我院消化内科门诊,仍有四肢麻木乏力,诉病程中逐渐出现闷油、舌头疼痛、食物无味、无饥饿感,复查呼气试验阴性,复查胃镜示:慢性萎缩性胃炎、胃多发小息肉样隆起,镜下考虑A型胃炎(图2);遂完善胃功能:胃蛋白酶原I (PGI)14.51ng/ml,胃蛋白酶原II (PGII)4.44ng/ml,胃泌素17 (G-17)84.95pmol/L,萎缩性胃炎抗体:抗胃壁细胞抗体阳性;予以内镜下息肉氩气凝固治疗(APC)。
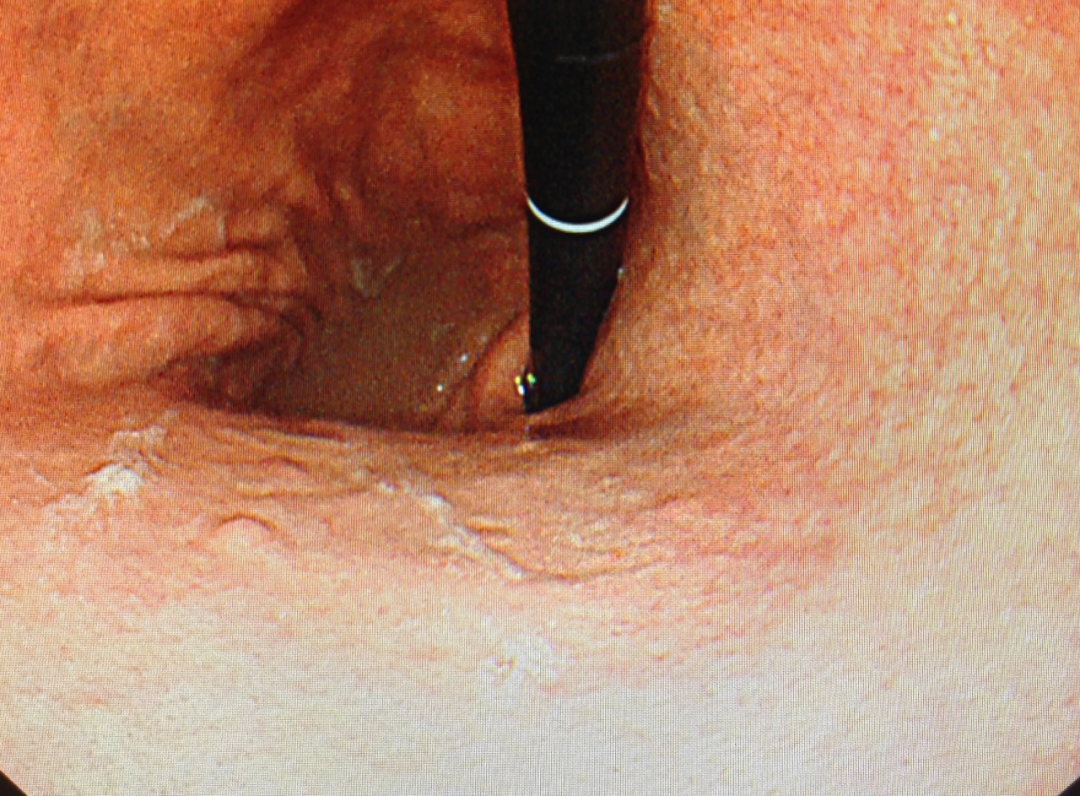
图2 镜下胃体底黏膜萎缩、多发小息肉样隆起
诊断与治疗:A型胃炎、胃多发增生性息肉、巨幼细胞性贫血、脊髓亚急性联合变性、周围神经病变,嘱继续口服补充叶酸、维生素B12、铁剂、消化酶等治疗,并定期复查胃镜、胃功能、贫血三项等指标。
讨论与总结
自身免疫性胃炎(AIG)是一种以胃黏膜内H+/K+-ATP酶为自身抗原,激活CD4+T细胞,刺激B细胞分化为浆细胞,产生萎缩性胃炎抗体,包括抗壁细胞抗体(PCA)和抗内因子抗体(IFA),同时释放一系列促炎因子,触发上皮细胞凋亡和萎缩;部分患者可合并其他自身免疫性疾病,如自身免疫性甲状腺病、自身免疫性肝病、1型糖尿病、白癜风、Addison病及重症肌无力等[2]。
AIG早期临床表现不典型,常为腹胀、消化不良、食欲下降等非特异性症状,病程早期内镜下黏膜萎缩不明显,且部分医师对该病认识不足,故早期诊断率低,吴杨庆[3]等国内学者研究显示该病延误诊断率达50%以上,其中78.3%的患者病程达2年以上,34.8%的患者病程达5年以上。
随着病情进展,AIG患者的胃体底黏膜萎缩逐渐加重,镜下表现为典型的黏膜变薄、血管显露,而胃窦无或轻度萎缩的“逆萎缩”特征,在合并幽门螺杆菌感染时,也可表现出包括胃窦在内的全胃高度萎缩(0-3);由于胃黏膜及黏膜内分泌细胞的破坏减少,胃酸、内因子及胃蛋白酶原I(PGI)分泌随之减少,通过负反馈调节机制、胃泌素分泌增加,临床上逐渐出现:伴随酸分泌减少的症状如胃排空延迟、铁吸收障碍致缺铁性贫血等较早期表现[4],伴随内因子分泌减少、维生素B12吸收障碍致巨幼细胞性贫血、周围神经病变、脊髓亚急性联合变性、精神症状等较晚期表现[5];伴随胃泌素增加的高胃泌素血症、胃多发增生性息肉、I型神经内分泌瘤(NET)、幽门腺腺瘤、黏膜下肿瘤等表现[6]。
目前AIG尚无确切治疗方法,诊疗的关键在于早期识别,及时补充叶酸、维生素B12,避免形成恶性贫血及不可逆的神经系统损伤;同时应避免使用制酸剂、适时补充消化酶、促动力药,以改善消化道相关症状;同时应长期胃镜监测,以早期筛查胃肿瘤等[7]。
专家点评
1.该病例具有代表性,反应出A型胃炎早期症状不典型、随后出现一系列并发症的过程。
2.该病例提示临床医师在遇到不典型消化系统症状,长期治疗效果欠佳,且合并其他系统症状时,应警惕该病的可能,及时完善胃镜、胃功能(包括胃泌素、PGI、PGII等)。
3.内镜医师在检查中见到以胃体底为主的黏膜萎缩表现时应考虑到该病的可能,积极活检,及时建议临床医师完善萎缩性胃炎抗体。
4.内镜医师在检查过程中见到A型胃炎的基础上有多发息肉样增生时,应高度警惕黏膜下肿瘤如NET、胃底腺型胃癌等。
参考文献
1.马欣跃,房静远,等.自身免疫性胃炎的研究进展[J].胃肠病学,2023,28(12):746-748.
2.LENTI M V, RUGGE M, LAHNER E, et al. Autoimmune gastritis[J]. Nat Rev Dis Primers, 2020, 6 (1): 56.
3.吴杨庆,周建波,方莹,等.自身免疫性胃炎患者诊断延误的危险因素分析[J].现代实用医学,2024,36(6):776-778.
4.KALKAN Ç, SOYKAN I, SOYDAL Ç, et al. Assessment of gastric emptying in patients with autoimmune gastritis[J]. Dig Dis Sci, 2016, 61 (6): 1597-1602.
5.KULNIGG-DABSCH S.Autoimmune gastritis[J]. Wien Med Wochenschr,2016,166 (13-14):424-430.
6.KAMADA T, WATANABE H, FURUTA T, et al. Diagnostic criteria and endoscopic and histological findings of autoimmune gastritis in Japan[J]. J Gastro-enterol, 2023, 58 (3): 185-195.
7.PIMENTEL-NUNES P, LIBÂNIO D, MARCOS-PINTO R, et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS Ⅱ): European Society of Gastrointestinal Endoscopy (ESGE), European Helico -bacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019[J]. Endoscopy, 2019, 51 (4): 365-388.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#A型胃炎# #胃多发息肉#
81