STTT:郑州大学韩新巍团队发表关于肿瘤转移的多阶段机制及治疗策略的研究综述
2024-10-15 iNature iNature 发表于上海
该综述强调了随着癌症进展而发生的动态和复杂的系统改变,阐明了器官特异性PMN产生的免疫学景观,加深了对转移相关治疗方式的理解。
肿瘤细胞的级联转移,表现出器官特异性倾向,可能发生在疾病的许多阶段,并在强烈的进化压力下进展。
2024年10月11日,郑州大学韩新巍团队在Signal Transduction and Targeted Therapy在线发表题为“Multi-stage mechanisms of tumor metastasis and therapeutic strategies”的综述,该综述强调了随着癌症进展而发生的动态和复杂的系统改变,阐明了器官特异性PMN产生的免疫学景观,加深了对转移相关治疗方式的理解,从而确定了一些有利于早期预测转移发生和设计适当治疗组合的预后和预测性生物标志物。
器官特异性转移依赖于转移前生态位(PMN)的形成,不同的细胞类型和复杂的细胞相互作用促成了这一概念,为传统的转移级联增加了一个新的维度。在转移扩散之前,作为PMN形成的协调者,原发肿瘤来源的细胞外囊泡为循环肿瘤细胞在远处继发部位的定居和定植提供了一个肥沃的微环境,显著影响癌症的进展和结局。显然,单纯被动干预大转移后的肿瘤转移部位往往是不够的。早期预测转移和整体宏观调控是未来肿瘤治疗的方向。

癌症转移是世界范围内一个重要的公共卫生问题,其特点是其高度可变的性质。转移是癌症患者的主要挑战,约占癌症相关死亡率的90%。尽管有广泛的研究,靶向转移播种和定植仍然是一个未解决的挑战。继续研究肿瘤细胞(TC)扩散和生长的生物学机制是必要的。
在转移期,肿瘤细胞通过淋巴和血液循环迁移,离开原发部位,最终到达远处区域,形成可见的大转移灶。肿瘤细胞开始形成原发肿瘤时,逐渐扩大并侵入周围组织和间质。在这一点上,“循环肿瘤细胞”是用来描述已经进入血液的肿瘤细胞的术语。此外,越来越多的研究表明,由于癌细胞及其改变的微环境成分之间的相互联系,癌细胞本身的内在过程并不能完全解释转移的出现。因此,只有少数具有上皮-间质转移(EMT)转移特性的CTC在脱离原发肿瘤并进入血液后存活并浸润远端器官。这些癌细胞通过各种方法增强其转移潜力,如免疫细胞和基质细胞之间的同型聚类和异型相互作用。这些机制促进了转移前生态位的形成,其他器官的成功定植,以及继发性肿瘤的发展因此,癌症的一个重要特征是它能够逃避免疫破坏。
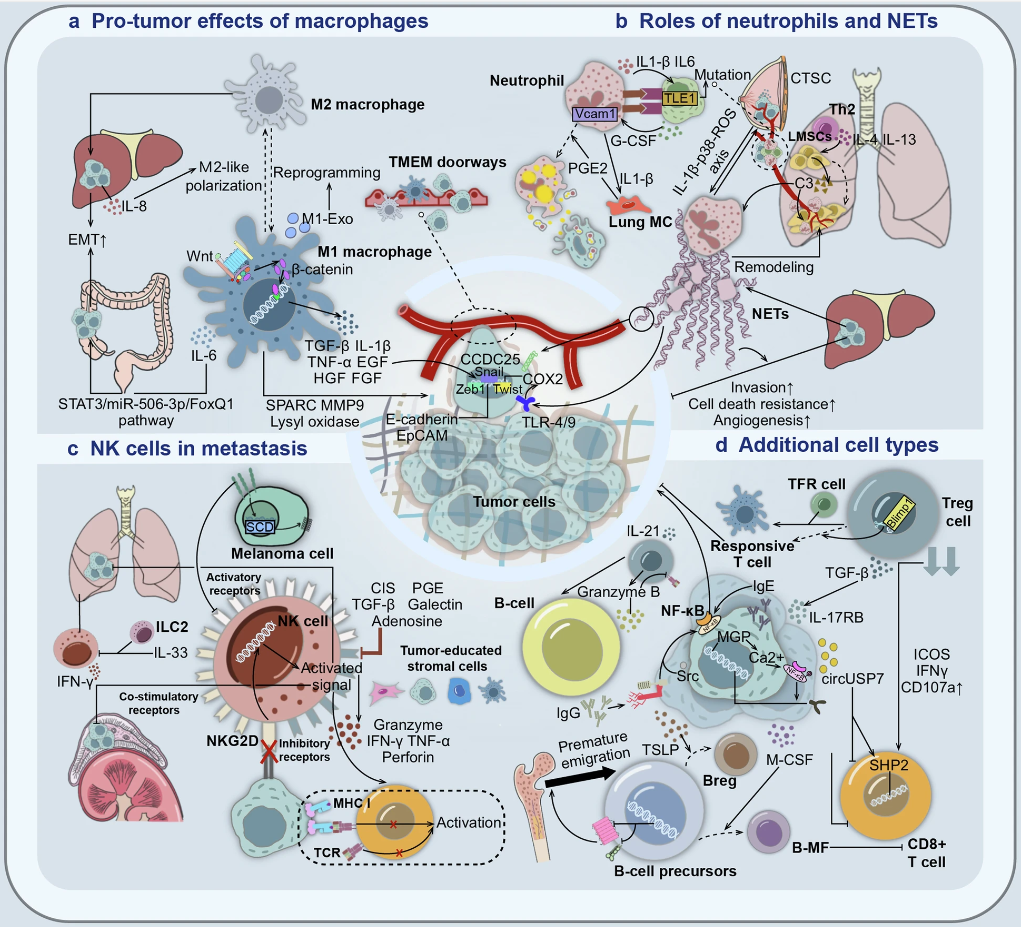
多种免疫细胞在肿瘤进展过程中发挥促肿瘤作用(图源自Signal Transduction and Targeted Therapy)
PMN是为CTCs在特定器官中寄存而准备的微环境,由独特的驻留细胞类型、细胞外基质(ECM)成分和浸润细胞群组成。细胞类型的多样性和复杂的相互作用使PMN概念化。PMN表现出血栓形成、血管通透性改变、ECM重塑和异常免疫抑制性炎症改变等关键特征。器官特异性转移的协调取决于PMN的形成,这一过程通常由细胞外囊泡(EV)引导,包括微囊泡、外泌体和从恶性细胞释放的大癌囊泡。其中,来自肿瘤的外泌体可能在血液中循环,传递炎症因子、PD-L1和其他可能抑制免疫系统的化合物,在转移前微环境中形成有利于肿瘤的免疫抑制炎症微环境。它们携带的DNA和编码或非编码RNA片段参与指导CTC的转移行为,而外泌体整合素也可能与ECM相互作用,促进随后的转移定植。
转移经常在局部和全身癌症治疗完成数年后出现。这一现象强烈表明,即使经过有效的癌症治疗,残留的癌细胞或最小残留的疾病也可以持续处于休眠状态。这种休眠使TC能够承受身体攻击并逃避免疫监视。据报道,CTC在转移过程早期通过表型、遗传和功能改变进入休眠状态。例如,EMT是一种调节癌细胞转移扩散的内在机制尽管癌症研究、诊断和治疗取得了巨大进步,但由于潜伏机制和耐药性,大多数晚期转移性疾病患者仍然无法治愈。综述了目前肿瘤治疗中存在于肿瘤进展各个阶段的潜在耐药机制。
参考消息:
https://www.nature.com/articles/s41392-024-01955-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#肿瘤细胞# #PMN#
49