黄芪多糖竟然能这样拯救化疗后的免疫系统!肠道菌群和多不饱和脂肪酸代谢大揭秘!
2024-09-04 梅斯循证中医药 MedSci原创 发表于上海
该研究证明APS能够缓解由化疗药物引起的免疫功能障碍及小鼠肠黏膜损伤,且APS对化疗小鼠的改善效果可能与其调节肠道微生物群落结构的能力相关。
肠道菌群的平衡对于维护宿主的代谢与免疫功能具有至关重要的作用。中医理论中,正气不足通常表现为身体疲劳、内脏功能紊乱、脾胃虚弱、抵抗力下降等症状。临床实践中,化疗引起的广泛不良反应,包括免疫功能的紊乱和腹泻,可归类于中医所指的正气亏损范畴。这些不良反应与肠道微生物群的失衡密切相关,而化疗药物对免疫系统和肠黏膜的损伤是化疗过程中常见的副作用。
黄芪是一种传统中药材,其主要成分包括黄芪多糖(APS)。药理学研究揭示APS具有多种生物活性,包括调节血糖与血脂水平,以及抗癌、抗衰老和免疫调节等功效。尤其是免疫调节功能显得尤为关键。近期有研究指出,APS在多种疾病模型中所展现的多维度影响,与它调节微生物群的能力密切相关。
日前,一篇名为“Astragalus polysaccharides attenuate chemotherapy-induced immune injury by modulating gut microbiota and polyunsaturated fatty acid metabolism”的文章对此进行了相关阐述。

图1 论文首页
APS可减轻5-Fu引起的免疫功能损害
为探究APS在化疗环境下的潜在免疫调节作用,该研究依据实验设计开展了初步的体内实验(图2A)。结果显示,相较于5-Fu小鼠组,接受低剂量和高剂量APS治疗的小鼠体重减轻显著较少(图2B)。胸腺和脾脏变化显示,与对照组(Con组)相比,5-Fu组的脾脏和胸腺在大小和重量等指标上明显减少,这表明5-Fu引发了免疫系统的损伤。与对照组相比,APS组的胸腺和脾脏指数有所升高,暗示APS具有逆转5-Fu引起的免疫器官萎缩的潜力(图2C、D)。
化疗对免疫系统的损害还体现在各种白细胞群的减少,从而降低了整体免疫反应能力。因此,研究测定了小鼠淋巴细胞和巨噬细胞的分化水平。以CD11b+和F4/80+作为小鼠巨噬细胞检测的标志物。结果显示,与对照组相比,5-Fu处理干扰了小鼠CD4+T细胞、CD8+T细胞、CD19+B淋巴细胞和F4/80+CD11B+巨噬细胞的分化模式(图2E、F)。但APS干预能显著改善这一现象,表明APS可以调节5-Fu引发的免疫损伤。
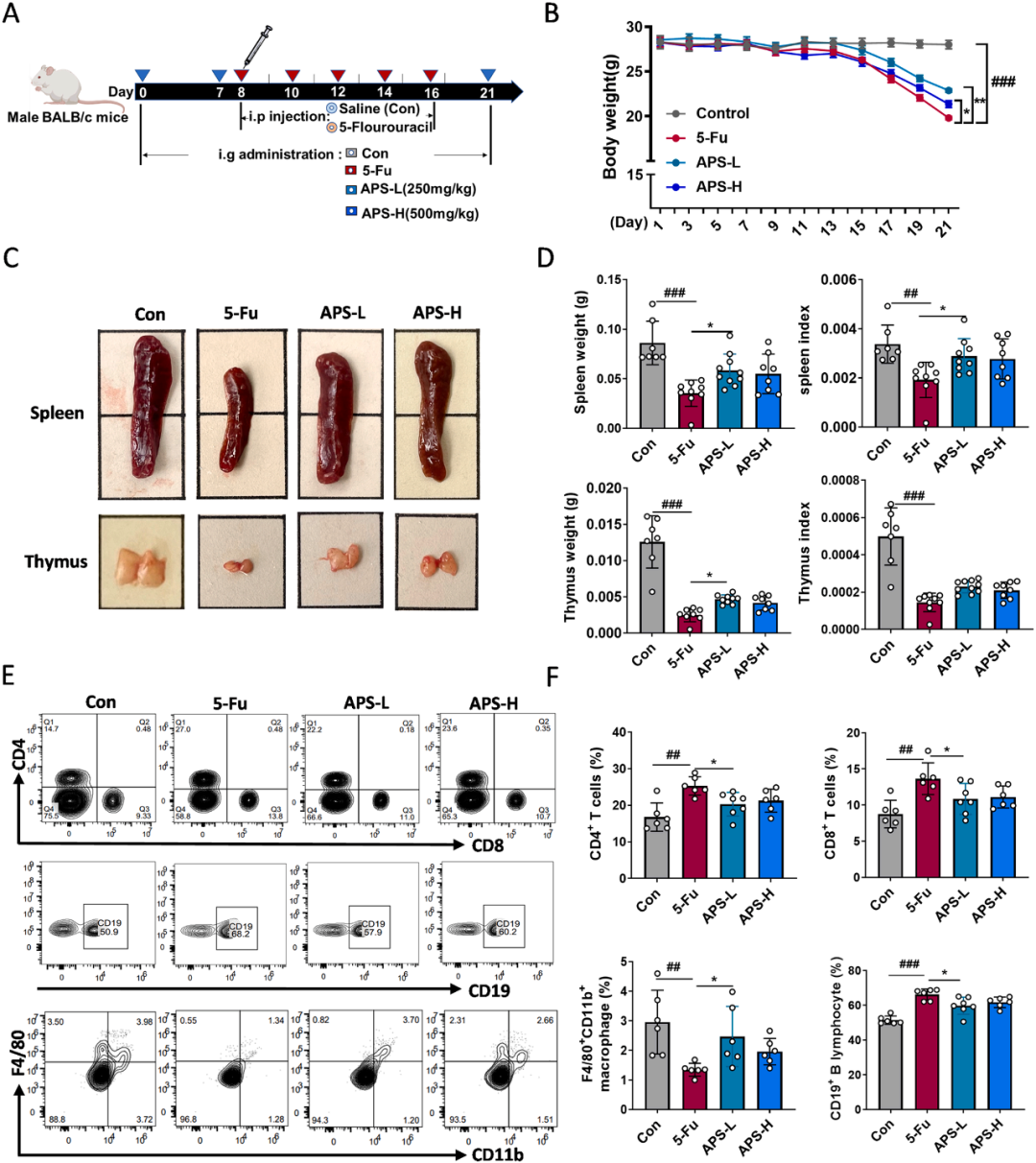
图2 APS对化疗小鼠免疫损伤的影响
APS可减轻5-FU诱导的肠黏膜损伤
研究进一步深入分析了APS在体内对5-Fu引发的肠黏膜炎的潜在作用。结果显示,APS治疗具有显著的缓解作用,能够对抗5-Fu引起的肠道长度缩短(图3A)。特别是与5-Fu组相比,APS的施用明显减轻了回肠缩短和炎症细胞的浸润现象(图3B)。阿利新蓝染色实验揭示,APS的施用与5-Fu诱导的结肠内酸性粘蛋白水平下降的缓解密切相关。为深入探究肠屏障的完整性,研究者评估了不同实验组(即对照组、5-Fu处理组和低剂量APS给药组)小鼠结肠内ZO-1和occludin mRNA的表达水平。
结果指出,与对照组相比,5-Fu处理后ZO-1和occludin的表达显著降低,而低剂量APS给药显著逆转了这一趋势(图3C)。此外,蛋白质印迹分析显示,低剂量APS给药显著提升了ZO-1、occludin和MUC2的表达,进一步强调了APS在维持肠屏障完整性方面的潜在作用(图3D, E)。由于5-Fu显著抑制了脾脏巨噬细胞的水平。因此,研究者还检测了肠道微环境中巨噬细胞的水平。结果显示,与对照组相比,5-Fu组中F4/80+和CD11b+的表达有所增加。与5-Fu组相比,APS处理降低了F4/80+和CD11b+的表达。这些结果表明APS能够调节肠道免疫微环境。
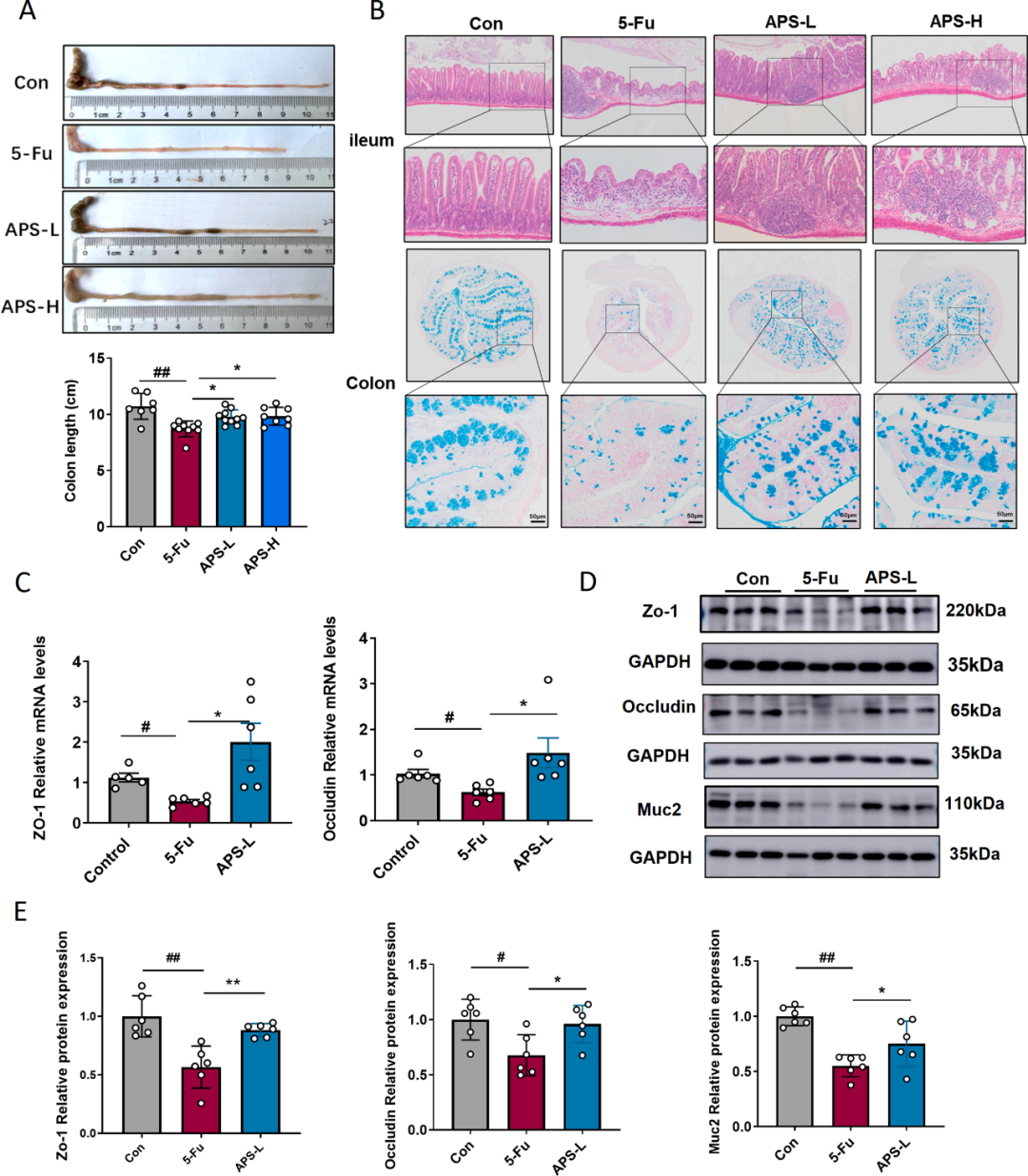
图3 APS对化疗诱导的肠黏膜损伤的影响
APS增强了体外肠道菌群的稳定性
此外,小鼠粪便样本的体外培养实验,旨在评估APS和5-Fu对微生物生长的直接作用以及微生物群落结构的后续变化。结果显示,经过12小时的APS预处理,并未导致微生物生长出现显著差异。然而,在施用5-Fu后,从12小时至24小时,5-Fu组的微生物种群生长速率明显低于对照组。相比之下,5-Fu+APS组的微生物生长速率超过了5-Fu组(图4A)。此外,在24小时时,5-Fu组的微生物丰度显著低于对照组。与5-Fu组相比,5-Fu+APS组在一定程度上缓解了微生物丰度的下降。
研究还检测了5-Fu对体外微生物群落结构的影响(图4B)。12小时时,与对照组相比,体外APS干预并未引起微生物结构组成的显著变化。然而,5-Fu处理后,5-Fu-24小时组的微生物群落结构发生了明显改变,变形菌门的丰度显著高于对照组24小时组。尽管与5-Fu-24小时组相比,5-Fu+APS-24小时组未能完全恢复至先前的厚壁菌门组成,但其在一定程度上抑制了变形菌门的丰度,使拟杆菌门成为主导(图4C)。
同时,研究对12小时和24小时时属水平PCoA变化的组间差异也进行了详细分析。5-Fu-24小时组的微生物结构与对照组24小时组的微生物结构完全分离(图4D),且5-Fu+APS-24小时组的结构与APS-24小时组并未完全分离(图4E)。结果表明,体外培养中APS维持的微生物群落增强了微生物群落生态系统的稳定性,并在一定程度上抵消了化疗药物对微生物的直接抑制作用。
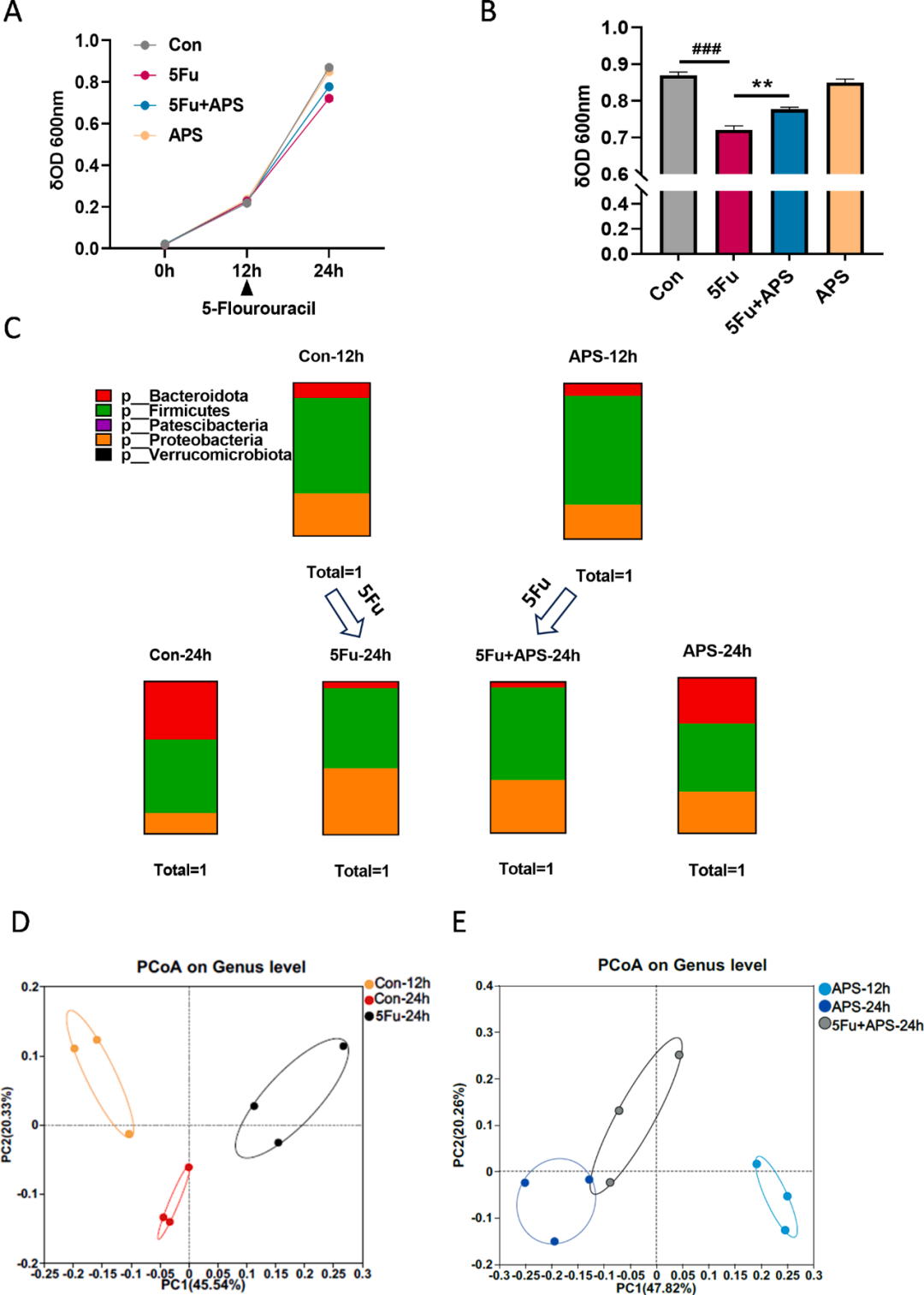
图4 APS和5-Fu对体外微生物结构的影响
APS对免疫功能和肠道完整性的益处依赖于肠道菌群
为深入阐释APS与肠道微生物群在缓解5-Fu诱导的小鼠效应中的复杂相互作用(图5A),研究将APS处理的小鼠或正常饮食小鼠的肠道细菌移植至5-Fu处理的小鼠体内。相较于ABX-5-Fu组,源自正常小鼠(FMT-Con)和APS治疗小鼠(FMT-APS)的粪便微生物群移植(FMT)均有助于促进5-Fu处理小鼠体重的恢复,其中FMT-APS组相较于FMT-Con组展现了更为显著的恢复效果(图5B)。此外,FMT-Con和FMT-APS在一定程度上改善了5-Fu引起的免疫器官萎缩,FMT-APS组相较于FMT-Con组表现出更为显著的免疫器官恢复(5C, D)。
严格而言,细胞表面标记物CD86+或CD206的高表达分别指示巨噬细胞趋向于M1或M2极化。因此,研究进一步探讨了5-Fu和APS干预肠道细菌对体内M1(F4/80+CD11b+CD86+)/M2(F4/80+CD11b+CD206+)细胞分化的影响。与对照组相比,ABX-5-Fu组显示出F4/80+CD11b+CD86+细胞分化显著上调,同时F4/80+CD11b+CD206+细胞分化显著下调(图5E、F),且源自APS小鼠的FMT(FMT-APS)部分缓解了细胞分化的这种改变。此外,该研究评估了实验组粪便形态和结肠长度的恢复趋势(图5G-I)。与FMT-5Fu组相比,APS处理小鼠的FMT(FMT-APS)在一定程度上促进了粪便形态和结肠长度的恢复。
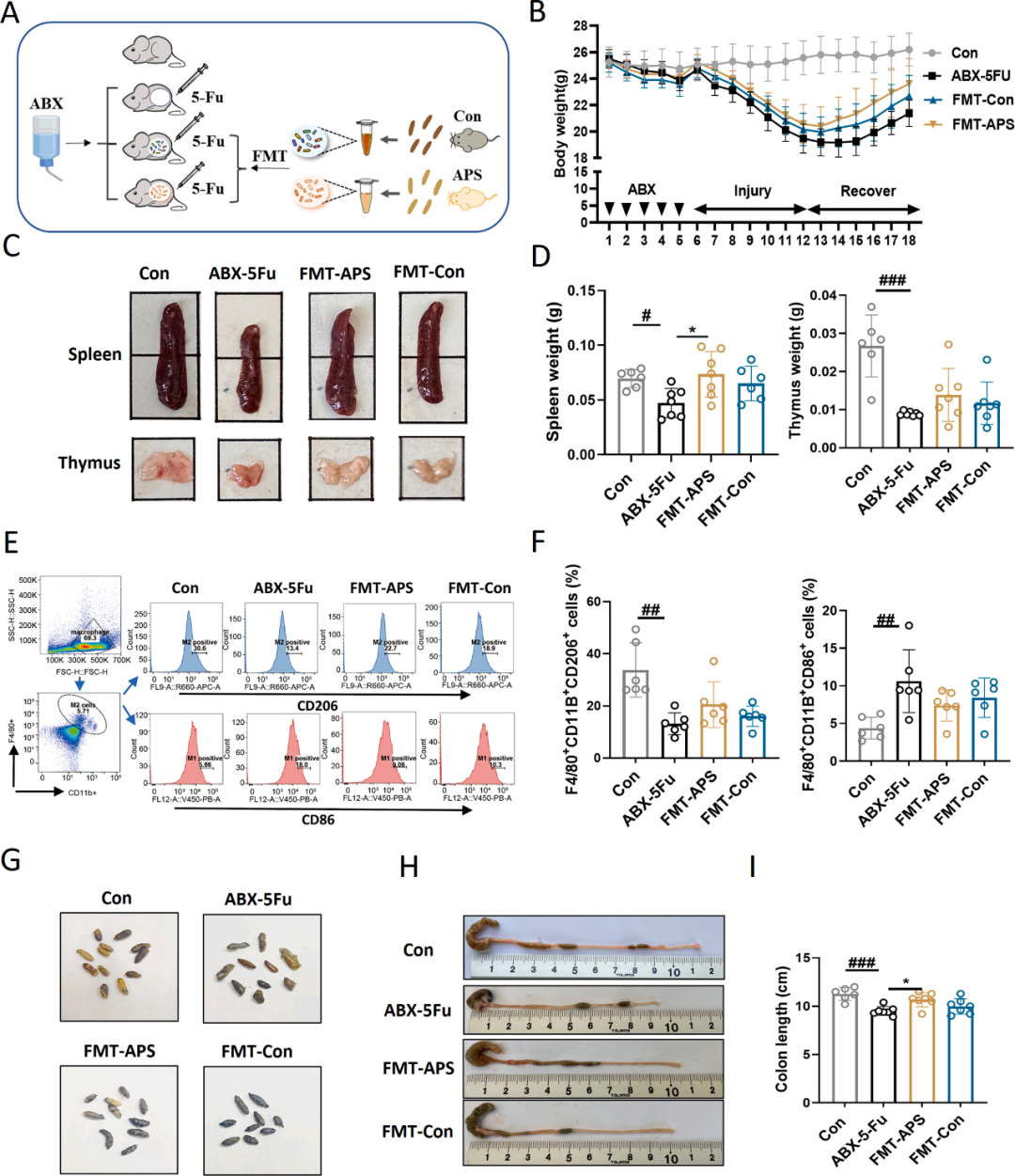
图5 APS调节的肠道菌群有助于5-Fu诱导的小鼠免疫功能和肠道恢复
结论
该研究证明APS能够缓解由化疗药物引起的免疫功能障碍及小鼠肠黏膜损伤,且APS对化疗小鼠的改善效果可能与其调节肠道微生物群落结构的能力相关,为APS作为缓解化疗导致的免疫损伤的有效手段提供了坚实的理论支撑。
参考文献:
Wang H, Zhu W, Hong Y, Wei W, Zheng N, He X, Bao Y, Gao X, Huang W, Sheng L, Li M, Li H. Astragalus polysaccharides attenuate chemotherapy-induced immune injury by modulating gut microbiota and polyunsaturated fatty acid metabolism. Phytomedicine. 2024 Jun;128:155492. doi: 10.1016/j.phymed.2024.155492
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肠道菌群# #黄芪多糖#
66