盘点:基因编辑新突破,或许基因编辑技术才刚刚开始
2017-02-27 MedSci MedSci原创
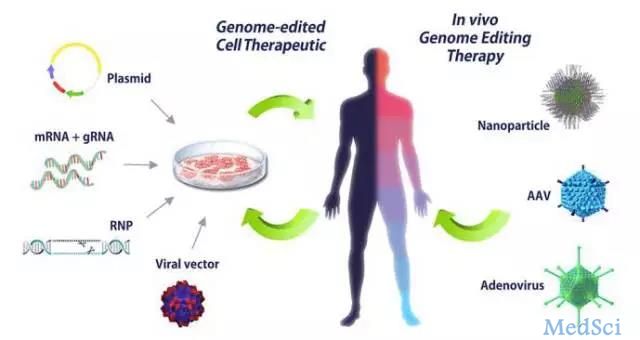
日前,科学家已经开发出一种新的方法来修复遗传性免疫缺陷病症——X 连锁慢性肉芽肿病(X-CGD)患者造血干细胞中的缺陷基因。科学家将修复的干细胞移植到小鼠体内,这些干细胞会发育成具有正常功能的白细胞,这也证明可以使用这一方法治疗患有 X-CGD 疾病的患者。科学家计划进行下一步的研究,最终目标是希望将这一方法用于 X-CGD 患者的临床治疗之中。与此同时,他们还表示这种基因编辑方法也适用于由单
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#新突破#
34
#基因编辑技术#
32