【论著】| Monaco放疗计划系统的金标准射束模型临床应用可行性分析
2023-09-17 中国癌症杂志 中国癌症杂志 发表于上海
基于GBD的Monaco TPS建模流程,较传统加速器从安装到验收流程而言,在保证模型精度的同时,整个流程时间缩短,具有临床应用可行性。
[摘要] 背景与目的:“快速验收流程”(accelerated go live,AGL)是医科达加速器从安装、调试、建模到放疗实施的整个管理流程。该流程是基于医科达上千台加速器大数据而建立的一套金标准射束模型,较传统繁琐耗时的加速器验收步骤而言,在数据采集和射束建模阶段得到很大程度优化。本研究旨在评估基于金标准射束数据(gold beam data,GBD)的Monaco放疗计划系统(treatment planning system,TPS)建模临床应用可行性。方法:基于复旦大学附属肿瘤医院放射治疗中心安装的两台Elekta Infinity™直线加速器,按照AGL与GBD进行调试和射束建模。然后,利用三维水箱对百分深度剂量(percentage depth dose,PDD)、离轴剂量分布曲线(profile)和开野(open filed,OF)点剂量进行客户验收测试(customer acceptance tests,CAT)和射束模型验证,并利用16例不同部位临床病例进行放疗计划设计、测量及剂量分析,进一步测试和验证射束模型精确度。结果:对于射束模型的误差分析发现,所有PDD和profile的一致性均大于90%,其中加速器1和加速器2点通过率大于95%的比例(以GBD为参考)分别为99.4%和98.5%。对于点剂量验证,96.8%和97.2%的OF点剂量测量结果与加速器1和加速器2的TPS计算结果的一致性均在2%以内。对于电子束模型,TPS计算结果与实测值的R50和R90偏差均在3 mm以内。当使用3%/3 mm标准时,16例临床放疗计划的Gamma通过率都大于90%,点剂量一致性在3%以内。结论:基于GBD的Monaco TPS建模流程,较传统加速器从安装到验收流程而言,在保证模型精度的同时,整个流程时间缩短,具有临床应用可行性。
[关键词] 金标准射束模型;加速器验收;放疗计划系统
[Abstract] Background and purpose: Accelerated go live (AGL) is the entire management process for medical accelerators from installation, commissioning, modeling to radiotherapy implementation. Compared with the traditional time-consuming accelerator acceptance process, AGL has established a set of gold standard models based on the big data of thousands of medical accelerators, which makes the accelerator installation greatly optimized in the data acquisition and modeling stage. This study aimed to evaluate and verify an efficient beam modeling method for Monaco treatment planning system (TPS) using golden beam data (GBD). Methods: Two Elekta Infinity™ linear accelerators with agility head in the Department of Radiation Oncology, Fudan University Shanghai Cancer Center, were installed and matched with the GBD. Then, a customer acceptance test (CAT) and beam model validations were performed on measured percentage depth dose (PDD) and profile for open-field (OF) point-doses in a three-dimensional water tank. Furthermore, a total of 16 clinical cases from different sites were used for radiotherapy planning design, measurement and dose analysis to validate and verify the accuracy of the beam model. Results: For beam model verification, the agreement of all validation PDD and profile was larger than 90%, and the majority point passing rate was larger than 95% (99.4% for linac 1 and 98.5% for linac 2). For point-dose validation, 96.8% and 97.2% of OF point measured were found to be within 2% agreement of TPS-calculations for linac 1 and linac 2, respectively. The deviation of R50 and R90 between TPS calculation and measured were within 3 mm at all evaluated points of electron beam. The Gamma passing rate for all plans was greater than 90% when using 3%/3 mm criteria, and point-dose agreement was within 3%. Conclusion: Compared with the traditional accelerator process from installation to commission, the Monaco TPS modeling process AGL based on GBD can not only ensure the model accuracy, but also shorten the entire process time, which has the feasibility of clinical application.
[Key words] Golden beam model; Accelerator acceptance; Treatment planning system
肿瘤放疗因其无创伤的治疗方式以及高治愈率、低不良反应等优势,已成为治疗恶性肿瘤不可或缺的重要手段[1]。放疗计划系统(treatment planning system,TPS)剂量计算的准确性是保证肿瘤放疗效果的基础,而TPS中,射束模型的质量是影响剂量分布计算精度的重要因素之一。射束建模是采集直线加速器的百分深度剂量(percentage depth dose,PDD)和离轴剂量分布曲线等数据集,并导入TPS进行建模。该建模是一个迭代过程,以保证最小化计算剂量分布与TPS中用于射束建模的数据之间的差异。射束模型的质量和所使用的射束数据集是决定TPS中计算剂量分布准确性的重要因素。
目前,许多大型综合癌症治疗中心都配备了来自同一生产商的两台或多台直线加速器。通常,直线加速器由于型号或安装的差异都具有独特的剂量学特性。因此,在临床使用之前,大约需要8周时间来收集大量的剂量和非剂量输入参数,并对每台机器及其相应的射束能量进行单独调试,以在TPS中建立一个最优的与直线加速器输出一致的射束模型[2-4]。为了简化多台来自相同厂商的模型数据的采集及加速器调试,在加速器安装及射束模型验收时,会通过射束匹配(beam matching,BM)来将新安装的加速器与已经验收好的加速器模型进行匹配。使用BM方法,TPS的剂量学相关数据采集可以显著减少[5]。同时,当加速器发生故障时,患者可以从一台机器转移到另一台进行BM的机器,而无需修改或重新设计放疗计划方案,提升放疗治疗灵活性。多项研究[5-7]表明,直线加速器的BM能很好地保证直线加速器的稳定和剂量的精确。然而,这种方法最主要的问题是,供应商之间的BM验收标准不同,会导致即使匹配良好,仍然不能保证加速器射束模型的剂量计算精度[8-9]。
近年来几项研究[10-11]表明,利用金标准射束数据(gold beam data,GBD)对医用直线加速器进行建模,加速器的射束数据差异几乎都在1%或2%以内。在抽查中可以发现许多机构GBD和测量数据集(measure beam data,MBD)之间一致性可以接受,但在临床情况下,射束数据的微小差异可能会产生不可接受的结果。有鉴于此,Elekta™(瑞典Elekta公司)提出加速器“快速验收流程”(accelerated go live,AGL)。该流程基于GBD对直线加速器的射束模型进行数据采集、调试和建模,较传统繁琐耗时的加速器验收步骤而言,在数据采集和射束建模阶段得到很大程度优化,同时可以大大提高Monaco TPS射束建模的精度。本研究基于复旦大学附属肿瘤医院放射治疗中心安装的两台Elekta Infinity™直线加速器,利用GBD进行射束建模,分析MBD和GBD之间的差异,并比较两台加速器调强放疗计划剂量学影响。在此基础上,验证和讨论采用GBD代替机构MBD进行射束建模的可行性。
1 材料和方法
1.1 临床资料
本研究基于复旦大学附属肿瘤医院安装的两台Elekta Infinity™直线加速器,该加速器配备了Agility机头(80对5 mm叶宽的多叶准直器)和X线容积影像(X-ray volume imaging,XVI),其中XVI包含锥形束计算机体层成像(computed tomography,CT)和iView GTTM门控成像。这两台机器有标称能量为6 MV(带扁平滤波器)、6 MV FFF(无6 MV扁平滤波器)和10 MV(带扁平滤波器)的双光子束,以及4个标称能量为6、9、12和15 MeV的电子束。本研究使用的Monaco TPS版本为5.11.03。
1.2 AGL
AGL是一个标准化的加速器安装、调试、建模到放疗实施的整个管理流程。该流程是基于医科达(上海)医疗器械有限公司上千台高端加速器大数据得出的一套标准GBD和模型,且调试过程是按照高于传统厂标近一个数量级的标准进行的调试。AGL工作流程如图1所示。在每台机器安装后与Elekta建模团队提供的GBD相匹配。然后,执行客户验收测试(customer acceptance tests,CAT),包括常规加速器验收测试[机械测试,X线容积影像(X-ray volume imaging,XVI),电子射野影像装置(electronic portal imaging device,EPID)治疗床验收]和AGL CAT。附加AGL CAT测试的目的是证明机器与AGL参考数据集匹配。包括射束均匀性测试、射束穿透质量测试和楔形因子测试。与此同时,依据GBD生成各个能量的蒙卡算法模型。
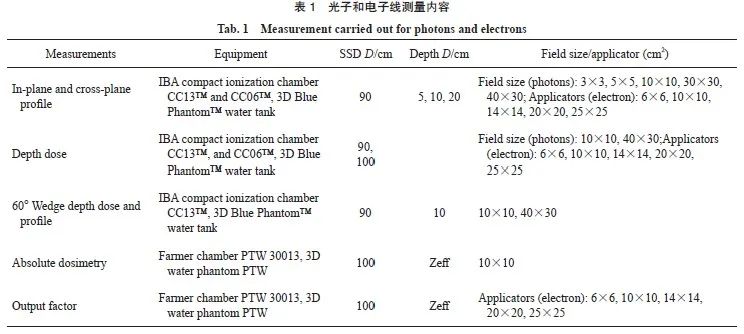
为了分析MBD与GBD的差异,对已经调试好的直线加速器进行数据采集。测量包括射束profile、PDD、绝对点剂量和输出因子,如表1所示。在采集数据基础上,使用Monaco调试实用程序(Monaco commissioning utility,MCU)模块对光子和电子测量数据进行Gamma分析。此外,光子射束模型通过比较测量数据和TPS 6 MV和6 MV FFF计算数据在不同源皮距(source-skin distance,SSD)(90、100和110 cm)的矩形和不规则场中心轴(central axis,CAX)和离轴上的差异。对于电子射束模型,通过将测量数据与TPS计算值进行比较,评估在SSD为110 cm下不同尺寸限光筒的输出因子。
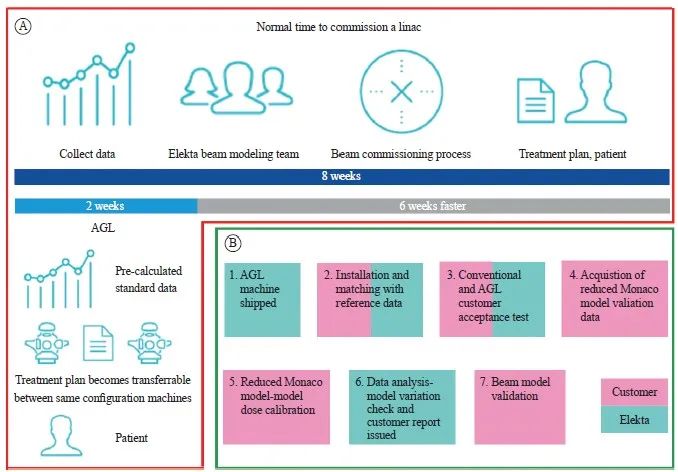
图1 常规直线加速器和AGL方案验收时间对比及AGL工作流程
Fig. 1 Timeline at glance of normal time to commission a linac and AGL and the workflow of AGL
A: Time comparison; B: Workflow of AGL.
1.3 临床病例
在直线加速器临床使用前,我们按照临床放疗计划设计标准,选取复旦大学附属肿瘤医院2020年9月—2021年2月收治的16例不同部位(头颈部肿瘤、乳腺癌、肺癌、直肠癌)患者进行调强适形放疗(intensity-modulated radiation therapy,IMRT)和容积调强放疗(volumetric-modulated arc therapy,VMAT)放疗计划设计及测量结果分析。计划由Monaco TPS使用3 mm×3 mm×3 mm剂量计算网格,蒙卡算法计算的统计不确定度为1%。
16例患者处方及射野具体信息如下:
⑴ 4例Ⅲ~ⅣA期头颈部癌症患者的处方剂量为70.4 Gy(2.2 Gy×32分次),所有患者放疗计划为9个射野。
⑵ 4例T2N2M0分期乳腺癌患者的总剂量为50 Gy(2 Gy×25分次),9个切线野。
⑶ 4例Ⅲ期非小细胞肺癌患者5~9个射野,总剂量为60 Gy(2 Gy×30分次);
⑷ 4例淋巴结阳性(Ⅲ期)直肠癌患者,放疗计划为7~9个射野,靶区处方剂量为50 Gy(2 Gy×25分次)。
对于每个案例,使用6 MV和6 MV FFF创建2个IMRT和2个VMAT计划。Gamma分析使用Delta4(Scandidos AB)QA系统进行,采用TG-218推荐的3%/3 mm标准。
2 结 果
2.1 CAT
CAT由常规机械方面测试和AGL CAT两部分组成。常规验收根据TG-157报告对所有数据进行测量和分析,该部分验收包括等中心精度、治疗床、XVI、iView GT、射线性质及准直系统等一系列精度的测试和验收。并在临床使用前进行加速器绝对剂量、射野平坦度、多叶光栅到位精度等与TPS计划系统的匹配情况进行测试,结果已经满足验收要求。本文结果部分只对AGL CAT测试结果进行展示。
2.1.1 X射束一致性结果
X射束profile是一组测量点和相对剂量的比值。相对剂量是指某一点的剂量与沿射束轴线的剂量之比。图2显示了3种不同深度(5、10和15 cm)下的测量值与参考值的偏差。从数据中可以看出,所有值偏差都在±1%范围内。
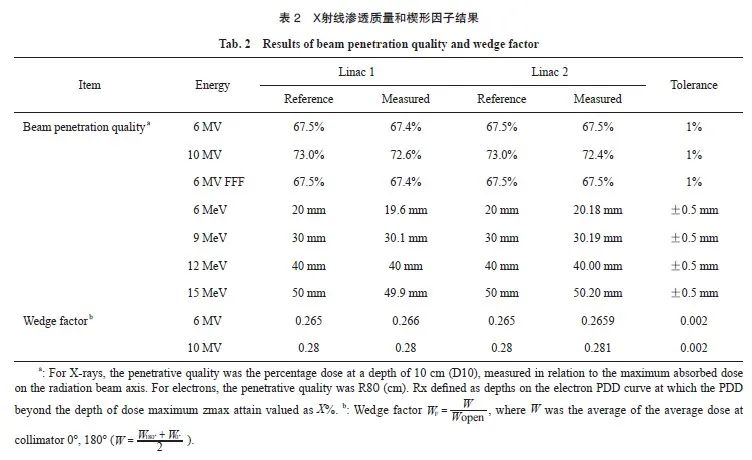
2.1.2 渗透质量和楔形因子结果
X射线和电子线渗透质量(penetration quality,PQ)结果见表2。结果显示,所有值的偏差小于容差(X射线为1%,电子为0.05 mm)。
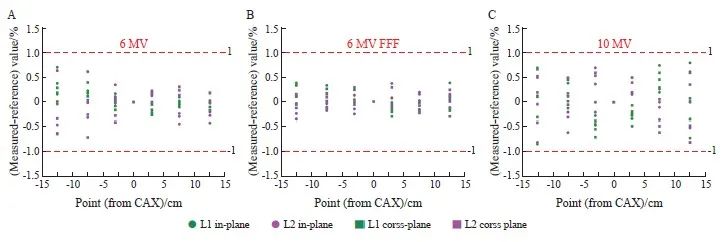
图2 不同量能在不同深度、射野尺寸的测量值与参考值
Fig. 2 Measurement and reference values of different quantities at different depths and field sizes
A: 6 MV; B: 6 MV FFF; C 10 MV. All were measured at 3 depths (5, 10 and 20 cm) with a field size of 30 cm × 30 cm. The green and magenta color represent the data of linac 1 and linac 2, respectively. The deviations valued in in-plane and cross-plane were depicted in solid dots and squares.
2.2 射束模型验证
2.2.1 Profile验证结果
直线加速器1的测量值、计算和参考PDD与profile数据之间的Gamma分析结果见图3。除了直线加速器2的3 cm×3 cm射野,其他所有测量的PDD与profile的一致性均大于90%,多数点通过率(以GBD为参考)均大于95%(直线加速器1和直线加速器2分别为99.4%和98.5%)。
2.2.2 开野(open field,OF)点剂量和输出因子结果
对两个直线加速器模型进行了OF剂量测量点剂量验证。两台机器的两个光子能量(6 MV和6 MV FFF)总共评估了508个点。在所有数据中,直线加速器1和直线加速器2的OF点剂量分别96.8%和97.2%,满足Medical Physics Practice Guideline 5a[12]中推荐的2%误差范围。对这两个模型也进行了楔形场点剂量验证,除远离CAX的两个点外,所有计算剂量与测量值的误差都在2.0%以内。
TPS计算和测量之间的R50和R90的偏差在所有评估点(80点)上都在3 mm以内,对于四档电子能量97.5%的测量在2 mm以内。当射野尺寸大于6 cm×6 cm,由计算剂量得出的输出因子对于所有能量和限光筒偏差都在3%以内。而对于6 cm×6 cm的射野尺寸,最大偏差高达3.8%。
2.2.3 计划验证结果
放疗计划验证结果见图4。在3%和3 mm的TPS计算和Delta 4测量之间进行Gamma分析,所有方案的通过率均超过90%。所有计划的点剂量差异都在3%以内。
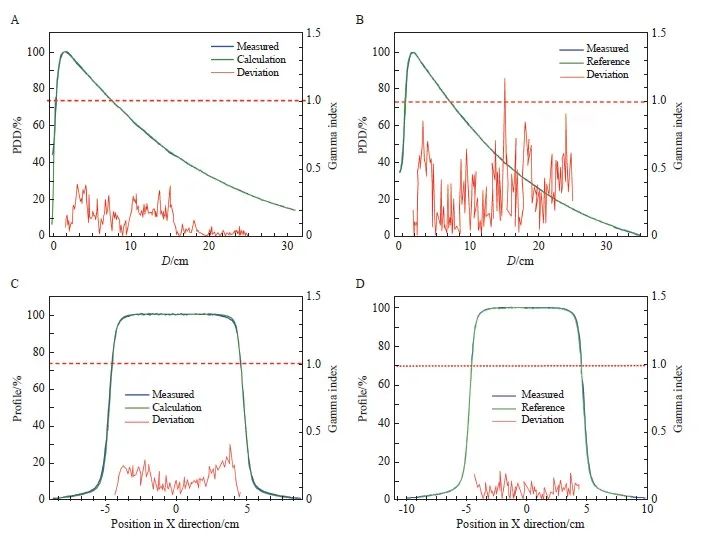
图3 加速器1的测量数据与TPS计算数据之间的Gamma分析
Fig. 3 Gamma analysis between measurement data of accelerator 1 and TPS calculation data
A: 6 MV, open, SSD was 90 cm, 10×10 cm, Z profile was 100.0% passed; B: 6 MV, open, SSD was 90 cm, 10×10 cm, Z profile was 99.6% passed; C: 6 MV, open, SSD was 90 cm, 10×10 cm, X profile, depth was 5 cm, was 100.0% passed; D: 6 MV, open, SSD 90 cm, 10×10 cm, X profile, depth was 5 cm, was 100.0% passed
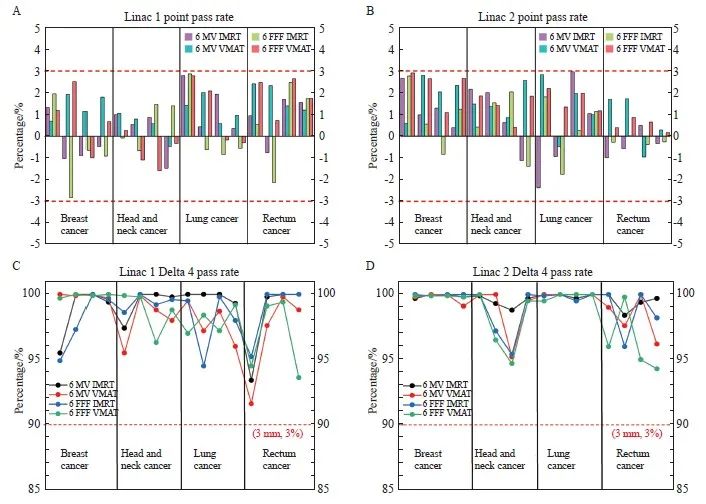
图4 IMRT/VMAT计划测量结果
Fig. 4 IMRT/VMAT plan measurement results
A: Point dose pass rate for linac 1; B: Point dose pass rate for linac 2; c: Delta 4 measurements pass rate for linac 1; D: Delta 4 measurements pass rate for linac 2.
3 讨 论
由于直线加速器在治疗过程中发生故障的原因不可预测,因此提高癌症治疗中心多台相同厂商加速器的剂量学一致性变得十分关键,这将提升放疗中心内部放疗计划的灵活性,并将对停机时间和对患者治疗效果的影响降低到最少。为了实现这一目标,之前研究[13-14]通过将每台机器及其射束能量进行BM。在BM过程中,一方面,模型剂量学精度在调试过程中无法得到保证;另一方面,不同机器供应商定义的BM标准是不同的。这两种偏差可能相互叠加,使得实际剂量和计算剂量偏差更大。
为了克服这些缺点,可以用GBD对几个同型号直线加速器进行BM,并确保计算和实际照射剂量之间的偏差在可接受的范围内。最近研究[10-11]表明,利用GBD对医用直线加速器进行建模,加速器的射束数据的差异几乎都在1%或2%以内。Chang等[11]的研究结果表明,三台TrueBeam直线加速器(美国Varian 公司)的PDD和profile平均标准偏差分别在0.2%和0.5%以内。Tanaka等[10]的研究结果也表明,对于21台TrueBeam直线加速器,PDD和profile的最大平均标准偏差分别为0.8%和2.3%。由于GBD射束数据变化小,GBD可以作为MBD的替代品,能加快直线加速器的数据采集及射束建模。然而,在使用GBD进行射束建模时,最重要的问题不是GBD和MBD的一致性是否在1%以内,而是射束建模数据集差异导致计算的剂量分布的偏差。
当用于射束建模的两个射束数据集的一致性在1%以内时,射束模型和计算的剂量分布是否相同还没有得到证明。基于此,本文论证了基于GBD的AGL的可行性。相对于传统加速器的验收时间(8周)[15],该方法可大大减少射束数据采集和建模时间(约6周)。此外,从射束模型差异分析结果来看,所有能量的PDD与profile一致性均大于90%,多数点通过率大于95%。对于点剂量验证,96.8%和97.2%的OF点剂量与加速器1和加速器2的TPS计算值的一致性分别在2%以内。对于电子能量,TPS计算的R50和R90与测量值的偏差均在3 mm以内。对于临床计划的Gamma分析可知,当采用3%/3 mm标准时,所有方案的Gamma通过率均大于90%,点剂量则在3%以内。
Profile验证结果显示,X射线一致性差异小,仅1个3 cm×3 cm小野profile和PDD的一致性低于90%。造成小野数据一致性偏差较大的原因是在数据采集过程中,探头的体积相对于小野面积较大,影响小野剂量分布。对于OF点剂量和输出因子验证也可以观察到相似的结果,在最小野(6 cm×6 cm)测量中,测量和计算的剂量值得出的输出因子偏差高达3.8%。同时受限于现有测量设备低剂量区域测量精度的影响,在两个机器射束模型远离CAX的点相对于模型计算剂量偏差大于2.0%。
为了进一步验证基于GBD建模的有效性,选取16例不同部位患者进行模型计算和测量差异分析。结果显示,两台加速器点剂量和Delta 4面剂量的通过率都在临床可接受的范围内(图4)。但直线加速器1和直线加速器2的通过率略有差异。首先,尽管这两台机器使用GBD进行调试和建模,但仍然很难确保每台直线加速器具有相同的射束特性。第二,通过率的测量受到人为因素的影响。在测量两台机器输出剂量的过程中,人为操作会引入随机误差,很难保证设置和测量的一致性。
与传统直线加速器验收时间相比,基于GBD的射束模型建模从数据收集和建模的时间总体上缩短了3/4,流程明显优化,特别是在数据采集和建模阶段。基于GBD的建模可以显著简化直线加速器的调试步骤,节省时间和人力,并提高模型精度和准确性;此外,还可以将加速器因故障停机对医院的干扰最小化,能保障癌症患者放疗的连续性,真正实现患者治疗过程中加速器互换。本研究也存在不足之处,文中只对本中心两台直线加速器验收的数据进行了分析,今后我们将进行多中心验收数据的分析和比较,进一步证明基于GBD的射束模型建模方法的高效性和准确性。
综上所述,本研究证实基于GBD进行医用直线加速器建模和验收方法可以简化建模流程和减少Monaco TPS射束建模中数据采集的潜在误差。在不影响模型调精度的同时,与传统加速器验收流程相比,可以减少70%的射束数据采集和建模时间。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] D'SOUZA D P, RUMBLE R B, FYLES A, et al. Intensitymodulated radiotherapy in the treatment of gynaecological cancers[J]. Clin Oncol, 2012, 24(7): 499-507.
[2] KERNS J R, FOLLOWILL D S, LOWENSTEIN J, et al. Reference dosimetry data and modeling challenges for Elekta accelerators based on IROC-Houston site visit data[J]. Med Phys, 2018, 45(5): 2337-2344.
[3] 曾华驱, 汤树奎, 曹剑云, 等. 医用直线加速器的验收和射束基准数据测量[J]. 中国医疗设备, 2022, 37(6): 53-57.
ZENG H Q, TANG S K, CAO J Y, et al. Acceptance and beam reference data measurement of medical linear accelerator[J]. China Med Devices, 2022, 37(6): 53-57.
[4] MA C M C, CHETTY I J, DENG J, et al. Beam modeling and beam model commissioning for Monte Carlo dose calculationbased radiation therapy treatment planning: report of AAPM Task Group 157[J]. Med Phys, 2020, 47(1): e1-e18.
[5] BHANGLE J R, NARAYANAN V K, KUMAR N K, et al. Dosimetric analysis of beam-matching procedure of two similar linear accelerators[J]. J Med Phys, 2011, 36(3): 176-180.
[6] GLENN M C, PETERSON C B, FOLLOWILL D S, et al. Reference dataset of users’ photon beam modeling parameters for the Eclipse, Pinnacle, and RayStation treatment planning systems[J]. Med Phys, 2020, 47(1): 282-288.
[7] XU Z Z, WARRELL G, LEE S, et al. Assessment of beammatched linacs quality/accuracy for interchanging SBRT or SRT patient using VMAT without replanning[J]. J Appl Clin Med Phys, 2019, 20(1): 68-75.
[8] SJÖSTRÖM D, BJELKENGREN U, OTTOSSON W, et al. A beam-matching concept for medical linear accelerators[J]. Acta Oncol, 2009, 48(2): 192-200.
[9] VENSELAAR J, WELLEWEERD H, MIJNHEER B. Tolerances for the accuracy of photon beam dose calculations of treatment planning systems[J]. Radiother Oncol, 2001, 60(2): 191-201.
[10] TANAKA Y, MIZUNO H, AKINO Y, et al. Do the representative beam data for TrueBeam™ linear accelerators represent average data? [J]. J Appl Clin Med Phys, 2019, 20(2): 51-62.
[11] CHANG Z, WU Q W, ADAMSON J, et al. Commissioning and dosimetric characteristics of TrueBeam system: composite data of three TrueBeam machines[J]. Med Phys, 2012, 39(11): 6981-7018.
[12] SMILOWITZ J B, DAS I J, FEYGELMAN V, et al. AAPM medical physics practice guideline 5.a.: commissioning and QA of treatment planning dose calculations-megavoltage photon and electron beams[J]. J Appl Clin Med Phys, 2015, 16(5): 14-34.
[13] SARKAR B, MANIKANDAN A, NANDY M, et al. A mathematical approach to beam matching[J]. Br J Radiol, 2013, 86(1031): 20130238.
[14] 肖 青, 李光俊, 张祥斌, 等. 统计过程控制在医用电子直线加速器射束匹配性能评估中的应用研究[J]. 中国医疗器械杂志, 2021, 45(1): 109-113.
XIAO Q, LI G J, ZHANG X B, et al. Application of statistical process control in evaluation of performance for beam-matched medical electron linacs[J]. Chin J Med Instrum, 2021, 45(1): 109-113.
[15] GLIDE-HURST C, BELLON M, FOSTER R, et al. Commissioning of the Varian TrueBeam linear accelerator: a multi-institutional study[J]. Med Phys, 2013, 40(3): 031719.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







