方案与建议|重症医学相关精神障碍药物合理使用专家共识
2024-11-09 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于上海
共识阐述了重症医学相关精神障碍药物规范化使用的原则、流程,以及各类精神科药物使用的临床指征、注意事项、具体药物选择,为精神科药物在重症医学科的临床应用提供可行性建议和指引。
摘 要 重症医学相关治疗是一个跨学科、多专业合作的过程,在临床实践中常出现继发或合并精神障碍的情况,相关药物治疗国内目前尚无共识,中华医学会心身医学分会心身重症协作组联合重症医学专家成立共识编写专家组,通过系统回顾相关文献,总结已发表的国内外文献,反复讨论制定本共识,共识阐述了重症医学相关精神障碍药物规范化使用的原则、流程,以及各类精神科药物使用的临床指征、注意事项、具体药物选择,为精神科药物在重症医学科的临床应用提供可行性建议和指引。
关键词
重症医学;精神障碍;谵妄;抑郁;焦虑;专家共识
重症医学是负责急危重症患者的抢救和延续性生命支持的临床学科,为发生多器官功能障碍的患者提供治疗、器官功能支持和多脏器功能障碍综合征的防治。每年有数以百万计的患者罹患危及生命的疾病并经历令人不安的重症监护室(intensive care unit,ICU)治疗过程,在这种情况下常常会出现精神心理问题[1],甚至是出现严重精神行为障碍,如谵妄、焦虑障碍、抑郁障碍、激越、自伤和自杀行为等,这些均需要精神科药物及心理治疗的及时介入[2]。在患者经历ICU治疗、危重症缓解后,还可能出现精神健康和身体机能方面的障碍,即ICU后综合征(post-intensive care syndrome, PICS),其中主要的精神心理障碍包括长期认知障碍(20%)、抑郁症(约30%)、焦虑症(35%~70%)和创伤后应激障碍(约20%~30%)[3-4],这些精神障碍临床表现各异,严重程度可以从轻微到威胁生命安全。除了以上精神障碍外,还需要关注患者是否存在其他影响医疗情况的心理因素,例如患者在没有任何精神障碍的情况下表现出显著的易激惹或对治疗的不依从。与非ICU住院患者相比,ICU住院患者在出院后5年内精神障碍的患病率和精神科药物的使用显著增加[5]。
重症医学相关治疗是一个跨学科、多专业合作的过程,但精神心理科的介入却常常被忽视。目前国内尚无重症相关精神障碍药物治疗的规范或指南,因此制定符合临床实践特点的专家共识十分必要。重症医学科医生在临床实践中经常面临与精神障碍相关的复杂情况,需要综合考虑患者的躯体情况、生命支持系统以及内科用药等多个因素,本专家共识能为其提供有效的指导和共识,以便更好地处理这些情况。当患者出现精神障碍时,建议使用《国际疾病与相关健康问题统计分类第11版》(International Statistical Classification of Diseases and Related Health Problems, 11th version, ICD-11)作为诊断标准。当患者出现严重的精神病性症状、自伤自杀或伤人毁物风险时,建议尽快请精神科医师会诊协助诊疗。当患者出现满足诊断标准的临床综合征,可视临床需要,根据本专家共识选择精神科药物进行治疗。
中华医学会心身医学分会心身重症医学学组通过检索PubMed、EMBase、Web of knowledge、中国知网、万方、维普及中国生物医学文献数据库,并广泛征求精神科、心身医学以及重症医学专家的意见,根据循证医学证据与推荐等级对证据质量和推荐强度进行评估(表1与表2),最终经过学组讨论确定本专家共识以供临床参考[6-7]。
表1 循证医学证据等级及说明(参照GRADE系统)Tab.1 Hierarchy of evidence and explanation in evidence-based medicine (based on the GRADE system)

表2 循证医学推荐等级及说明(参照GRADE系统)Tab.2 Recommendation grades and explanations in evidence-based medicine (based on the GRADE system)

1 精神科药物规范化使用原则
当重症患者出现明显的精神症状,尤其是出现精神运动性行为改变时,可能因为合并多种躯体疾病,导致鉴别诊断和治疗十分复杂,在难以明确病因时,我们需要以“改善症状,减少复发,预防自杀,促进康复,提高生活质量”作为治疗目标,尽早开始治疗。在选择精神科药物治疗时,建议优先考虑以下几个原则。
1.1 基于评估的治疗原则 重症相关精神障碍,精神科药物的使用需遵循“基于评估的治疗原则”:①全面了解病史;②评估躯体状况,评估原有疾病及用药对精神科药物代谢动力学和药效学的影响,坚持个体化治疗原则;③评估精神状况,明确是否存在意识障碍[8-10],确认精神症状和综合征,识别不典型症状;④治疗上应注意精简用药,对合并多种躯体疾病,同时使用多种药物的患者,尽量精简用药,注意与原有药物的相互作用。
1.2 病因治疗和对症治疗相结合的原则 首先针对病因治疗,同时给予对症治疗。精神症状的治疗主要采取对症治疗[11-12]。抗精神病药控制精神病性症状、激越或攻击等行为;抗抑郁药改善抑郁、焦虑症状;抗焦虑药物改善紧张、恐惧等症状;心境稳定剂控制躁狂症状、稳定情绪、减少冲动行为等;镇静催眠药改善睡眠障碍;促认知药改善记忆、注意等认知功能症状。
1.3 单一用药和“滴定”原则 尽可能单一用药,特别是年龄大、体质差、合并躯体疾病多、联用药物种类多以及首次使用精神科药物的患者。治疗应个体化,从小剂量起始,缓慢“滴定”,逐渐加至有效剂量。药物“滴定”速度视疗效和耐受性等因素而定。症状改善后可酌情减量或逐渐停药,不推荐长期、大量用药。
1.4 关注药物安全性原则 应密切观察精神科药物不良反应,及时发现,积极处理。需特别关注心血管系统、血液系统、呼吸系统、肝肾功能有损害的患者,以及有癫痫发作史的患者。心脏疾病患者谨慎使用三环类抗抑郁药(如氯米帕明、阿米替林、多塞平等)。肾功能不全者谨慎使用锂盐、舒必利、氨磺必利、帕利哌酮,慎重使用抗胆碱能作用强的药物(如氯氮平、氯丙嗪、苯海索等),以免引起尿潴留。抗精神病药物方面推荐使用奥氮平或者氟哌啶醇[13]。肝功能不全患者若需要使用抗精神病药物,推荐使用舒必利、氨磺必利、帕利哌酮或小剂量氟哌啶醇[14]。癫痫患者使用抗精神病药物时避免使用氯氮平、氯丙嗪以及长效抗精神病药物,慎用奥氮平、喹硫平,推荐使用氟哌啶醇、氨磺必利、舒必利[15]。共病癫痫的患者在使用抗抑郁药时推荐氟西汀和度洛西汀[16],避免使用安非他酮及三环类抗抑郁药[17]。
1.5 关注药物相互作用原则 药物相互作用是一个十分重要且复杂的问题,可能导致严重药物不良反应,常需要多学科合作来共同应对。重症患者的治疗中常联合使用多种不同机制的药物,这时很容易产生药物相互作用。既要考虑药物代谢动力学相互作用,又要关注药物效应动力学相互作用,尤其是药物对细胞色素P450酶的影响。为了进行合理的合并用药,在加用精神科药物时可使用药物相互作用平台“药物-药物相互作用数据库(DDInter)”[18]等工具辅助临床决策,减少潜在的药物联用风险。
遵循以上原则同时,需充分考虑个体化的治疗方案,考量性别、年龄、特殊人群、躯体疾病等相关因素,在临床实践中综合考虑个体差异来制定最佳的治疗策略,并动态评估病情、风险以及用药后个体化反应,动态调整用药方案,必要时联络会诊处理。具体参见重症医学相关精神障碍的药物治疗实施流程图(图1)。
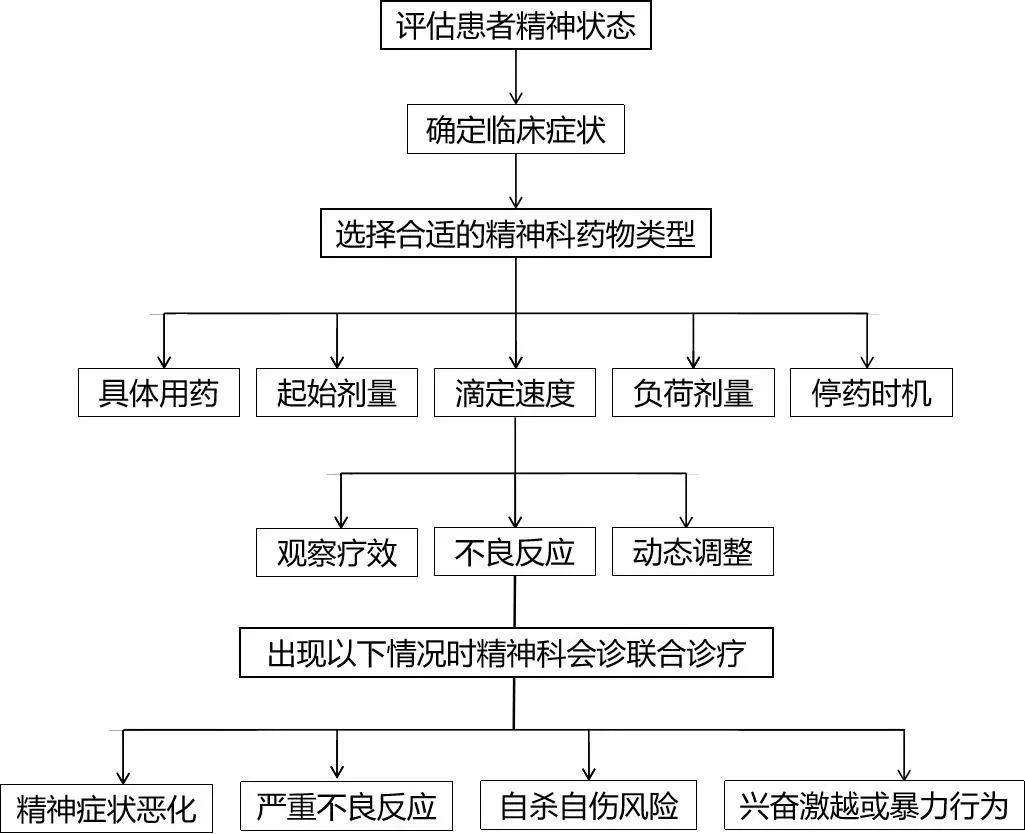
图1 重症医学相关精神障碍的药物治疗实施流程Fig.1 Drug treatment implementation process for mental disorders related to critical care medicine
2 精神科各类药物使用的共识
2.1 抗精神病药 抗精神病药能够控制兴奋、躁动、幻觉及妄想等症状,在临床中主要用于治疗精神分裂症及其他精神病性障碍,也可用于处理谵妄、激越状态以及器质性疾病继发的幻觉妄想状态等。
2.1.1 临床指征 谵妄:重症患者最常见的精神综合征之一,可发生于任何年龄,尤其多见于老年人群和伴有严重躯体疾病的患者。在ICU年龄>65岁且伴内科疾病或术后的患者中,谵妄发生率高达70%~87%[19]。据报道,60%~80%的机械通气患者和20%~50%的ICU低危患者出现谵妄[20]。临床中可使用ICU意识模糊评估法(confusion assessment method of ICU,CAM-ICU)和重症监护谵妄筛查清单(intensive care delirium screening checklist,ICDSC)对谵妄进行筛查和评估,当判断患者处于谵妄状态时可短期使用抗精神病药物控制症状[21]。
急性行为紊乱:由精神分裂症、躁狂或其他器质性精神障碍所导致的精神兴奋、攻击行为以及其他的异常行为等。一旦患者出现急性行为紊乱,应快速而安全地加以控制,在心理治疗或行为干预无效的情况下可以进行药物治疗[22]。
2.1.2 治疗建议 谵妄的治疗:目前众多指南不建议常规使用氟哌啶醇和非典型抗精神病药来治疗或者预防危重成人患者的谵妄,有meta分析显示成人术后谵妄中,预防性使用抗精神病药物(氟哌啶醇、利培酮、奥氮平)不能缩短谵妄的病程及ICU住院时间,也不能降低谵妄的发生率[23-24]。目前谵妄的治疗并不支持常规使用氟哌啶醇治疗谵妄,但大部分研究证实了氟哌啶醇在谵妄患者中的安全性[25-26]。在明确谵妄病因的多数情况下,行为干预足以控制病情。但是对于有严重激越(危害到患者)和引起痛苦的精神病性症状(幻觉或妄想)的患者,可以使用抗精神病药[27]。抗精神病药物在短期内可控制重度激越,以防止患者自行移除ICU设备、跌倒或做出攻击性行为,可用于需要避免呼吸抑制的重度焦虑患者[如心力衰竭、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)或哮喘]或有明显精神病性症状(如幻觉或妄想)的患者[21]。目前关于ICU患者的谵妄药物治疗,包括右美托咪定[11,28]、氟哌啶醇[25,29]、非典型抗精神病药(喹硫平、齐拉西酮、奥氮平)[25,29-30]等。传统上使用氟哌啶醇(2,B),应从小剂量开始,谨慎调整剂量,以获得预期镇静作用同时又避免出现过度镇静和其他不良反应,如有必要首次可选用肌肉注射,此后每6 h给药一次(通常剂量范围为1~5 mg/d,老年患者可能需要更低剂量)。临床上亦使用非典型抗精神病药替代氟哌啶醇,同样需要谨慎用药,密切监测[31]。考虑到肌肉注射氟哌啶醇可能引起具有临床意义的QTc间期延长,增加尖端扭转性室性心动过速(torsades de points,TdP)和心源性猝死(sudden cardiac death,CSD)的风险,需注意监测心电图。目前有研究发现,氟哌啶醇加劳拉西泮联合治疗可有效控制谵妄(2,B),且可缓解药物相关的锥体外系症状[32]。此外,劳拉西泮联合处方可进一步缓解激越症状[32]。
对于容易出现锥体外系症状、需要镇静治疗或者既往对氟哌啶醇抵抗的患者,建议使用奥氮平(2,C)起始剂量1.25~5 mg,每日最大剂量15 mg[33];或者使用喹硫平治疗(2,C),起始剂量12.5~100 mg,每日最大剂量400 mg[33];或者利培酮(2,C),起始剂量为1 mg,每日最大剂量6 mg[33];或者齐拉西酮20~80 mg(2,C)[25]。需要注意的是,奥氮平可能导致心动过缓和嗜睡症状,需谨慎使用[34]。以上药物宜小剂量口服开始,根据谵妄改善情况及不良反应逐渐调整剂量,必要时可使用肠道外给药,对于不配合的患者可予以奥氮平口溶膜或者齐拉西酮针剂。谵妄症状明显缓解后停药[21],且在出院后一般不需要继续使用抗精神病药物[35-36]。
急性行为紊乱的药物治疗:如果患者既往未服用过抗精神病药,建议使用奥氮平10 mg(2,B),喹硫平100~200 mg(2,B),利培酮1~2 mg(2,B),或者氟哌啶醇2.5 mg联合应用异丙嗪25 mg(2,B)。如果患者既往服用过抗精神病药,则加用劳拉西泮1~2 mg(2,B)或异丙嗪25~50 mg(2,B)即可。对于有明显激越或异常攻击行为的患者可使用肠道外给药,一般为劳拉西泮2 mg(2,B),异丙嗪50 mg(2,B),奥氮平10 mg(2,B),或者氟哌啶醇5 mg(2,B)。在精神科临床上常使用氟哌啶醇与苯海索联用。需要注意的是,肌肉注射氟哌啶醇应当在心电监测安全的情况下进行。在ICU患者中应当注意用药后可能导致的呼吸抑制,一旦发生,可用苯二氮䓬类受体拮抗剂氟马西尼进行缓解[22]。
2.1.3 药物相互作用 氟哌啶醇主要经由CYP2D6和CYP3A4代谢,抗真菌药(如酮康唑、氟康唑及伊曲康唑)通过抑制CYP3A4而抑制了氟哌啶醇的部分代谢,使氟哌啶醇的口服清除率降低,升高后者的血药浓度,特别对于快代谢型患者的影响更大,在临床中应该谨慎合用[37]。ⅠA类(例如丙吡胺、奎尼丁、普鲁卡因胺)和Ⅲ类(例如胺碘酮、多非利特、索他洛尔)抗心律失常药物可导致剂量相关的QT间期延长。上述抗心律失常药物与氟哌啶醇共同给药会导致累加效应,使室性心律失常的风险增加,包括尖端扭转型室性心动过速和猝死,在临床中应该谨慎合用[38]。
喹硫平主要经由CYP3A4代谢,该药物及其代谢产物对CYP1A2、2C9、2C19、2D6及3A4有较弱的抑制作用。抗真菌药会抑制喹硫平的代谢,升高后者的血药浓度,导致副作用的增加。阿扎那韦、利托那韦可能通过抑制CYP3A4减慢喹硫平的代谢,导致出现中毒症状[39]。苯妥英钠等药物可通过CYP3A4酶诱导加快喹硫平的体内清除速度,临床中应该谨慎合用[40]。
奥氮平主要经由CYP1A2和CYP2D6代谢,在老年人、女性、肝功能损害者中奥氮平的半衰期显著延长,而吸烟通过诱导CYP1A2加快奥氮平的代谢,骤然戒烟可能引起奥氮平代谢减慢,从而导致血药浓度升高[41]。氟伏沙明可以通过抑制CYP1A2而减慢奥氮平经CYP1A2的代谢,升高血药浓度。
利培酮主要经由CYP2D6代谢,当与CYP2D6酶抑制剂(例如氟西汀和帕罗西汀)联用时会升高利培酮血药浓度,建议每日剂量不超过4 mg,与酶诱导剂(例如卡马西平)联用时会降低血药浓度,建议检测血药浓度,必要时可适当增加药物剂量。
2.2 抗抑郁药 目前在成人单相抑郁中常用的药物根据作用机制或化学结构可分为以下几类:选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)、5-羟色胺与去甲肾上腺素再摄取抑制剂(serotonin-noradrenaline reuptake inhibitors,SNRIs)、去甲肾上腺素能和特异性5-羟色胺能抗抑郁剂(norepinephrine and specific serotonin antidepressant,NaSSA)、褪黑素受体激动剂、三环及四环类抗抑郁药(tricyclic and tetracyclic antidepressants,TCA)。这些药物通常除了能改善抑郁症状,也能有效治疗焦虑症状。
2.2.1 临床指征 抑郁障碍是以抑郁心境或愉悦感丧失为主要表现的一组疾病。与重症医学疾病的共病可以分为两种情况:一是入院前已有抑郁症状,因伴有严重自杀行为(如割腕、过量吞服药物)或出现亟需治疗的躯体问题入住ICU;二是先有重症疾病,在ICU治疗中继发抑郁障碍或出现抑郁症状。
抑郁症状在ICU患者中很常见,对患者疾病康复、预后生活质量和死亡率都会产生不良影响。有研究指出79.6%的ICU重症患者存在抑郁症状,近30%的ICU出院患者在疾病恢复的第一年内会出现新发的具有临床意义的抑郁症状[42]。存在抑郁症状的患者离开ICU后的24个月内死亡风险比没有抑郁症状的患者高出近50%[43]。多项研究指出重度的抑郁障碍会增加多种感染及免疫失调的风险,有抑郁症状的ICU患者更易发生谵妄[44],且抑郁症状会降低卒中后患者的治疗依从性、削弱治疗效果、增加死亡和再次发病的风险[45-46]。
针对ICU住院患者出现抑郁症状相关风险因素的研究发现,20~49岁患者的风险最高,ICU住院时间1~3 d和超过15 d时出现抑郁症状的风险较高,与ICU出院后出现抑郁症状最相关的疾病是脑血管疾病[47]。
因此,在ICU住院期间尽早识别患者的抑郁症状、及时采取干预措施,有助于控制病情、改善疾病预后、增加生存率、提高生活质量。推荐使用医院焦虑抑郁量表(hospital anxiety and depression scale, HADS)评估ICU患者抑郁和焦虑症状,也可以选用更为简洁的9条目患者健康问卷(patient health questionnaire-9 items,PHQ-9)进行初步筛查。
2.2.2 治疗建议 达到临床诊断的重度抑郁障碍及自杀风险高的患者应及时进行药物干预。现有的研究考虑到危重症患者使用SSRI/SNRI对凝血功能的影响、引起血管痉挛的风险[48]及获益的不确定性,不建议危重症患者在急性期使用SSRI/SNRI类药物[49]。但突然停药可能引起抗抑郁药撤药综合征(antidepressant discontinuation syndrome,ADS),出现诸如头晕、疲劳、头痛、恶心等症状[48,50]。因此,对于进入ICU前正在使用抗抑郁药物的患者,急性期生命体征不平稳时不建议继续抗抑郁治疗,可逐步停药;对于生命体征逐渐稳定的危重症患者,则需要综合考量患者躯体情况、撤药反应及副作用后决定是否停药,建议请精神科医生会诊协助评估患者药物耐受情况及调整后续抗抑郁治疗方案。
对于生命体征稳定的ICU住院及出院患者,若筛查发现抑郁情绪,精神科会诊确诊为抑郁症,基于目前对疗效和耐受性的meta分析[51]以及与其他药物的相互作用[48],首次用药推荐使用舍曲林(1,B)(50~200 mg/d)或者艾司西酞普兰(1,B)(10~20 mg/d)进行抗抑郁治疗。对于伴有明显焦虑症状的患者,也可以选用文拉法辛(1,B)(75~225 mg/d)或艾司西酞普兰(1,B)(10~20 mg/d)进行治疗。
对于因重度抑郁伴自杀行为入院,或ICU住院过程中展现出强烈自杀意念及倾向的患者,在生命体征平稳、精神科会诊评估用药安全的情况下,推荐使用静脉注射氯胺酮(2,C),推荐剂量0.5 mg/kg,每周3次,持续3~4周,快速抗抑郁及降低自杀自伤风险[52-54],使用期间需持续监测生命体征。对于不能接受氯胺酮静脉注射的患者,也可以考虑艾司氯胺酮鼻喷雾剂(2,C),推荐剂量56~84 mg,每周2次,持续4周,联合口服抗抑郁药物治疗可有效缓解抑郁症状,降低复发风险[54-56]。有研究结果提示在ICU住院患者中使用氯胺酮静脉滴注可改善患者情绪、睡眠,增加其治疗意愿[57]。需要注意的是氯胺酮产生的心脏毒性及肝胆管损害较为突出,对于血压升高会构成严重危险的患者禁用氯胺酮,甲状腺功能异常升高的患者需慎用。常见的不良反应包括血压变化、脉搏改变、呼吸减慢或困难、复视、眼球震颤、口眼鼻分泌增多等。氯胺酮起效快,疗效尚可,但作用持续时间短,可获得性低,与其他内科用药可能有冲突,且后续仍需维持支持治疗,暂不推荐作为首选方案。
2.2.3 药物相互作用 舍曲林主要由CYP3A4、CYP2C19代谢,红霉素抑制CYP3A4后可显著减慢舍曲林的代谢,导致血药浓度升高,但目前未确定其临床效应[58]。
艾司西酞普兰在体内主要由CYP2C19代谢,CYP3A4和CYP2D6也参与其代谢,但影响较小。与奥美拉唑(CYP2C19酶抑制剂)合并使用时会导致艾司西酞普兰血浆浓度中度升高约50%,应谨慎合用。
文拉法辛在人体内主要通过CYP2D6代谢,生成的代谢产物O-去甲基文拉法辛(ODV)具有相同生物活性。普罗帕酮是CYP2D6和P-糖蛋白(P-glycoprotein,P-gp)底物和抑制剂,有报道表明其能提高文拉法辛的生物利用度或减慢其代谢,导致出现精神障碍[59],在临床中应谨慎合用。特比萘芬可能通过抑制CYP2D6导致文拉法辛和O-去甲基文拉法辛的血浆浓度显著提高,使用特比萘芬期间,文拉法辛的血浆浓度-时间曲线下面积(area under the curve,AUC)平均为对照值的490%[60],在临床中应避免合用。
另外,利奈唑胺通过抑制单胺氧化酶,减少内源性的5-羟色胺(5-hydroxytryptamine,5-HT)代谢,与SSRIs合用可能导致5-羟色胺综合征,临床应该谨慎合用[61]。目前有研究发现艾司西酞普兰与阿司匹林、华法林等抗凝血药合用时存在引起凝血功能异常的风险,会增加上消化道出血的可能,应谨慎合用[62]。
氯胺酮作为CYP2C9的底物,应避免与CYP2C9强诱导剂利福平合用。对照研究明确指出,与安慰剂组相比,合用利福平可能通过诱导CYP3A4和CYP2B6,使S-氯胺酮及其代谢物S-去甲氯胺酮的AUC分别减少10%和50%[63]。有研究提示CYP 450同样影响氯胺酮代谢,应避免合用[64]。氯胺酮与阿片类镇痛药、苯二氮䓬类(benzodiazepines,BZDs)或其他中枢神经系统抑制剂(包括酒精)合用时可能导致严重的镇静作用、呼吸抑制、昏迷;与抗高血压药同用时,可导致血压剧降;与甲状腺激素同服,可引发血压过高或心动过速,应谨慎合用。
2.3 抗焦虑药 目前在重症医学中使用的具有抗焦虑作用的药物包括SSRIs、SNRIs、BZDs、NaSSA、选择性5-HT1A受体激动剂等。
2.3.1 临床指征 重症医学治疗环境特殊,可能对患者心理造成一定影响,诱发患者焦虑、恐惧、抑郁等负性情绪[65],而继发于焦虑的失眠、疼痛等全身症状及头晕、胸闷等自主神经功能失调症状,同样不利于患者的治疗康复。有研究指出焦虑障碍与心血管健康状况差、冠状动脉性心脏病和心血管意外死亡率升高相关[66]。因此,早期识别和干预重症疾病患者的焦虑情绪对疾病康复有重要意义。
当患者出现过度担忧、易激惹、过度警觉、自主神经过度活跃和肌肉紧张等表现,提示患者可能存在焦虑症状,可使用7条目广泛性焦虑障碍(generalized anxiety disorde-7,GAD-7)进行评估。若GAD-7评分≥10分,提示患者存在中度以上的焦虑,对这类患者可请精神科医生会诊确定诊断后给予抗焦虑治疗。
2.3 2 治疗建议 SSRIs和SNRIs的治疗建议参见“2.2
抗抑郁药”。
BZDs药物具有较强的镇静、催眠、肌松以及抗焦虑作用,但在大剂量时可能引起呼吸抑制和血压下降,因此在患者生命体征不平稳时,慎用BZDs治疗焦虑。对于需要持续镇静的患者推荐使用咪达唑仑(2,C)进行抗焦虑治疗,对因停用镇静药物而出现焦虑的患者可使用氯硝西泮(2,C)治疗[67]。
丁螺环酮和坦度螺酮作为选择性5-HT1A受体激动剂,具有抗焦虑作用。这类药物镇静作用轻微,不易引起运动障碍,无呼吸抑制作用,对认知功能影响小,但起效相对较慢,需要2~4周。值得注意的是,青光眼、重症肌无力及白细胞减少的患者禁用丁螺环酮;存在脑器质性功能障碍、中度或重度呼吸衰竭、心功能障碍的患者禁用坦度螺酮。使用丁螺环酮和坦度螺酮(2,C)治疗焦虑时,建议起始剂量为每次5 mg,每日2~3次,1周后逐渐加大剂量至每次10~15 mg,每日2~3次。
2.3.3 药物相互作用 丁螺环酮在人体内主要通过CYP3A4代谢。红霉素、利福平、伊曲康唑、维拉帕米和地尔硫䓬[67]都可能通过抑制CYP3A4显著增加血浆丁螺环酮的血药浓度,在临床中应谨慎合用。
2.4 心境稳定剂 心境稳定剂是治疗双相障碍的主要药物,能有效缓解并预防躁狂和抑郁发作,且不会导致或诱发转相。常用的心境稳定剂包括碳酸锂和抗惊厥药(如丙戊酸盐、拉莫三嗪等),第二代抗精神病药物(如奥氮平、喹硫平、氯氮平、利培酮、齐拉西酮)也具有稳定情绪的作用。
2.4.1 临床指征 心境障碍的患者可表现为情绪不稳、抑郁、躁狂或轻躁狂。典型躁狂的核心症状为心境的异常高涨、易激惹和不稳定,以及精力和活动的持续增加,持续时间达1周及以上,推荐使用杨氏躁狂量表(Young mania rating scale,YMRS)和Bech-Rafaelsen躁狂量表(Bech-Rafaelsen mania rating scale,BRMS)评估患者躁狂症状。抑郁症状详见2.2.1。部分患者的心境障碍可能继发于其他疾病或药物的使用,例如在全身性使用糖皮质激素的早期有可能出现轻躁狂反应和兴奋状态,而在长期使用的患者中抑郁症的患病率更高[68]。
2.4.2 治疗建议 对于进入ICU前正在使用心境稳定剂的患者,需要评估患者躯体情况、撤药后病情复发风险及副作用,以决定是否停药。在躁狂症状明显,存在伤人毁物风险和(或)影响诊疗效果,患者躯体情况能耐受的情况下,可请精神科医生会诊评估适宜的药物剂量。ICU内的继发性躁狂患者,考虑到碳酸锂的肾毒性以及抗癫痫药物对肝功能的影响,肝肾功能异常的患者均不推荐使用,可替换第二代抗精神病药物(如奥氮平、喹硫平)作为心境稳定剂治疗,从小剂量开始使用,在患者症状缓解后逐渐减停。
2.5 镇静催眠药 镇静催眠药是指通过降低中枢神经系统兴奋性和活动性,达到镇静、诱导睡眠及帮助维持睡眠、改善睡眠质量的一系列药物,主要包括BZDs、丙泊酚、右美托嘧啶、巴比妥类、其他类(唑吡坦、佐匹克隆和褪黑素等)。
2.5.1 临床指征 当患者出现明显的应激反应和躁动时,应尽快进行处理。通常镇静药物的使用应当基于所观察到的应激反应的严重程度,否则容易增加过度镇静、呼吸抑制等风险,进而可能导致患者的临床结局恶化。
重症患者的睡眠障碍经常很严重,主要特征为睡眠碎片化、生物钟紊乱、浅睡眠增加、慢波睡眠和快眼动睡眠减少。采用非药物措施后仍然存在睡眠障碍者,可慎重使用药物诱导睡眠。
2.5.2 治疗建议 美国重症医学会(SCCM)在2018年发布了新版的《ICU成年患者疼痛,躁动/镇静,谵妄,制动及睡眠障碍管理指南》[69],中华医学会重症医学分会也更新修订并发布了《中国成人ICU镇痛和镇静治疗指南》[70]以及《中国急诊成人镇痛、镇静与谵妄管理专家共识》[21]。目前推荐的镇静药物包括BZDs药物、丙泊酚、右美托咪啶,对于单纯睡眠障碍而无需镇静的患者也可以选择非BZDs药物,如唑吡坦、佐匹克隆。
BZDs药物是重症患者重要的镇静药物之一[71]。重症医学科最常用的BZDs为咪达唑仑(1,B)。咪达唑仑是当前临床应用中唯一的水溶性BZDs,同时具有脂溶性,可迅速穿透血脑屏障作用于中枢神经系统,且作用维持时间相对较短。在静脉输注咪达唑仑时,可以采用持续输注或间歇性输注两种方式,具体选择哪种方式应该根据患者的情况、治疗目的来决定。有研究表明BZDs容易引起蓄积、代谢较慢,增加镇静深度,从而进一步延长机械通气时间及住院时间[71-74]。
丙泊酚(1,B)是重症医学科常用的镇静药物,起效快,作用时间短,撤药后能快速清醒,镇静深度呈剂量依赖性,丙泊酚亦可产生遗忘作用和抗惊厥作用。有研究提示,丙泊酚相比BZDs能减少ICU住院时间和机械通气时间,但对短期病死率无影响[72]。目前仅推荐使用丙泊酚进行短期镇静,在长期镇静时需警惕丙泊酚输注综合征(propofol infusion syndrome,PRIS)的风险:当输注剂量较高或使用时间较长(>48 d)可能会出现PRIS,主要特征为急性难治性心动过缓、重度代谢性酸中毒、心血管衰竭、横纹肌溶解、高脂血症、肾衰竭和肝肿大[73]。
右美托咪啶(2,B)是选择性α2受体激动剂,具有抗焦虑、镇静和轻度的镇痛作用,无抗惊厥作用,更容易唤醒,呼吸抑制较少。有研究表明右美托咪啶相比传统镇静药可缩短机械通气时间及ICU住院时间[74]。根据美国FDA批准的产品信息,该药适用于机械通气患者的初始镇静,使用时间长于24 h可能增加停药反应(如高血压)的风险。右美托咪啶常见的不良反应是低血压、恶心、心动过缓和房颤[75],在对重症患者给予负荷剂量时需缓慢输注。
对于无镇静需求的失眠患者可以尝试使用非BZDs药物治疗,其代表药物有唑吡坦、佐匹克隆、右佐匹克隆(艾司佐匹克隆)、扎来普隆等,因药名均有“Z”,故又被称为Z药物,较BZDs对睡眠时相干扰少,可改善睡眠结构,宿醉反应、反跳现象和戒断症状等不良反应轻微,安全性高[21]。目前缺少这类药物在ICU失眠患者中应用的相关研究,在使用时应注意其可能出现的不良反应,包括常见的嗜睡、头晕和共济失调的风险,以及罕见但严重的复杂睡眠相关行为障碍风险,开始使用时应从尽可能低的剂量开始,如果使用后出现梦游症及相关行为,应避免使用。
2.5.3 药物相互作用 咪达唑仑主要经过CYP3A4代谢,氟康唑等唑类抗真菌药、克拉霉素等大环内酯类抗生素,以及胺碘酮、地尔硫䓬、舍曲林、氟西汀等药物会抑制咪达唑仑的代谢,增加血药浓度,延长作用时间[76]。抗癫痫药、抗精神病药、阿片类药物、酒精等具有中枢神经系统(central nervous system,CNS)抑制和呼吸抑制作用的药物,可增强BZDs的镇静和抑制作用;相反,CNS兴奋剂(如哌甲酯)可减弱BZDs对CNS的抑制作用。
丙泊酚易于穿透血脑屏障,与阿片类麻醉药、镇静药联用时会增强其CNS和呼吸抑制作用。丙泊酚与咪达唑仑和右美托咪啶的相互作用模型尚未明确,可能为累加或协同作用,与阿片类药物存在高度协同的相互作用[77]。丙泊酚在肝内主要经过CYP2B6代谢,小部分经过CYP2C9代谢,主要代谢物没有镇静、催眠活性,因此尚未发现有重要临床意义的代谢相关药物相互作用。
右美托咪啶在人体内主要经葡萄糖醛酸化作用和CYP代谢,目前尚未发现具有重要临床意义的经CYP介导的药物相互作用。
2.6 中枢兴奋药/促认知药及其他 ICU后综合征中长期认知功能障碍发生率达20%[3-4],其形成原因复杂,认识尚不充分。对于可能存在的认知功能问题,重点应在于早期评估和积极预防。鉴于目前尚未有研究针对ICU后综合征进行药物干预的研究报道,无法对其药物疗效进行详细评估。对于已经发生的持久的(≥6个月)认知功能损害,在治疗上建议可尝试使用改善认知功能损害的药物(2,D),如:胆碱酯酶抑制剂,包括多奈哌齐、卡巴拉汀、加兰他敏;兴奋性氨基酸拮抗剂,如美金刚;其他药物,如丁苯酞、银杏叶提取物、尼麦角林、尼莫地平、胞磷胆碱等。
3 总结
对于重症患者精神障碍的治疗,目前研究相对较少,大部分治疗策略主要依赖于专家共识、观察性研究以及有限的临床对照试验结果,这使得在制定最佳的治疗方案时面临着诸多挑战。未来,应该鼓励开展更多的临床研究,为临床实践提供更可靠的指导,帮助医生更好地治疗这一特殊群体的患者。此外,应该积极推动信息共享和国际合作,以促进重症患者精神障碍治疗领域的研究进展,提高治疗效果,改善患者的生活质量。
我们希望本专家共识能辅助重症医学科医生进行临床决策,为改善重症患者的精神障碍提供更好的治疗。同时也希望能得到读者们的积极反馈,以不断完善和优化本共识。
中华医学会心身医学分会心身重症医学协作学组
佘生林(广州医科大学附属脑科医院成人精神科)、宋真(广州医科大学附属脑科医院成人精神科)、孙同文(郑州大学第一附属医院综合ICU)、翟金国(济宁医学院精神卫生学院)、喻妍(湖南省人民医院临床心理科)、杨宁波(河南科技大学第一附属医院精神心理科)、房茂胜(武汉市精神卫生中心精神科)、郭文斌(中南大学湘雅二医院精神病学科)、王曼(深圳市人民医院临床心理科)、寻广磊(山东省精神卫生中心精神科)、张璐璐(广州市第一人民医院精神心理科)、徐西嘉(南京医科大学附属脑科医院精神科)、吴小立(中山大学附属第三医院精神科)、魏钦令(中山大学附属第三医院精神科)、刘芳(昆明医科大学第一附属医院)、李惠萍(南方科技大学附属第一医院呼吸与危重症医学科)、宋兴荣(广州市妇女儿童医疗中心麻醉与围手术科)、汪友平(广州医科大学附属脑科医院急诊科)、郑英君(广州医科大学附属脑科医院成人精神科)、宋学勤(郑州大学第一附属医院精神医学科)
参考文献:
1. DERRY H M, MIKKELSEN M E. Early forecasting of posttraumatic stress disorder symptoms after critical illness: Partly cloudy but clearing[J]. Crit Care Med, 2020, 48(11): 1694-1696.
2. MIKKELSEN M E, STILL M, ANDERSON B J, et al. Society of critical care medicine's international consensus conference on prediction and identification of long-term impairments after critical illness[J]. Crit Care Med, 2020, 48(11): 1670-1679.
3. BIENVENU O J, FRIEDMAN L A, COLANTUONI E, et al. Psychiatric symptoms after acute respiratory distress syndrome: A 5-year longitudinal study[J]. Intensive Care Med, 2018, 44(1): 38-47.
4. CANAVERA K E, ELLIOTT D A. Mental health care during and after the ICU: A call to action[J]. Chest, 2020, 158(5): 1835-1836.
5. OLAFSON K, MARRIE R A, BOLTON J M, et al. The 5-year pre- and post-hospitalization treated prevalence of mental disorders and psychotropic medication use in critically ill patients: A Canadian population-based study[J]. Intensive Care Med, 2021, 47(12): 1450-1461.
6. JAESCHKE R, GUYATT G H, DELLINGER P, et al. Use of grade grid to reach decisions on clinical practice guidelines when consensus is elusive[J]. BMJ, 2008, 337: a744.
7. BALSHEM H, HELFAND M, SCHÜNEMANN H J, et al. GRADE guidelines: 3. rating the quality of evidence[J]. J Clin Epidemiol, 2011, 64(4): 401-406.
8. ANDERSEN-RANBERG N C, POULSEN L M, PERNER A, et al. Haloperidol for the treatment of delirium in icu patients[J]. N Engl J Med, 2022, 387(26): 2425-2435.
9. DEVLIN J W, SKROBIK Y, GÉLINAS C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU[J]. Crit Care Med, 2018, 46(9): e825-e873.
10. GÉLINAS C, BÉRUBÉ M, CHEVRIER A, et al. Delirium assessment tools for use in critically ill adults: A psychometric analysis and systematic review[J]. Crit Care Nurse, 2018, 38(1): 38-49.
11. BURRY L D, CHENG W, WILLIAMSON D R, et al. Pharmacological and non-pharmacological interventions to prevent delirium in critically ill patients: A systematic review and network meta-analysis[J]. Crit Care Med, 2021, 47(9): 943-960.
12. SERAFIM R B, BOZZA F A, SOARES M, et al. Pharmacologic prevention and treatment of delirium in intensive care patients: A systematic review[J]. J Crit Care, 2015, 30(4): 799-807.
13. HAYES J F, MARSTON L, WALTERS K, et al. Adverse renal, endocrine, hepatic, and metabolic events during maintenance mood stabilizer treatment for bipolar disorder: A population-based cohort study[J]. PLoS Med, 2016, 13(8): e1002058.
14. GUNTHER M, DOPHEIDE J A. Antipsychotic safety in liver disease: A narrative review and practical guide for the clinician[J]. J Acad Consult Liaison Psychiatry, 2023, 64(1): 73-82.
15. HABIBI M, HART F, BAINBRIDGE J. The impact of psychoactive drugs on seizures and antiepileptic drugs[J]. Curr Neurol Neurosci Rep, 2016, 16(8): 71.
16. STEINERT T, FRÖSCHER W. Epileptic seizures under antidepressive drug treatment: Systematic review[J]. Pharmacopsychiatry, 2018, 51(4): 121-135.
17. ALPER K, SCHWARTZ K A, KOLTS R L, et al. Seizure incidence in psychopharmacological clinical trials: An analysis of food and drug administration (FDA) summary basis of approval reports[J]. Biol Psychiatry, 2007, 62(4): 345-354.
18. XIONG G, YANG Z, YI J, et al. DDInter: An online drug-drug interaction database towards improving clinical decision-making and patient safety[J]. Nucleic Acids Res, 2022, 50(D1): D1200-D1207.
19. GILCHRIST N A, ASOH I, GREENBERG B. Atypical antipsychotics for the treatment of ICU delirium[J]. J Intensive Care Med, 2012, 27(6): 354-361.
20. STOLLINGS J L, KOTFIS K, CHANQUES G, et al. Delirium in critical illness: Clinical manifestations, outcomes, and management[J]. Intensive Care Med, 2021, 47(10): 1089-1103.
21. 中华医学会急诊医学分会危重症学组, 中国急诊成人镇痛、镇静与谵妄管理专家共识组. 中国急诊成人镇痛、镇静与谵妄管理专家共识: 12[J]. 中华急诊医学杂志, 2023, 32(12): 1594-1609.
22. 急性行为紊乱[M]// HARRISON P, COWEN P, BURNS T, et al. 牛津精神病学. 陆林, 李涛, 王高华, 主译. 第7版. 北京: 北京大学医学出版社, 2022: 626-627.
23. SCHRIJVER E J M, DE VRIES O J, VAN DE VEN P M, et al. Haloperidol versus placebo for delirium prevention in acutely hospitalised older at risk patients: A multi-centre double-blind randomised controlled clinical trial[J]. Age Ageing, 2018, 47(1): 48-55.
24. LIN P, ZHANG J, SHI F, et al. Can haloperidol prophylaxis reduce the incidence of delirium in critically ill patients in intensive care units? A systematic review and meta-analysis[J]. Heart Lung, 2020, 49(3): 265-272.
25. PAGE V J, ELY E W, GATES S, et al. Effect of intravenous haloperidol on the duration of delirium and coma in critically ill patients (Hope-ICU): A randomised, double-blind, placebo-controlled trial[J]. Lancet Respir Med, 2013, 1(7): 515-523.
26. COLE J B, LEE S C, MARTEL M L, et al. The incidence of qt prolongation and torsades des pointes in patients receiving droperidol in an urban emergency department[J]. West J Emerg Med, 2020, 21(4): 728-736.
27. INOUYE S K, WESTENDORP R G J, SACZYNSKI J S. Delirium in elderly people[J]. Lancet, 2014, 383(9920): 911-922.
28. BURRY L, HUTTON B, WILLIAMSON D R, et al. Pharmacological interventions for the treatment of delirium in critically ill adults[J]. Cochrane Database Syst Rev, 2019, 2019(9): CD011749.
29. GIRARD T D, PANDHARIPANDE P P, CARSON S S, et al. Feasibility, efficacy, and safety of antipsychotics for intensive care unit delirium: The mind randomized, placebo-controlled trial[J]. Crit Care Med, 2010, 38(2): 428-437.
30. BALAS M C, BURKE W J, GANNON D, et al. Implementing the awakening and breathing coordination, delirium monitoring/management, and early exercise/mobility bundle into everyday care: Opportunities, challenges, and lessons learned for implementing the ICU pain, agitation, and delirium guidelines[J]. Crit Care Med, 2013, 41(9 Suppl 1): S116-S127.
31. 谵妄[M]// HARRISON P, COWEN P, BURNS T, et al. 牛津精神病学. 陆林, 李涛, 王高华, 主译. 第7版. 北京: 北京大学医学出版社, 2022: 300-302.
32. WU Y C, TSENG P T, TU Y K, et al. Association of delirium response and safety of pharmacological interventions for the management and prevention of delirium[J]. JAMA Psychiatry, 2019, 76(5): 526-535.
33. RIVIÈRE J, VAN DER MAST R C, VANDENBERGHE J, et al. Efficacy and tolerability of atypical antipsychotics in the treatment of delirium: A systematic review of the literature[J]. Psychosomatics, 2019, 60(1): 18-26.
34. WANG M, YANKAMA T T, ABDALLAH G T, et al. A retrospective comparison of the effectiveness and safety of intravenous olanzapine versus intravenous haloperidol for agitation in adult intensive care unit patients[J]. J Intensive Care Med, 2022, 37(2): 222-230.
35. TOMICHEK J E, STOLLINGS J L, PANDHARIPANDE P P, et al. Antipsychotic prescribing patterns during and after critical illness: A prospective cohort study[J]. Crit Care, 2016, 20(1): 378.
36. BONCYK C S, FARRIN E, STOLLINGS J L, et al. Pharmacologic management of intensive care unit delirium: Clinical prescribing practices and outcomes in more than 8500 patient encounters[J]. Anesth Analg, 2021, 133(3): 713-722.
37. MILOSAVLJEVIC F, BUKVIC N, PAVLOVIC Z, et al. Association of CYP2C19 and CYP2D6 poor and intermediate metabolizer status with antidepressant and antipsychotic exposure: A systematic review and meta-analysis[J]. JAMA Psychiatry, 2021, 8(3): 270-280.
38. YAMREUDEEWONG W, DEBISSCHOP M, MARTIN L G, et al. Potentially significant drug interactions of class III antiarrhythmic drugs[J]. Drug Saf, 2003, 26(6): 421-38.
39. POLLACK T M, MCCOY C, STEAD W. Clinically significant adverse events from a drug interaction between quetiapine and atazanavir-ritonavir in two patients[J]. Pharmacotherapy, 2009, 29(11): 1386-1391.
40. WONG Y W, YEH C, THYRUM P T. The effects of concomitant phenytoin administration on the steady-state pharmacokinetics of quetiapine[J]. J Clin Psychopharmacol, 2001, 21(1): 89-93.
41. ARNOLDI J, REPKING N. Olanzapine-induced parkinsonism associated with smoking cessation[J]. Am J Health Syst Pharm, 2011, 68(5): 399-401.
42. DAVYDOW D S, GIFFORD J M, DESAI S V, et al. Depression in general intensive care unit survivors: A systematic review[J]. Intensive Care Med, 2009, 35(5): 796-809.
43. HATCH R, YOUNG D, BARBER V, et al. Anxiety, depression and post traumatic stress disorder after critical illness: A UK-wide prospective cohort study[J]. Crit Care, 2018, 22(1): 310.
44. ARBABI M, DEZHDAR Z, AMINI B, et al. Depression and anxiety increase the odds of developing delirium in ICU patients; A prospective observational study[J]. Cogn Neuropsychiatry, 2022, 27(1): 1-10.
45. AYERBE L, AYIS S, WOLFE C D A, et al. Natural history, predictors and outcomes of depression after stroke: Systematic review and meta-analysis[J]. Br J Psychiatry, 2013, 202(1): 14-21.
46. EDMONDSON D, RICHARDSON S, FAUSETT J K, et al. Prevalence of ptsd in survivors of stroke and transient ischemic attack: A meta-analytic review[J]. PLoS One, 2013, 8(6): e66435.
47. LIAO K M, HO C H, LAI C C, et al. The association between depression and length of stay in the intensive care unit[J]. Medicine (Baltimore), 2020, 99(23): e20514.
48. SHAFIEKHANI M, MIRJALILI M, VAZIN A. Psychotropic drug therapy in patients in the intensive care unit - usage, adverse effects, and drug interactions: A review[J]. Ther Clin Risk Manag, 2018, 14: 1799-1812.
49. KELLY J M, RUBENFELD G D, MASSON N, et al. Using selective serotonin reuptake inhibitors and serotonin-norepinephrine reuptake inhibitors in critical care: A systematic review of the evidence for benefit or harm[J]. Crit Care Med, 2017, 45(6): e607-e616.
50. LAPORTE S, CHAPELLE C, CAILLET P, et al. Bleeding risk under selective serotonin reuptake inhibitor (SSRI) antidepressants: A meta-analysis of observational studies[J]. Pharmacol Res, 2017, 118: 19-32.
51. CIPRIANI A, FURUKAWA T A, SALANTI G, et al. Comparative efficacy and acceptability of 12 new-generation antidepressants: A multiple-treatments meta-analysis[J]. Lancet, 2009, 373(9665): 746-758.
52. WILKINSON S T, BALLARD E D, BLOCH M H, et al. The effect of a single dose of intravenous ketamine on suicidal ideation: A systematic review and individual participant data meta-analysis[J]. Am J Psychiatry, 2018, 175(2): 150-158.
53. MURROUGH J W, SOLEIMANI L, DEWILDE K E, et al. Ketamine for rapid reduction of suicidal ideation: A randomized controlled trial[J]. Psychol Med, 2015, 45(16): 3571-3580.
54. MCINTYRE R S, ROSENBLAT J D, NEMEROFF C B, et al. Synthesizing the evidence for Ketamine and Esketamine in treatment-resistant depression: An international expert opinion on the available evidence and implementation[J]. Am J Psychiatry, 2021, 178(5): 383-399.
55. REIF A, BITTER I, BUYZE J, et al. Esketamine nasal spray versus quetiapine for treatment-resistant depression[J]. N Engl J Med, 2023, 389(14): 1298-1309.
56. DALY E J, TRIVEDI M H, JANIK A, et al. Efficacy of esketamine nasal spray plus oral antidepressant treatment for relapse prevention in patients with treatment-resistant depression: A randomized clinical trial[J]. JAMA Psychiatry, 2019, 76(9): 893-903.
57. GIRI A R, KAUR N, YARRARAPU S N S, et al. "Novel management of depression using ketamine in the intensive care unit"[J]. J Intensive Care Med, 2022, 37(12): 1654-1661.
58. OBACH R S, COX L M, TREMAINE L M. SERTRALINE is metabolized by multiple cytochrome p450 enzymes, monoamine oxidases, and glucuronyl transferases in human: An in vitro study[J]. Drug Metab Dispos, 2005, 33(2): 262.
59. GARERI P, FAZIO P D, GALLELLI L, et al. Venlafaxine-propafenone interaction resulting in hallucinations and psychomotor agitation[J]. Ann Pharmacother, 2008, 42(3): 434-438.
60. HYNNINEN V V, OLKKOLA K, BERTILSSON L, et al. Effect of terbinafine and voriconazole on the pharmacokinetics of the antidepressant venlafaxine[J]. Clin Pharmacol Ther, 2008, 83(2): 342-348.
61. CLARK D B, ANDRUS M R, BYRD D C. Drug interactions between linezolid and selective serotonin reuptake inhibitors: Case report involving sertraline and review of the literature[J]. Pharmacotherapy, 2006, 26(2): 269-276.
62. MENON R M, BADRI P S, WANG T, et al. Drug-drug interaction profile of the all-oral anti-hepatitis C virus regimen of paritaprevir/ritonavir, ombitasvir, and dasabuvir[J]. J Hepatol, 2015, 63(1): 20-29.
63. NOPPERS I, OLOFSEN E, NIESTERS M, et al. Effect of rifampicin on s-ketamine and s-norketamine plasma concentrations in healthy volunteers after intravenous S-ketamine administration[J]. Anesthesiology, 2011, 114(6): 1435-1445.
64. NGUYEN T M L, MCGOWAN J C, GARDIER A M. CYP 450 enzymes influence (R,S)-ketamine brain delivery and its antidepressant activity[J]. Neuropharmacology, 2022, 206: 108936.
65. BASHAR F R, VAHEDIAN-AZIMI A, HAJIESMAEILI M, et al. Post-ICU psychological morbidity in very long ICU stay patients with ards and delirium[J]. J Crit Care, 2018, 43: 88-94.
66. BUTNORIENE J, BUNEVICIUS A, SAUDARGIENE A, et al. Metabolic syndrome, major depression, generalized anxiety disorder, and ten-year all-cause and cardiovascular mortality in middle aged and elderly patients[J]. Int J Cardiol, 2015, 190: 360-366.
67. OLSEN H T, NEDERGAARD H K, STRØM T, et al. Nonsedation or light sedation in critically ill, mechanically ventilated patients[J]. N Engl J Med, 2020, 382(12): 1103-1111.
68. BHANGLE S D, KRAMER N, ROSENSTEIN E D. Corticosteroid-induced neuropsychiatric disorders: Review and contrast with neuropsychiatric lupus[J]. Rheumatol Int, 2013, 33(8): 1923-1932.
69. DEVLIN J W, SKROBIK Y, GÉLINAS C, et al. Executive summary: clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU[J]. Crit Care Med, 2018, 46(9): 1532-1548.
70. 中华医学会重症医学分会. 中国成人ICU镇痛和镇静治疗指南: 6[J]. 中华危重病急救医学, 2018, 30(6): 497-514.
71. VINCENT J L, SHEHABI Y, WALSH T S, et al. Comfort and patient-centred care without excessive sedation: The ecash concept[J]. Intensive Care Med, 2016, 42(6): 962-971.
72. CARSON S S, KRESS J P, RODGERS J E, et al. A randomized trial of intermittent lorazepam versus propofol with daily interruption in mechanically ventilated patients[J]. Crit Care Med, 2006, 34(5): 1326-1332.
73. FUDICKAR A, BEIN B. Propofol infusion syndrome: Update of clinical manifestation and pathophysiology[J]. Minerva Anestesiol, 2009, 75(5): 339-344.
74. CHEN K, LU Z, XIN Y C, et al. Alpha-2 agonists for long-term sedation during mechanical ventilation in critically ill patients[J]. Cochrane Database Syst Rev, 2015, 1(1): CD010269.
75. JAKOB S M, RUOKONEN E, GROUNDS R M, et al. Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation: Two randomized controlled trials[J]. JAMA, 2012, 307(11): 1151-1160.
76. CHUNG E, NAFZIGER A N, KAZIERAD D J, et al. Comparison of midazolam and simvastatin as cytochrome P450 3A probes[J]. Clin Pharmacol Ther, 2006, 79(4): 350-361.
77. SAHINOVIC M M, STRUYS M M R F, ABSALOM A R. Clinical pharmacokinetics and pharmacodynamics of propofol[J]. Clin Pharmacokinet, 2018, 57(12): 1539-1558.
【引用格式】佘生林,宋真,孙同文,等. 重症医学相关精神障碍药物合理使用专家共识[J]. 中国神经精神疾病杂志,2024,50(9):513-524.
【Cite this article】SHE S L, SONG Z, SUN T W.Expert consensus on the rational use of psychotropic drugs related to intensive care medicineExpert consensus on the rational use of psychotropic drugs related to intensive care medicine[J]. Chin J Nervous Mental Dis,2024,50(9):513-524.
DOI:10.3969/j.issn.1002-0152.2024.09.001
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#谵妄# #精神障碍# #重症医学#
35