Biomaterials:西北大学联合空军军医大学制备基因工程重组细胞外囊泡增强前列腺癌免疫治疗效果
2024-11-01 iNature iNature 发表于上海
PSMAscFv-EVN-GSDMD可以将PCa的免疫抑制性“冷”肿瘤微环境转化为免疫原性“热”肿瘤微环境。
前列腺癌(PCa)与免疫原性差和淋巴细胞浸润有关,目前仍缺乏有效的免疫疗法。焦亡是一种新型癌症免疫治疗方式,可促进全身免疫反应,诱导实体瘤中的免疫原性细胞死亡。
2024年10月28日,西北大学Wu Guojun、空军军医大学张瑞共同通讯在Biomaterials 上在线发表题为“Genetically modified extracellular vesicles loaded with activated gasdermin D potentially inhibit prostate-specific membrane antigen-positive prostate carcinoma growth and enhance immunotherapy”的研究论文。该研究制备了一种基因工程重组细胞外囊泡PSMAscFv-EVN-GSDMD,其表面表达对前列腺特异性膜抗原(PSMA)具有高亲和力的单链可变抗体片段(scFv),并负载有gasderminD(GSDMD)的N-末端结构域。
体外和体内实验中,PSMAscFv-EVN-GSDMD通过细胞外囊泡的载体特性和PSMAscFv的特异性有效靶向PSMA阳性前列腺癌细胞并诱导诱导焦亡。在22RV1和PSMA转染的RM-1接种的前列腺癌小鼠模型中,PSMAscFv-EVN-GSDMD有效抑制肿瘤生长并增强肿瘤免疫反应。总之,PSMAscFv-EVN-GSDMD可以将PCa的免疫抑制性“冷”肿瘤微环境转化为免疫原性“热”肿瘤微环境。

前列腺癌(PCa)每年出现超过120万新诊断病例和超过350,000例PCa相关死亡病例,给男性健康带来重大负担。PCa的标准治疗方案包括手术干预、内分泌治疗和化疗,但许多患者会发展为去势抵抗性前列腺癌(CRPC)。免疫疗法能够产生长期抗癌效果,已广泛用于各种恶性肿瘤治疗。然而,PCa为“冷”肿瘤,由于其肿瘤突变负荷低、程序性细胞死亡蛋白配体1(programmedcelldeathproteinligand1,PD-L1)表达受限和T细胞浸润减少,对免疫治疗的反应性欠佳。因此,有必要设计更新、更有效的PCa免疫治疗方法。
gasdermin(GSDM)家族蛋白诱导的焦亡是由病原体感染或内源性攻击触发的一种裂解性细胞死亡。在GSDM家族成员中,gasderminD(GSDMD)是一种焦亡引发剂,由约53kDa的胞质前蛋白组成,包含N端效应子和C端自抑制结构域。当受到刺激时,被募集和激活的caspase-1/4/5/11切割GSDMD,导致GSDMD(N-GSDMD)的N端结构域释放。释放的片段随后可以寡聚化以产生膜孔,最终导致局部细胞肿胀、膜破裂和细胞质损伤相关分子模式(DAMP)泄漏。免疫细胞识别DAMP,随后引起免疫细胞活化和浸润。焦亡细胞形成的孔可以启动免疫原性细胞死亡(ICD)并释放促炎细胞因子,形成“热”肿瘤微环境(TME)。近期研究表明,通过多种途径直接递送N-GSDMD来诱导焦亡,可以有效治疗不同的疾病。因此,通过直接将N-GSDMD递送至肿瘤细胞来逆转免疫抑制性肿瘤微环境具有广阔的应用前景,但如何将N-GSDMD递送到肿瘤细胞是目前面临的巨大挑战。
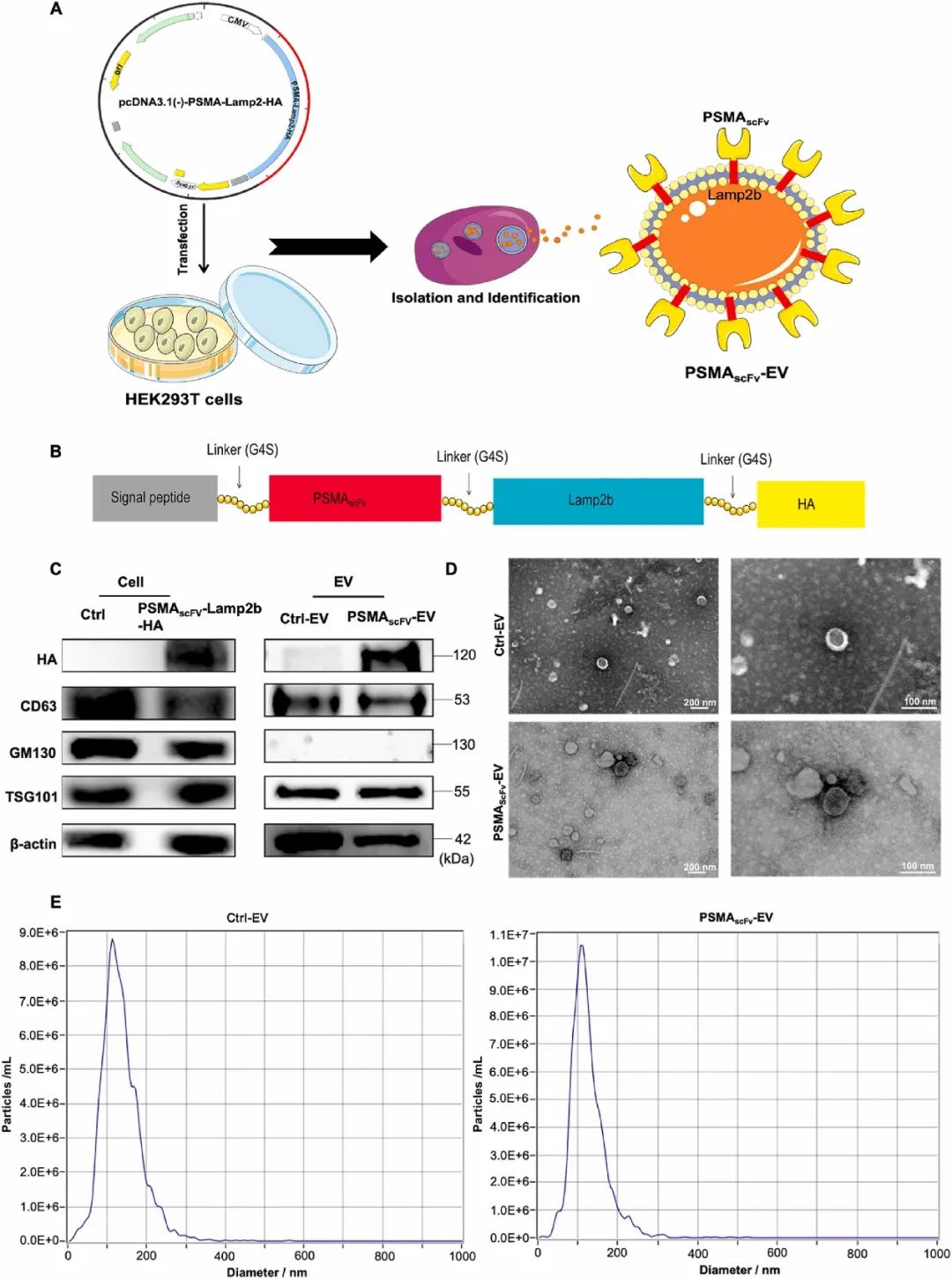
图1 PSMAscFv-EVN-GSDMD的制备和表征(摘自Biomaterials )
人胚胎肾(HEK)293T细胞系表现出良好的生物学特性,如高转染效率和易于培养,常用于细胞生物学和生物技术实验。来源于HEK293T细胞的细胞外囊泡(EV)具有高稳定性、可及性和丰度,在疾病治疗中应用潜力巨大。“EVs”是由脂双层界定的细胞自然释放的非复制颗粒,根据大小和形态,可分为不同类别的分泌性囊泡。生物体液中直径为50至150nm的小型EV最丰富,参与细胞间通讯、免疫、发育、神经生物学和微生物学等各种生理过程。尽管还处于起步阶段,但由于其低毒性、免疫原性以及高工程化,小型EVs有望成为药物递送的载体。EVs已用于各种疾病模型的靶向治疗,如抗表皮生长因子受体单链可变片段(scFv)功能化的外泌体可以递送溶血磷脂酰胆碱酰基转移酶特异性siRNAs,抑制肺癌脑转移。此外, GelMA/纳米粘土水凝胶负载的人脐带间充质干细胞衍生小EVs可以促进软骨再生。因此,作者假设具有特异性递送能力的含N-GSDMD细胞外囊泡将是一种有效的抗PCa治疗策略。
以EV为基础的基因治疗有望用于前列腺癌的治疗。该研究设计了一种表达溶酶体相关膜糖蛋白2b基因(Lamp2b)的慢病毒载体,含有前列腺特异性膜抗原(PSMA)特异性scFv,并将其转染到HEK-293T细胞中以得到一种新型细胞外囊泡PSMAscFv-EV。随后,PSMAscFv-EV负载N-GSDMD,得到基于HEK-293TEV的多功能靶向递送平台PSMAscFv-EVN-GSDMD。作者认为,该平台可以靶向PSMA受体,并在没有蛋白酶切割的情况下直接触发PSMA阳性PCa细胞焦亡。体外和体内结果表明,PSMAscFv-EVN-GSDMD可以特异性靶向PSMA阳性PCa细胞,抑制肿瘤生长并激活抗肿瘤免疫反应。总得来说,该研究制备了PSMAscFv-EVN-GSDMD,验证了静脉注射PSMAscFv-EVN-GSDMD靶向和治疗表达PSMA的前列腺癌的可行性,为前列腺癌免疫疗法提供了新参考。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961224004289?via%3Dihub#sec1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














前沿知识学习紧跟时代!!
16
#前列腺癌# #免疫治疗#
17