Nat Genet:WES联合RNA-seq分析揭示晚期NSCLC免疫治疗的基因组学和转录组学特征
2023-05-06 测序中国 测序中国 发表于四川省
通过对基因组特征以及已有的免疫和肿瘤生物学相关特征的综合分析,发现了不同信号通路和不同细胞类型之间复杂相互作用的现象,进一步揭示了免疫检查点抑制剂治疗背后的多维度相互作用。
导读
PD-1/PD-L1抑制剂的应用使得晚期非小细胞肺癌(NSCLC)治疗出现了新的转机。多项研究结果表明,PD-1/PD-L1抑制剂可显著改善NSCLC患者的总生存期。但在未经选择的NSCLC患者中,目前只有约20%反应率。因此,了解患者对治疗是否有反应的预测因子,有助于确定最有可能受益的患者群体。但目前仍缺乏针对NSCLC免疫治疗特异性患者的大型、多组学队列研究,这使相关预测因子的鉴定和整合工作受到了阻碍。
近日,美国麻省总医院癌症中心、Broad研究所联合阿斯利康等团队在Nature Genetics上发表了题为“Genomic and transcriptomic analysis of checkpoint blockade response in advanced non-small cell lung cancer”的文章。在这项研究中,为了加深对NSCLC中免疫检查点抑制剂反应分子特征的理解,研究团队对Stand Up To Cancer-Mark Foundation(SU2C-MARK)队列进行了首次联合分析,发现了多个与患者反应结果相关的分子特征,包括有利(ATM突变)和不利(TERT扩增)的基因组亚群;免疫蛋白酶体可诱导成分的表达与反应之间的关联以及肿瘤内在亚型的影响等。该研究结果强调了免疫治疗背后的生物学决定因素的复杂性,以及在大型特定癌症队列中进行综合分析的潜力。

文章发表在Nature Genetics
主要研究内容
队列突变概况
研究团队分析了NSCLC患者接受PD-1/PD-L1药物的一线治疗之前收集的肿瘤样本,这些样本来自9个癌症中心的393名晚期NSCLC患者。肿瘤和匹配的正常样本均进行了全外显子组测序(WES)。此外,研究人员还对部分患者的肿瘤组织进行了全转录组测序(RNA-seq)分析。整体而言,该研究共纳入309份WES和152份RNA-seq样本进行分析及定量。
为了更好地理解突变驱动因素和疾病缓解之间的关系,研究人员在三个缓解类别中评估了已知肺癌驱动因素的患病率:部分或完全缓解(PR/CR)、病情稳定(SD)和疾病进展(PD)。与先前的报道一致,非同义TMB与缓解类别相关,PR/CR患者的TMB中位数为14.0 mut/MB,SD患者为9.0 mut/MB,PD患者为7.4 mut/MB。
同时,研究团队分析了49个已知肺癌驱动因素与治疗反应之间的关系,其中6个基因存在统计学显著性或接近显著性。例如,ATM突变似乎对检查点抑制治疗最有利,在另一独立队列中也进行了ATM和应答性的相关性分析,发现ATM突变与免疫检查点抑制治疗后的总生存率提高相关。因此,除了TMB指标外,单个驱动事件也可能定义免疫检查点抑制剂治疗的有利和不利因素。
此外,研究团队还进行了应答的转录预测因子鉴定,对应答者(PR/CR)和无应答者(SD/PD)之间的差异表达基因进行了全基因组分析,初步确定了三个相关基因:PSME1、PSME2和PSMB9。鉴于这三个基因在负责肽生成的蛋白酶体/免疫蛋白酶体系统组分上的显著富集,研究人员扩大了对抗原呈递途径特异性基因的探索,发现免疫蛋白酶体亚基似乎是非常重要的治疗反应预测因子,甚至在更广泛的IFN-γ诱导转录中也是如此。
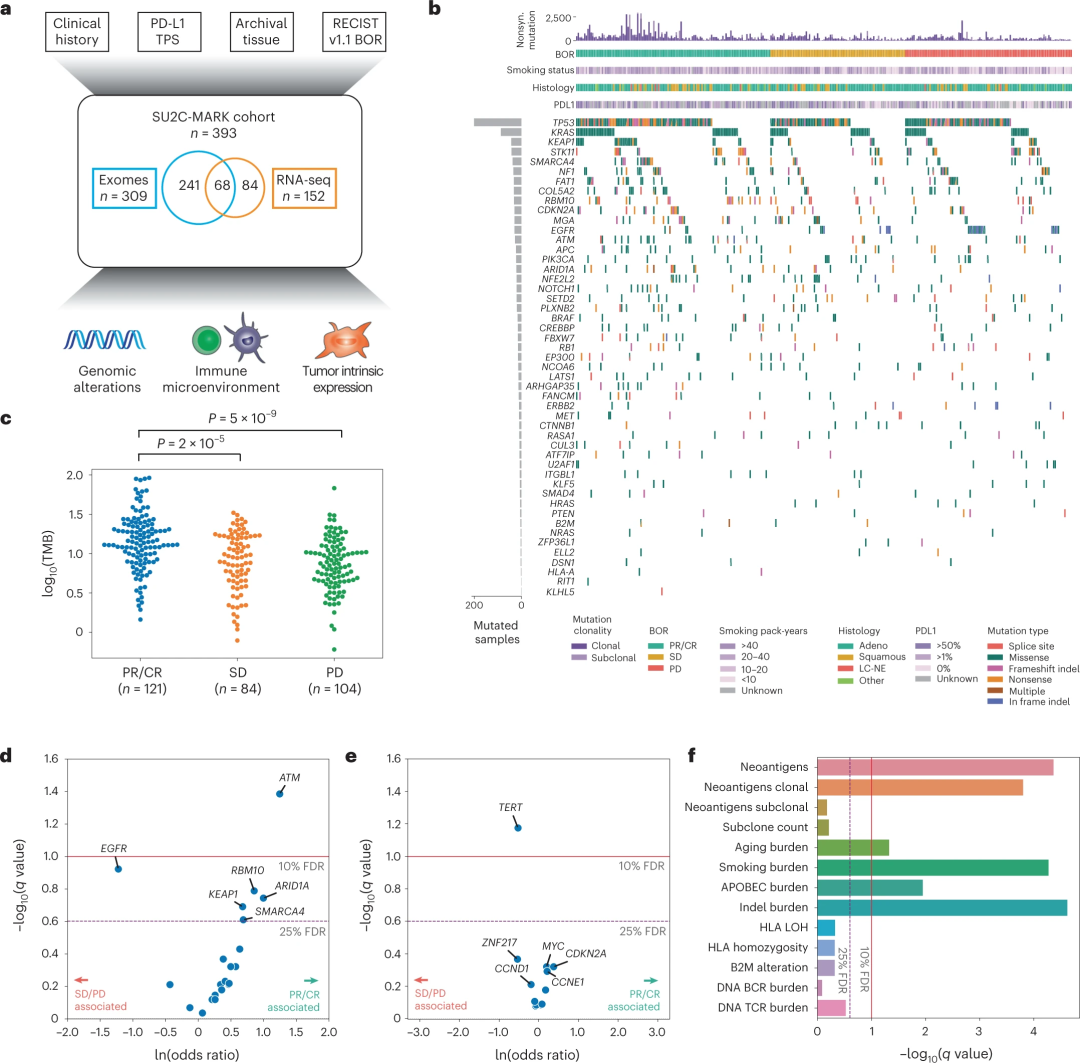
图1. SU2C-MARK队列概述和初始基因组特征,来源:Nature Genetics
微环境表达特征
为了鉴定与单个细胞类型以外的免疫治疗反应相关的微环境(M)特征,研究人员将贝叶斯非负矩阵分解(B-NMF)应用于前770个差异表达基因,并产生了三个不同的M特征:M-1、M-2和M-3。由于这些特征基因来自混合细胞群的测序数据,因此它们有望反映完整的微环境特征,包括肿瘤和非肿瘤(即免疫和基质)来源。
基因集富集分析结果显示,M-1与上皮-间充质转化有关;M-2与异体移植物排斥反应/IFN-γ反应有关,与炎症免疫环境一致;M-3则与细胞周期相关的E2F靶点存在弱相关性。值得注意的是,这些亚型对免疫检查点抑制剂的反应率各不相同,相对于M-1和M-3,M-2反应率显著增加。
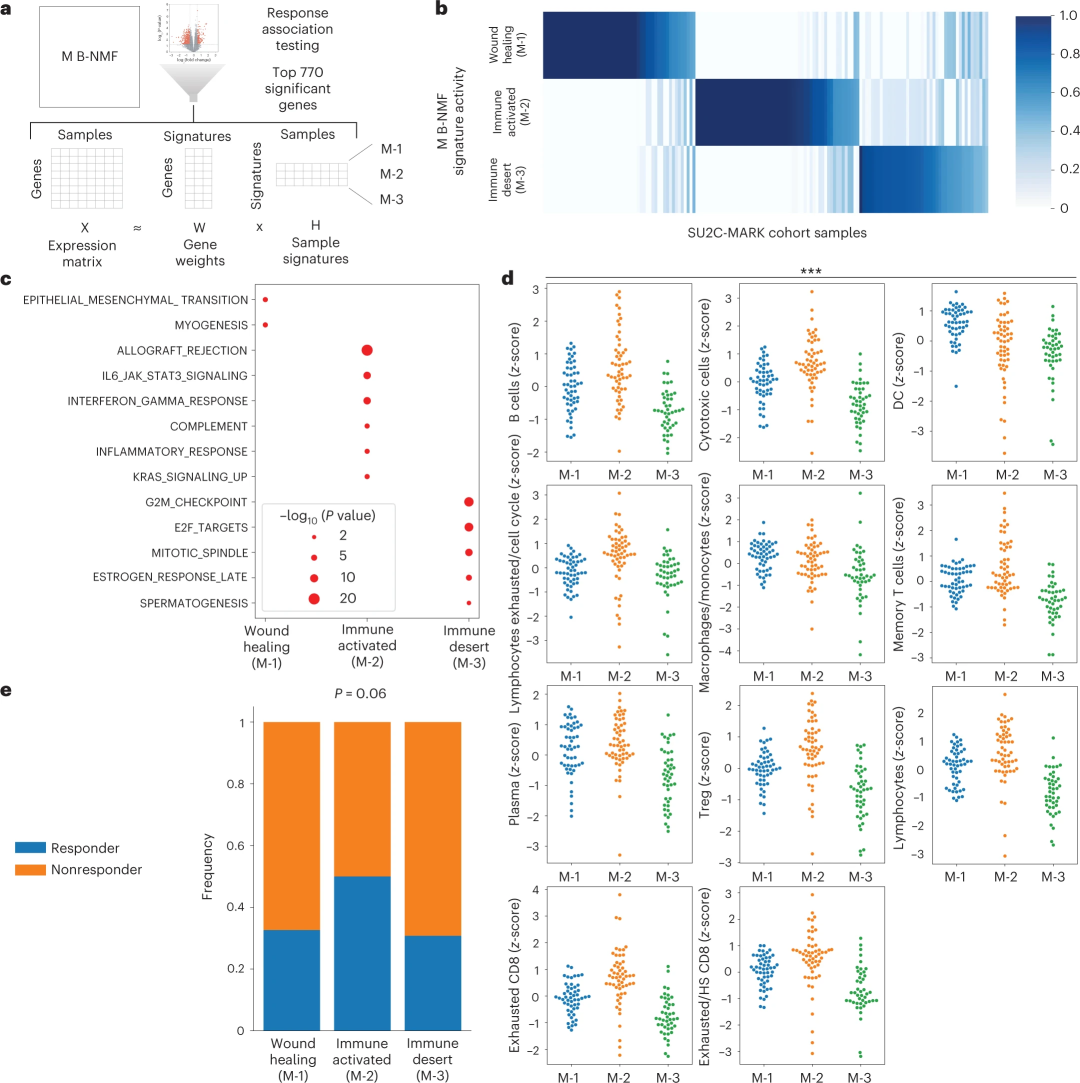
图2. 微环境亚型的鉴定及其与免疫检查点抑制剂治疗反应的关系,来源:Nature Genetics
研究队列的综合分析
在评估了与NSCLC检查点阻断反应相关的广泛的临床、基因组和转录组学特征后,研究人员对这些预测因子之间的关系进行了综合分析。
总的来说,研究团队获得三个强相关模块,第一个相关模块(C1)似乎反映了典型的“伤口愈合”的微环境,包括免疫抑制性髓系细胞和基质特征;第二个相关模块(C2)反映了与“免疫激活/衰竭”相关的更经典的细胞因子和免疫环境,包括浸润性免疫特征和蛋白酶体亚基;第三个相关模块(C3)由与突变负担相关的特征组成,可能是新抗原丰度和随后增强的免疫识别的代表。其余9个特征在某种程度上呈现离散相关,作为第四组(C4)富集了单基因的改变,具有不同的免疫生物学特征。值得注意的是,该模块包括EGFR突变,不过EGFR突变与免疫特征的相关性很小,但与突变负荷特征存在中度相关性,这表明该亚型的内在耐药性可能主要是由新抗原不足驱动的。
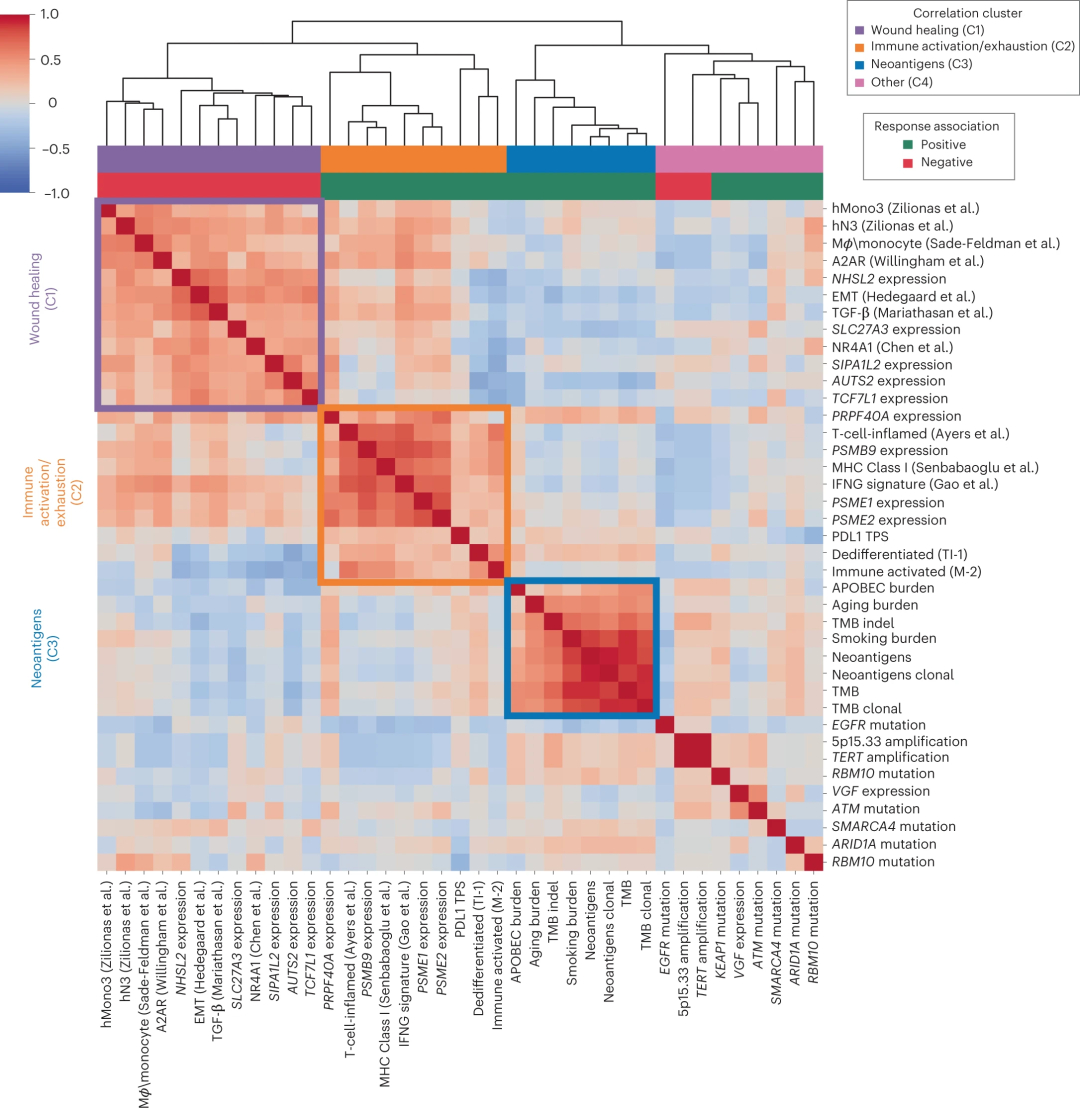
图3. 临床、基因组和转录组特征的整合分析,来源:Nature Genetics
为了进一步了解可能驱动反应和耐药性的特定细胞成分,研究团队在已公开发表的NSCLC单细胞测序数据中,通过对13个癌症相关标记物表达进行评估,揭示了其与不同肿瘤亚型的直接关联。研究显示,EMT和TGF-b信号主要反映肿瘤细胞内的成纤维细胞和内皮细胞,而不是间充质表观遗传状态本身;一些主要的单基因转录预测因子,如AUTS2和TCF7L1,则显示出大量的肿瘤固有表达。这些发现表明机体存在着丰富的、相互作用的生态系统,可能是免疫检查点抑制剂发挥作用的广泛基础,并提供了一系列特定的信号通路和细胞类型,这些可能是未来进行有效干预的努力方向。
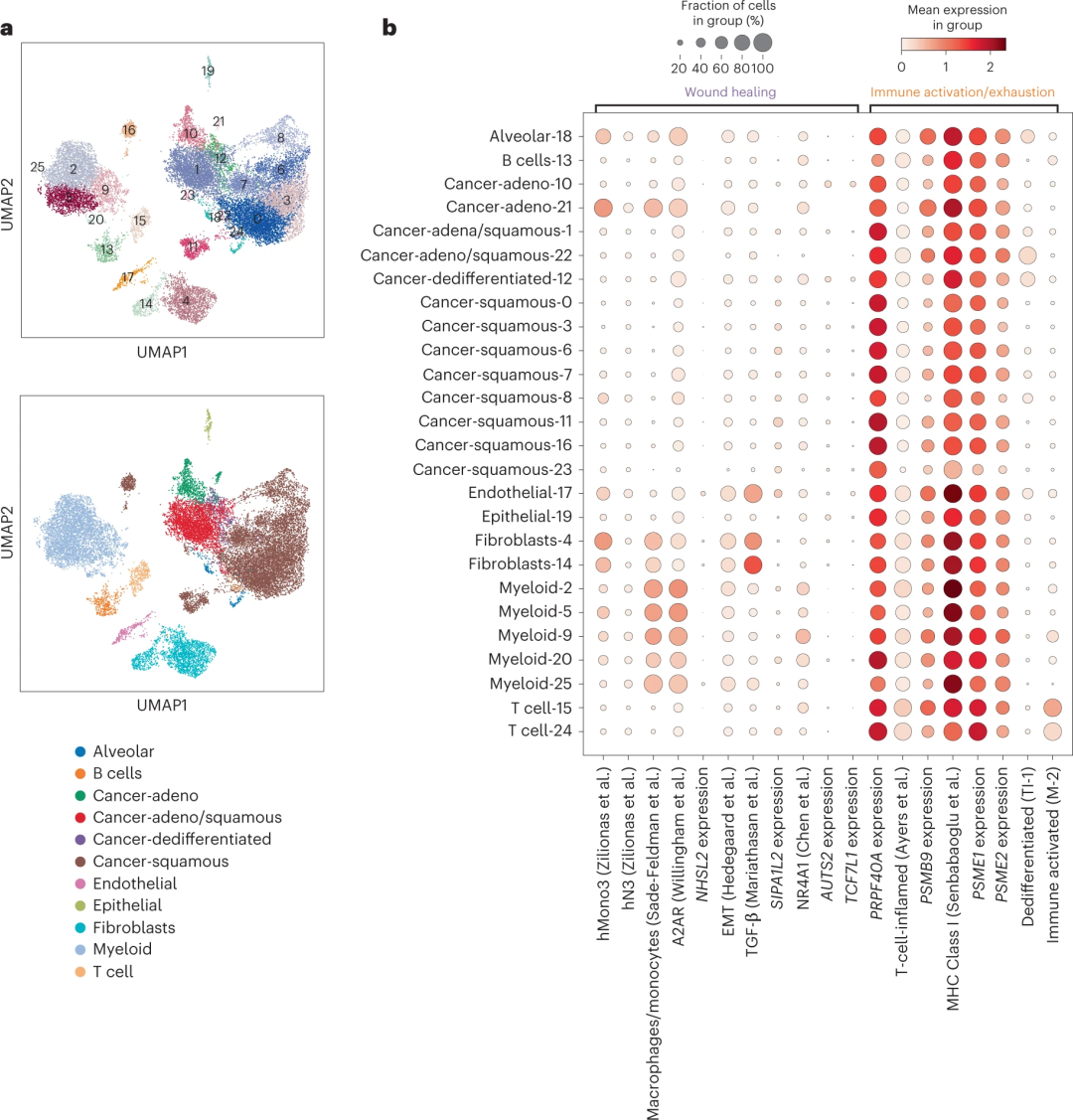
图4.单细胞数据中转录组特征解析,来源:Nature Genetics
结 语
综上所述,该研究对NSCLC患者的SU2C-MARK队列进行了联合分析,从而鉴定出与免疫治疗反应相关的不同层面的预测因子。通过对基因组特征以及已有的免疫和肿瘤生物学相关特征的综合分析,发现了不同信号通路和不同细胞类型之间复杂相互作用的现象,进一步揭示了免疫检查点抑制剂治疗背后的多维度相互作用。研究人员表示,希望SU2C-MARK队列可以继续作为丰富的资源供多个科研团队进行深入探讨,以进一步揭示相关基因组预测因子的复杂结构,并对抗肿瘤免疫生物学产生更深入的见解。
参考资料:
Ravi, A., Hellmann, M.D., Arniella, M.B. et al. Genomic and transcriptomic analysis of checkpoint blockade response in advanced non-small cell lung cancer. Nat Genet (2023).
https://www.nature.com/articles/s41588-023-01355-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









