Nature:CRISPR逐个筛查基因组找到癌症免疫治疗必需基因
2017-08-09 文姜 生物探索
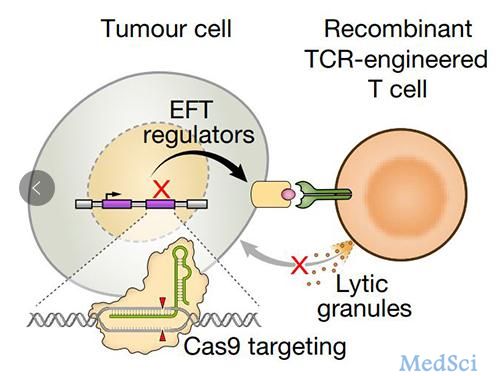
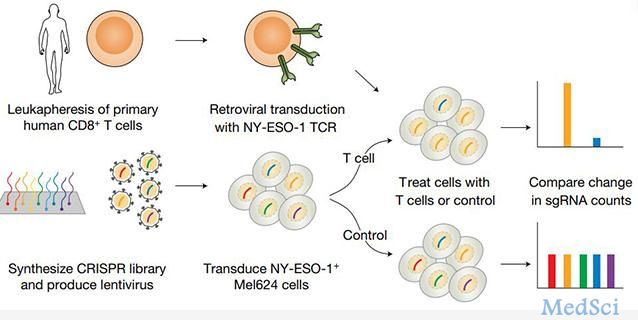
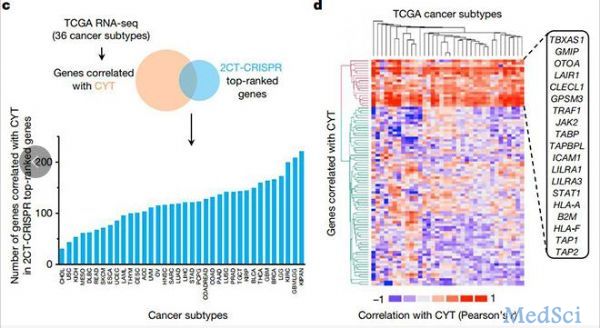
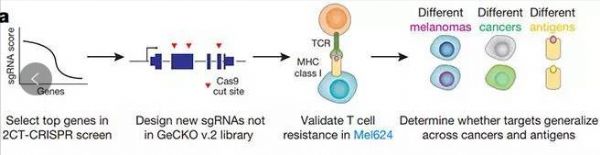
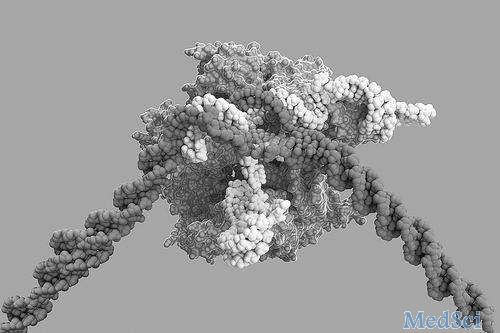
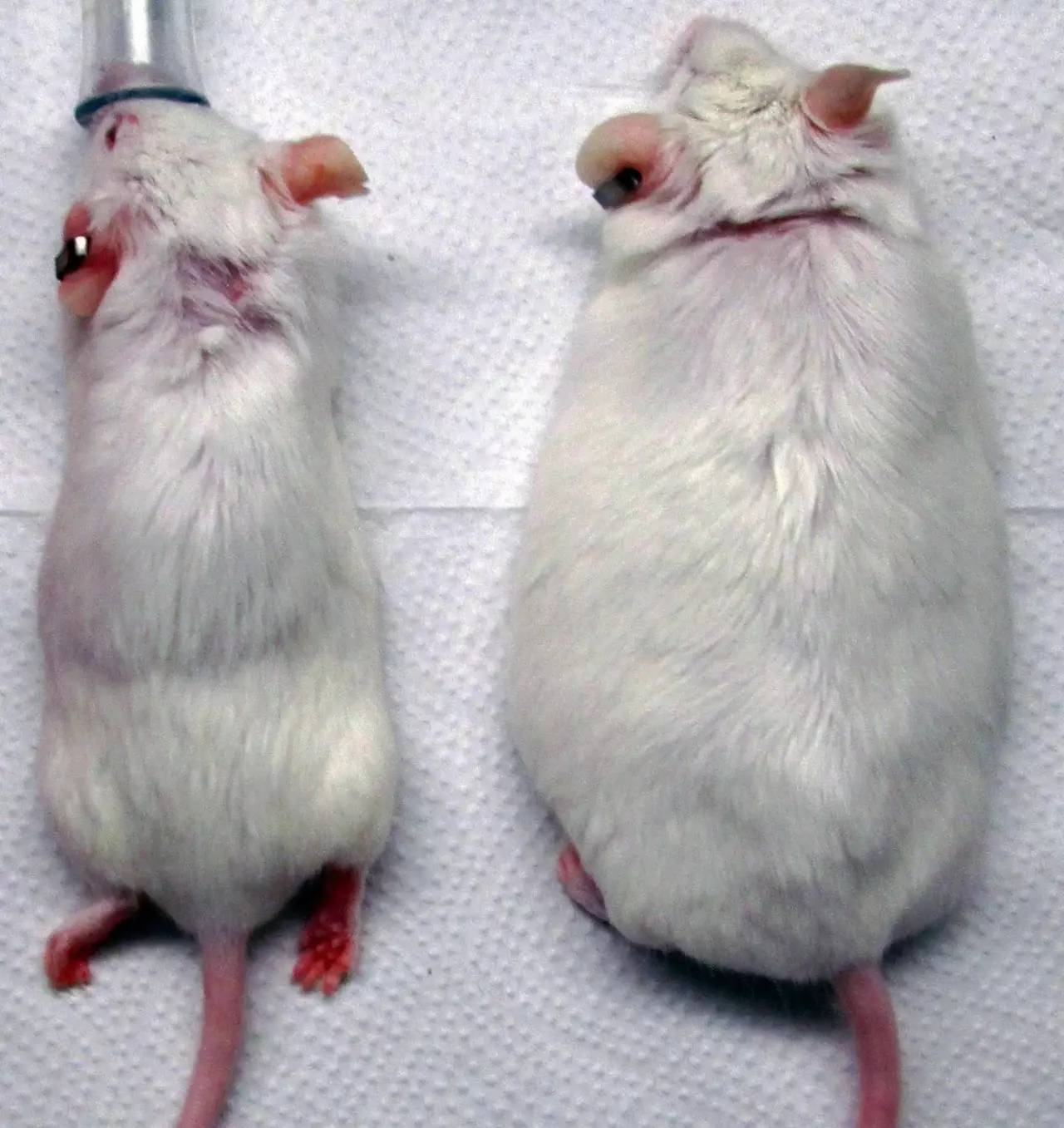
一项8月7日在线发表在Nature上的最新研究确定了在癌细胞中免疫治疗起作用所必需的基因,解决了为什么一些肿瘤对免疫治疗没有反应或最初有反应,但随着肿瘤细胞对免疫疗法出现抗性而停止的问题。该研究是由美国国立癌症研究所Nicholas Restifo博士为首与MIT、哈佛大学和Broad研究院等单位的研究者合作完成的,张锋是参与的作者之一。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
31
#CRISPR#
25