陆军军医大学附属二院Biomaterials:响应型等离子体杂化纳米棒通过铜死亡-光热联合治疗实现肿瘤代谢重编程
2024-11-26 BioMed科技 BioMed科技 发表于陕西省
陆军军医大学团队开发 ACNRs 用于铜死亡 - 光热联合治疗,可重编程肿瘤代谢、激活免疫,对多种肿瘤有效,相关成果发表于 Biomaterials,为癌症治疗提供新思路。
铜死亡与代谢
代谢改变是肿瘤细胞的关键标志之一,这不但能够为肿瘤创造生存条件,同时还会促进免疫抑制环境的形成。靶向干预肿瘤代谢成为癌症治疗的一个有效途径。铜死亡是一种铜浓度依赖的细胞死亡方式,其信号通路不同于凋亡、铁死亡等其他细胞死亡方式,不会产生耐药性,是一种非常有前景的肿瘤治疗方式。铜死亡倾向于发生于线粒体供能细胞,并对三羧酸循环相关代谢产物产生一定影响。基于此,作者推测铜死亡可能会对细胞的代谢产生扰动,并提出“能否通过铜死亡来调控肿瘤代谢”。
光热治疗如何促进铜死亡
研究发现铜死亡疗效受到细胞内铜稳态和铜螯合剂毒性的限制。肿瘤微环境中的维持细胞稳态的谷胱甘肽是一种内源性含巯基的铜螯合剂,消耗内源性谷胱甘肽可增加细胞内铜离子浓度,增强铜死亡疗效。光热治疗可以通过局部升温实现,引发细胞内活性氧(ROS)水平的升高,从而消耗内源性谷胱甘肽。同时,ROS通过增强细胞内氧化应激导致线粒体损伤,从而阻碍ATP的合成,进而影响铜离子转运蛋白(ATP7A)的合成,减少铜离子外排,因此推断光热治疗可以增强铜死亡疗效。
光热-铜死亡联合治疗重塑肿瘤代谢、激活抗肿瘤免疫反应
异常的肿瘤代谢会导致肿瘤生长、转移和复发,重编程肿瘤代谢并激活有效的抗肿瘤免疫反应已被证明对消除肿瘤具有良好的治疗效果。鉴于此,陆军军医大学第二附属医院周春宇研究员和张冬教授课题组开发了一种pH响应型金纳米棒-氧化亚铜核壳结构等离子体杂化纳米棒(AuNRs@Cu2O,ACNRs),其可实现肿瘤微环境响应的铜离子释放和激活的光热特性,用于铜死亡诱导和近红外二区光热的联合治疗。ACNRs响应肿瘤微环境释放铜离子后,其AuNRs核心表现出优异的近红外二区光热特性,协同提高细胞内铜浓度,引发严重的铜死亡并诱导肿瘤细胞的免疫原性细胞死亡。活体研究表明,ACNRs对原发性、转移性和复发性肿瘤均具有良好的治疗效果。ACNRs诱导的铜死亡和光热疗法能够重编程能量代谢,导致乳酸产生减少。这种代谢重编程有助于重塑免疫抑制性肿瘤微环境,促进免疫细胞的浸润并增强由光热疗法触发的免疫反应。代谢组学分析进一步验证了治疗机制,表明铜死亡-光热联合疗法导致肿瘤细胞中磷酸戊糖途径和糖酵解途径的抑制。糖酵解的抑制减少了ATP的合成,从而阻碍了能量依赖性的铜外排,进而促进了铜死亡。综上所述,这项研究为基于铜死亡的癌症治疗提供了有前景的视角,并为未来肿瘤治疗中纳米医学介导的代谢调节提供了新的思路。相关工作以“Responsive Plasmonic Hybrid Nanorods Enables Metabolism Reprogramming via Cuproptosis-Photothermal Combined Cancer Therapy”为题发表在Biomaterials。
【文章要点】
1.ACNRs等离子体杂交纳米棒对原发性、转移性和复发性肿瘤均表现出优异治疗效果。
2.ACNRs诱导的铜死亡联合光热治疗能够重编程能量代谢,导致乳酸产生减少。这种代谢重编程的潜力有助于重塑免疫抑制性肿瘤微环境,以促进免疫细胞的浸润并增强PTT 触发的免疫反应。
3.代谢组学分析表明,ACNRs + PTT 治疗导致肿瘤细胞中磷酸戊糖途径和糖酵解途径受到抑制。糖酵解的抑制减少了ATP合成,从而导致铜离子转运蛋白(ATP7A)合成降低,进而阻碍能量依赖性铜外流,促进铜死亡。
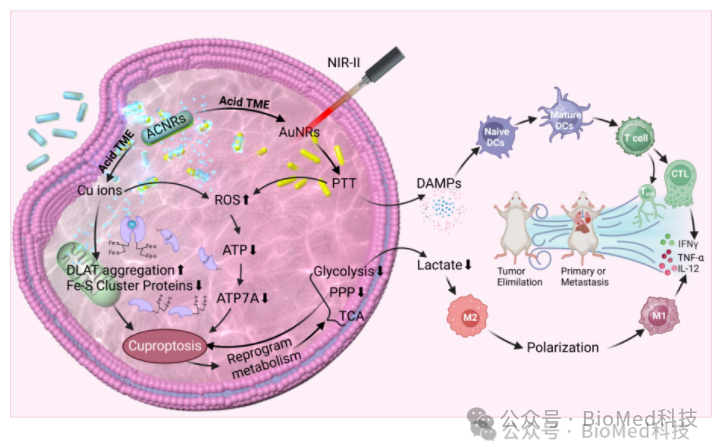
图1 研究示意图:ACNRs通过铜死亡和光热联合治疗实现代谢重编程和免疫应答激活用于原发性、转移性和复发性肿瘤治疗
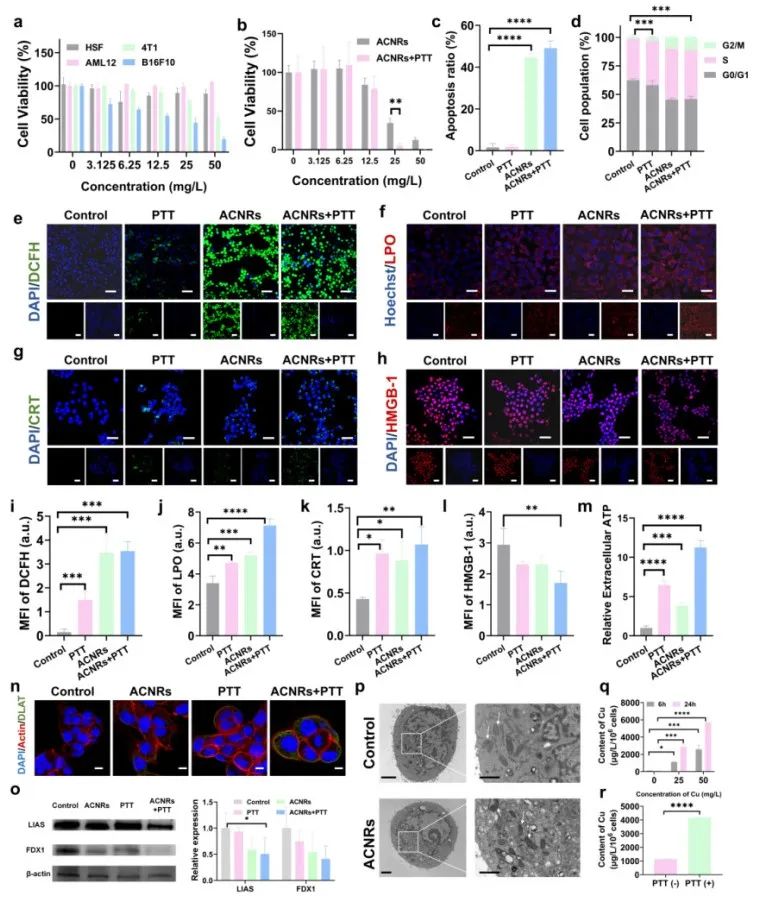
图2 ACNRs体外抗肿瘤性能研究
细胞实验证明联合光热后ACNRs展现出对肿瘤细胞更强的杀伤作用,可导致肿瘤细胞严重的凋亡并将更多细胞阻滞在G2/M期。关于对ACNRs杀伤肿瘤细胞的具体机制探究中,作者通过对活性氧和脂质过氧化的免疫荧光检测,发现ACNRs产生大量的ROS,并使肿瘤细胞发生脂质过氧化。另外,针对铜死亡需要胞内铜浓度升高的关键问题,作者通过ICP检测不同作用时间长度的肿瘤细胞内铜浓度,可以发现铜浓度呈现时间和材料浓度依赖性,因此证明ACNRs升高胞内铜浓度并造成肿瘤细胞铜死亡。
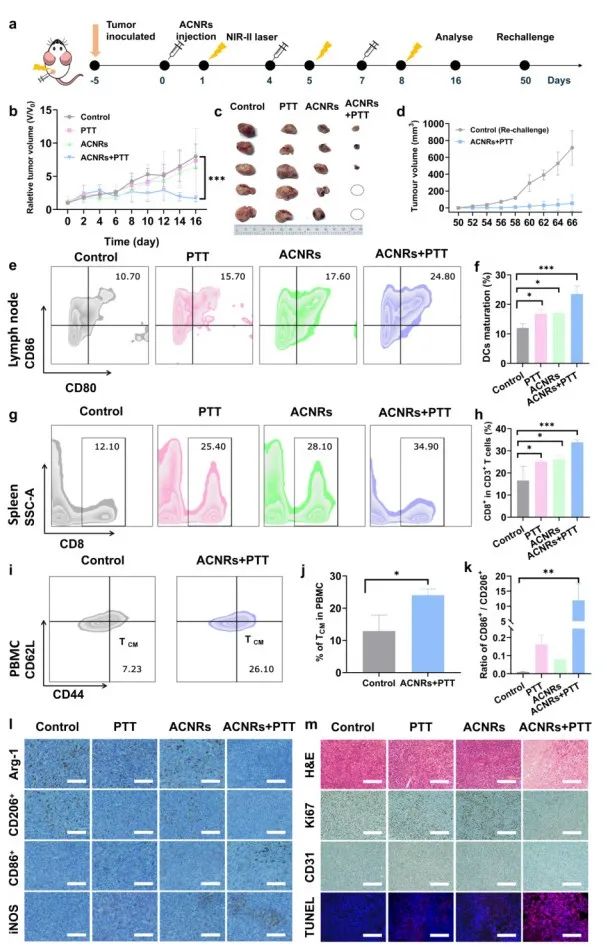
图3 ACNRs对单侧4T1荷瘤小鼠(BALB/c)体内治疗和抗肿瘤免疫学评价
4T1单侧瘤荷瘤小鼠(BALB/c)活体研究表明,联合治疗在活体水平表现出良好的肿瘤抑制作用。流式细胞术研究表明,联合治疗促进树突细胞成熟以及CD8+T细胞的分化增多。在治愈小鼠再挑战实验中,血清中检测出更多记忆T细胞。肿瘤组织免疫组化及免疫荧光等方法研究表明,联合治疗促进M2型巨噬细胞向M1型极化。研究表明联合治疗后产生了更强大的抗肿瘤效果和长期免疫记忆力。
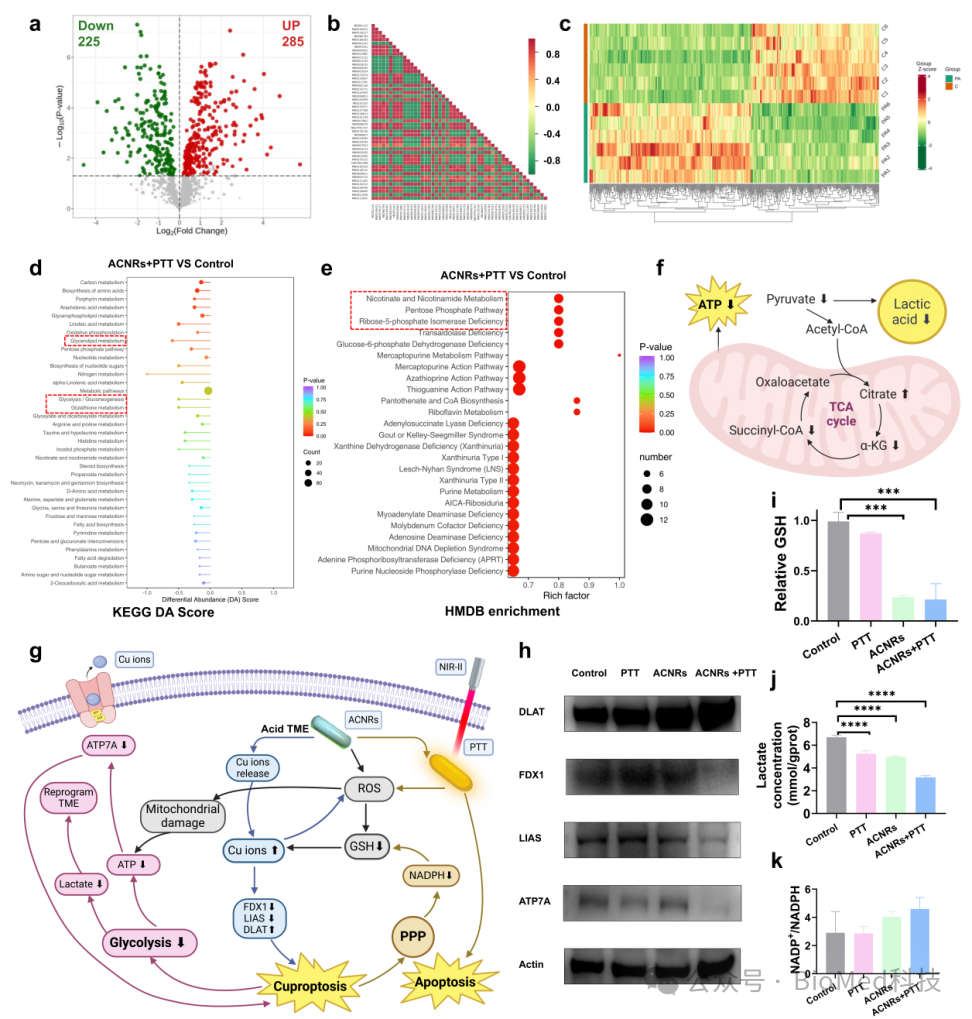
图4 代谢组学分析及实验验证ACNRs + PTT治疗的抗肿瘤机制
通过代谢组学进一步分析联合治疗对肿瘤细胞内代谢的扰动。根据差异代谢物富集,发现联合治疗抑制了肿瘤细胞的糖酵解和磷酸戊糖途径。通过抑制糖酵解,减少乳酸的富集,一定程度上逆转了免疫抑制的肿瘤微环境,另外磷酸戊糖途径的抑制,减少了还原型谷胱甘肽的产生,亦可以增加细胞内游离的铜离子,促进肿瘤发生铜死亡。进一步实验验证了联合治疗的这一抗肿瘤机制。
原文链接:
https://doi.org/10.1016/j.biomaterials.2024.122971
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肿瘤代谢# #光热治疗# #铜死亡#
5