Nature Methods:WHaloCaMP:突破性模块化钙离子指示器助力多重体内功能成像
2024-09-25 生物探索 生物探索 发表于上海
开发 WHaloCaMP 钙离子指示器,结合化学遗传标记与猝灭机制,具高亮度、适合深层组织成像与多重信号监测,在多种动物模型中成功应用,为功能成像提供新工具。
引言
在生物医学成像领域,钙离子(Ca²⁺)作为细胞内重要的信号分子,参与了多种生理过程的调控,尤其是在神经元活动、心脏收缩、细胞分裂等过程中,具有关键作用。为了更好地研究钙信号的动态变化,研究人员开发了多种荧光钙离子指示器。这些指示器能够在细胞内钙离子浓度发生变化时产生荧光信号,帮助研究人员在活体中观察和记录细胞的生理活动。然而,现有的荧光钙指示器大多基于荧光蛋白,发射波长集中在绿色到红色光谱范围内,难以与其他现有的光学工具兼容,且在组织深层成像时信号衰减严重。因此,开发具有更高亮度、可以多重信号成像且适合深层组织成像的指示器成为一个重要的研究方向。
在此背景下,9月20日Nature Methods的研究报道“A modular chemigenetic calcium indicator for multiplexed in vivo functional imaging”,开发了WHaloCaMP,一种模块化化学遗传钙离子指示器。它采用了亮度高的染料配体和蛋白传感器域,通过色氨酸(Tryptophan)诱导的荧光猝灭机制,使钙离子与传感器结合时产生显著的荧光变化。研究团队首先设计并验证了WHaloCaMP的结构和性能,通过定向进化筛选出最优的变体WHaloCaMP1a。这一指示器能够与多种罗丹明染料配体(Rhodamine dye-ligands)兼容,发射波长范围从绿色到近红外(near-infrared),从而能够与现有的绿色和红色荧光探针进行多重成像。此外,由于近红外光的组织散射较少,该指示器特别适合于深层组织的成像应用。
WHaloCaMP的开发为功能成像提供了一个新的强大工具,其在多种动物模型中的成功应用表明其在神经科学研究和其他生物医学领域具有广阔的应用前景。未来的研究还可以进一步优化其性能,并将这一化学遗传指示器技术扩展到更多的生物信号监测中,为体内多重信号动态监测提供新的解决方案。

钙离子(Ca²⁺)是细胞内重要的信号分子,参与多种生理过程,如神经元活动、心脏收缩、细胞增殖等。因此,准确监测钙离子的动态变化对于揭示这些过程的机制至关重要。传统的钙离子指示器依赖于基因编码的荧光蛋白,如GCaMP等。然而,现有的荧光钙指示器在生物利用率、信号强度及组织穿透能力等方面存在局限,尤其是在多重成像时表现不佳。
为了克服这些问题,研究团队开发了WHaloCaMP系列钙离子指示器。这一指示器结合了HaloTag化学遗传标记与色氨酸诱导的荧光猝灭机制,不仅具有较高的荧光亮度,还可以与从绿色到近红外的多种染料配体(Rhodamine dye-ligands)结合,实现深层组织成像和多重生理信号的同时监测。
指示器设计
WHaloCaMP通过工程化的色氨酸位点猝灭机制实现了钙离子的可逆监测。当钙离子与指示器结合时,荧光强度显著增加,研究人员通过定向进化筛选得到了WHaloCaMP1a这一最优变体。
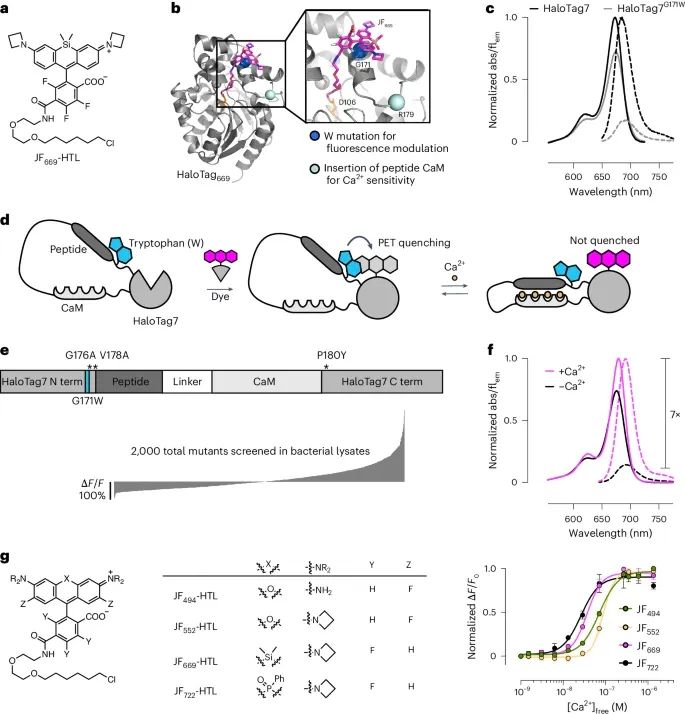
通过色氨酸猝灭机制成功设计并优化了WHaloCaMP1a,可以显著增强其在钙离子结合时的荧光变化,为体内功能成像提供了强大的工具(Credit: Nature Methods)
染料配体JF669-HaloTag的化学结构(图a):展示了用于WHaloCaMP1a指示器的主要染料配体JF669-HaloTag的分子结构。这种染料在近红外范围内发射荧光,用于高效标记神经元。
HaloTag7蛋白与染料配体结合的晶体结构(图b):显示了HaloTag7与JF669-HaloTag配体结合的晶体结构,其中标出了通过定点突变为色氨酸(G171W)的关键位点,这一突变负责猝灭荧光的调控。
光谱变化(图c):展示了突变前后(HaloTag7与HaloTag7G171W突变体)荧光吸收和发射光谱的变化。突变后的色氨酸能够有效猝灭染料的荧光发射,表明猝灭机制的有效性。
WHaloCaMP的结构设计(图d):展示了WHaloCaMP的整体结构示意图,包括钙离子结合部位、色氨酸猝灭机制以及染料配体的共价结合方式。
荧光强度变化的定量分析(图e, f):通过细菌裂解物筛选了约2000个WHaloCaMP1a的变体,最终选出具有最佳荧光响应的变体WHaloCaMP1a。图f显示了WHaloCaMP1a在有无钙离子条件下的吸收和荧光发射光谱,说明了钙离子结合对荧光强度的显著影响。
不同染料配体的钙离子依赖性荧光响应(图g):展示了WHaloCaMP1a与多种染料配体(如JF494、JF552、JF669、JF722)结合后,在钙离子浓度变化下的荧光响应曲线,定量了WHaloCaMP1a对不同染料配体的钙亲和力和荧光变化范围。
体外和体内测试
WHaloCaMP在神经元培养物和脑片中的钙离子成像实验中表现出色。随后,研究团队将WHaloCaMP1a应用于果蝇和小鼠的神经元中,成功报告了这些模型中钙离子的动态变化。此外,在斑马鱼实验中,研究通过WHaloCaMP与其他探针结合,实现了多重成像。
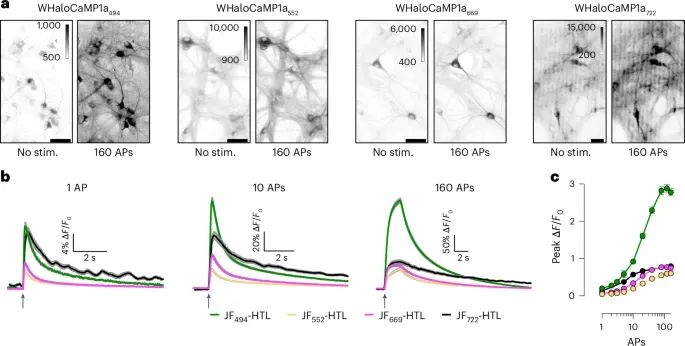
WHaloCaMP1a在培养的神经元中具有良好的性能,能够灵敏地检测钙信号,尤其是在使用不同的染料配体进行标记后,能够准确跟踪动作电位的动态变化(Credit: Nature Methods)
WHaloCaMP1a在培养的神经元中的表达和染料标记(图a):展示了在大鼠海马神经元培养物中,WHaloCaMP1a成功表达并使用不同的染料配体(如JF494、JF552、JF669、JF722)标记后的荧光图像。通过诱导动作电位(AP)进行电刺激,观察到荧光强度的明显变化,表明WHaloCaMP1a对钙信号的灵敏性。
WHaloCaMP1a对动作电位(AP)的荧光响应(图b):展示了WHaloCaMP1a在不同数量的动作电位刺激下的荧光响应。使用不同染料配体(JF494、JF552、JF669、JF722)标记的神经元在单个AP和多个AP刺激下的荧光变化(∆F/F0)得到了清晰的响应结果,显示WHaloCaMP1a能够检测到单个AP和多次AP的变化。
峰值荧光响应与AP数量的关系(图c):展示了不同染料配体标记下的WHaloCaMP1a在神经元中的峰值荧光响应(∆F/F0)与AP数量的关系曲线。结果表明,随着AP数量的增加,荧光响应呈现出明显的上升趋势,尤其是在JF494、JF552、JF669染料配体下,WHaloCaMP1a表现出更强的荧光响应。
荧光寿命成像
该研究的另一亮点在于通过荧光寿命成像显微镜(FLIM)技术,研究团队可以对细胞内钙离子浓度进行定量。FLIM技术利用WHaloCaMP1a的荧光寿命变化,进一步提高了钙离子信号的检测精度,并能通过时间分辨技术捕捉快速的钙离子变化。
亮度与灵敏度提升
WHaloCaMP1a在绑定近红外染料JF669时,荧光强度增加了7倍,荧光寿命延长了2.1纳秒。与现有的红色钙指示器jGCaMP8s相比,WHaloCaMP1a的亮度提高了2倍。此外,WHaloCaMP1a在钙离子动态检测中的性能优于现有的钙指示器,尤其是在深层组织成像中表现出色。
体内应用
研究团队在果蝇和小鼠模型中应用WHaloCaMP1a成功监测了嗅觉刺激下果蝇菇状体神经元的钙信号变化。同时,在小鼠视觉皮层中,WHaloCaMP1a能够检测到不同方向运动刺激引发的钙离子动态,单次实验中钙荧光变化达到了35%。
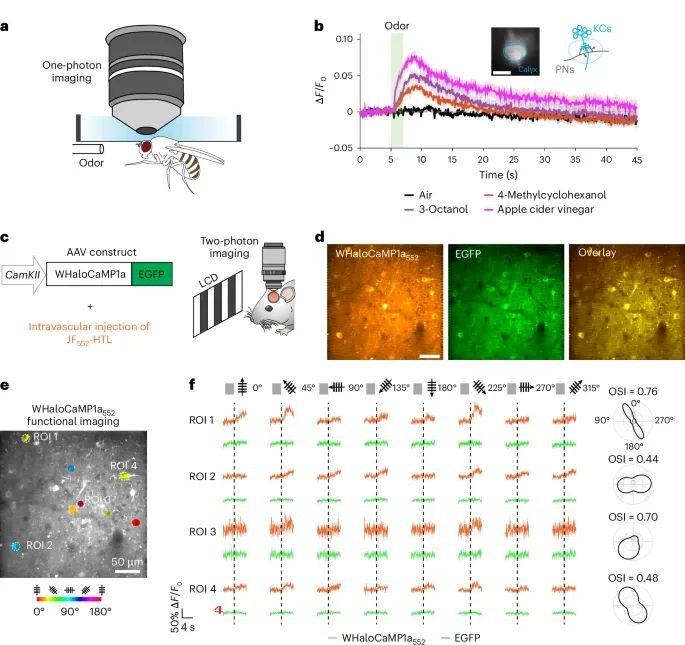
WHaloCaMP1a能够成功报告果蝇和小鼠神经元的钙离子动态变化,能够检测到神经元对不同类型感官刺激(如嗅觉和视觉刺激)的灵敏响应(Credit: Nature Methods)
果蝇中的WHaloCaMP1a应用(图a, b):研究团队在果蝇的菇状体(mushroom body)Kenyon细胞(KCs)中表达了WHaloCaMP1a,并通过头部固定的果蝇进行单光子荧光成像。通过在果蝇头部的胶质腔中打开一个小窗口并用JF669-HaloTag染料标记WHaloCaMP1a,展示了在呈现苹果醋和化学气味刺激时,WHaloCaMP1a荧光强度的显著增加。每次嗅觉刺激后,KCs中的钙离子响应表现出显著的荧光上升,表明WHaloCaMP1a能够灵敏检测到果蝇神经元对嗅觉刺激的钙信号变化。
小鼠视觉皮层中的WHaloCaMP1a应用(图c, d):在小鼠的视觉皮层(V1)中,通过腺相关病毒(AAV)介导的基因传递表达WHaloCaMP1a,并使用JF552-HaloTag染料通过静脉注射进行标记。研究展示了通过两光子成像记录的视觉刺激引发的神经元钙离子响应。图d展示了视觉皮层中的神经元在标记WHaloCaMP1a后,荧光信号强度的显著变化,证明了WHaloCaMP1a在小鼠体内的应用效果。
方向选择性的成像结果(图e, f):研究进一步展示了小鼠视觉皮层中,神经元对不同方向的视觉刺激(如移动条纹)的方向选择性反应。WHaloCaMP1a的功能成像清晰地显示了神经元的方向选择性指数(OSI),表明其对不同视觉方向刺激的差异响应。图f展示了多个感兴趣区域(ROIs)的荧光强度变化,验证了该工具在多神经元同时成像中的有效性。
多重成像与深层组织应用
在斑马鱼中,WHaloCaMP成功与其他探针(如红色和绿色探针)结合,实现了多色成像。通过三色多重功能成像,研究团队能够同时监测钙离子、葡萄糖等多种生理信号,这种多色成像特别适用于神经科学研究。
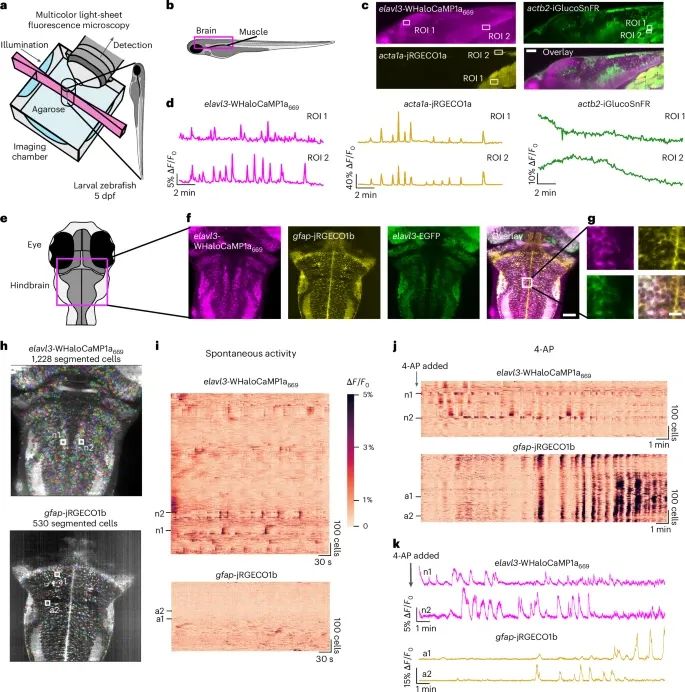
WHaloCaMP1a与其他荧光探针结合,能够在斑马鱼中实现三色多重功能成像,不仅可以监测神经元和星形胶质细胞的活动,还可以记录钙和葡萄糖等不同生理信号的变化(Credit: Nature Methods)
三色多重成像设置(图a, b):研究团队使用光片显微镜对斑马鱼幼体进行了三色多重成像。图a展示了实验设置,使用多色光片荧光显微镜对斑马鱼的脑、肌肉和眼部进行成像。图b示意了斑马鱼的成像视角,重点展示了三个信号通道的同时监测,包括神经元中的钙离子信号、肌肉中的钙信号以及葡萄糖的变化。
三种不同的荧光探针成像(图c):在斑马鱼神经元中表达了WHaloCaMP1a,在肌肉中表达了红色荧光钙指示器jRGECO1a,同时通过β-肌动蛋白启动子表达绿色的葡萄糖传感器iGlucoSnFR。图c展示了三个不同的生理信号在同一平面上的多重成像结果,清晰显示了钙离子和葡萄糖信号在不同组织中的分布情况。
神经元和肌肉的钙信号动态(图d):通过WHaloCaMP1a和jRGECO1a,研究展示了斑马鱼后脑神经元和肌肉中的钙信号动态变化。图中记录了神经元中的钙离子瞬变和肌肉中的钙离子瞬变,表明两者之间的钙信号在特定区域存在相关性,但在其他脑区,如视顶盖,未观察到类似相关性。
神经元和星形胶质细胞的活动(图e, f):研究进一步展示了斑马鱼神经元和星形胶质细胞的钙信号活动。在神经元中表达WHaloCaMP1a,在星形胶质细胞中表达红色荧光钙指示器jRGECO1b。图f展示了后脑区域的单细胞分辨率图像,清晰地显示了两个细胞类型的活动。
自发活动和药物诱导的变化(图g, h, i):研究通过光片显微镜和计算方法(如Suite2p和Cellpose)对超过1000个神经元和数百个星形胶质细胞的自发活动进行了功能成像和分割。图i展示了神经元和星形胶质细胞在自发脑活动中的光栅图。研究还通过钾通道阻断剂4-AP诱导癫痫样状态,发现后脑神经元的活动模式丧失,而星形胶质细胞出现了明显的钙波活动(图j, k),这些钙波与神经元活动明确区分。
荧光寿命定量分析
FLIM技术被成功应用于HeLa细胞和斑马鱼前脑神经元中。研究显示WHaloCaMP1a不仅能定量细胞内钙离子浓度,还能够提供单细胞分辨率下的钙离子变化图像。
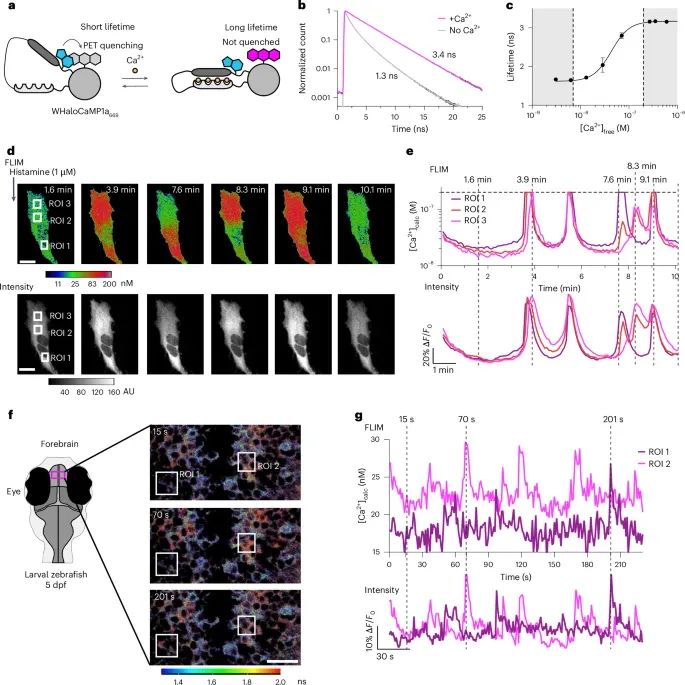
WHaloCaMP1a作为FLIM探针在钙离子浓度的定量测量中具有显著优势,不仅能够在细胞水平精确测量钙信号,还能够通过FLIM技术进行活体动物中的动态监测(Credit: Nature Methods)
WHaloCaMP1a的荧光寿命成像原理(图a):展示了WHaloCaMP1a作为FLIM(荧光寿命成像显微镜)探针的原理图。色氨酸诱导的猝灭机制调控了荧光寿命的变化,WHaloCaMP1a在钙离子存在与否的情况下表现出不同的荧光寿命。
WHaloCaMP1a的荧光寿命变化(图b):展示了WHaloCaMP1a在有钙离子和无钙离子的情况下荧光寿命的变化。无钙时,WHaloCaMP1a的荧光寿命为1.3纳秒,而在钙饱和条件下,荧光寿命延长至3.4纳秒,表明其对钙离子的敏感性。
钙离子浓度校准曲线(图c):研究建立了WHaloCaMP1a的荧光寿命与钙离子浓度之间的校准曲线。该曲线通过纯化蛋白和HeLa细胞实验得出,展示了WHaloCaMP1a在不同钙浓度下的荧光寿命变化范围,能够精确测量纳摩尔级的钙浓度。
HeLa细胞中的钙离子测量(图d, e):研究团队在HeLa细胞中通过FLIM探针实时监测钙离子浓度变化。图d展示了在组胺刺激下HeLa细胞中的钙离子浓度伪彩色图像,钙浓度通过荧光寿命的校准曲线进行定量。图e展示了钙离子浓度和荧光强度随时间的变化曲线,证实WHaloCaMP1a能够检测到组胺诱导的钙信号振荡,精确度可达7纳摩尔。
斑马鱼幼体中的钙离子成像(图f, g):研究进一步展示了WHaloCaMP1a在斑马鱼前脑神经元中的应用。图f展示了通过FLIM对活体斑马鱼幼体进行成像,能够实时监测前脑神经元中的钙离子浓度变化,图中展示了钙离子浓度和荧光寿命的伪彩色图像。图g展示了两个神经元中钙离子浓度和荧光强度随时间的变化,表明FLIM技术可以实现单细胞分辨率下的钙浓度定量。
WHaloCaMP1a的开发为多重体内成像提供了一个强大工具,其在果蝇、小鼠及斑马鱼中的成功应用表明,这一工具具有广泛的应用前景。未来的研究可能进一步优化该工具,扩展其在更多生理信号监测中的应用,特别是在复杂体内环境中的多重功能成像。这一研究为钙离子动态变化的定量分析和多重成像提供了新的解决方案。
参考文献
Farrants H, Shuai Y, Lemon WC, Monroy Hernandez C, Zhang D, Yang S, Patel R, Qiao G, Frei MS, Plutkis SE, Grimm JB, Hanson TL, Tomaska F, Turner GC, Stringer C, Keller PJ, Beyene AG, Chen Y, Liang Y, Lavis LD, Schreiter ER. A modular chemigenetic calcium indicator for multiplexed in vivo functional imaging. Nat Methods. 2024 Sep 20. doi: 10.1038/s41592-024-02411-6. Epub ahead of print. PMID: 39304767.
https://www.nature.com/articles/s41592-024-02411-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#钙离子指示器# #WHaloCaMP#
74