弥漫性大 B 细胞淋巴瘤 (DLBCL) 是一种异质性疾病,5年总生存率 (OS) 介于Ⅰ期的79.5%到Ⅳ期的54.7%,中位5年 OS 为64.6%。尽管2/3的 DLBCL 患者可通过一线免疫化疗(如R-CHOP)治愈,但仍有高达30%-40%的患者在前期治疗期间或结束时发生疾病进展(即原发性难治)或在初始缓解后复发。复发/难治性 (R/R) DLBCL 的治疗曾经一直是挽救性化疗,随后自体干细胞移植 (ASCT)。尽管 ASCT 有可能治愈,但原发难治性或早期复发性疾病患者的 ASCT 成功率往往达不到相同水平。
适合移植和不适合移植的 R/R DLBCL 患者已有多种新药出现,可提供毒性可控的更有效选择。《ASCO Educational Book》发表的一篇综述概述了这些进展,并强调了治疗原发难治和早期复发(高危R/R)DLBCL患者的拟定策略。

•尽管大多数弥漫性大 B 细胞淋巴瘤患者可通过一线免疫化疗治愈,但仍有30%-40%的患者复发。自体干细胞移植可提供持久缓解的第二次机会,但原发难治和早期复发DLBCL的结局仍极差。
•基于随机对照试验,axicabtagene ciloleucel或lisocabtagene maraleucel (liso-cel)等CAR T细胞疗法目前是医学上fit的原发难治和早期复发患者的推荐二线治疗。
•对于unfit的复发/难治性 DLBCL 患者,建议使用 liso-cel 治疗(如适用),如果不适合则参加临床试验使用双特异性 T 细胞衔接抗体 (BITE) 等治疗,或使用获批药物治疗,如 tafasitamab联合来那度胺、维泊妥珠单抗联合苯达莫司汀和利妥昔单抗、R-GemOx、或loncastuximab tesirine。
•DLBCL仍有许多值得探索的领域,包括优化桥接治疗的选择、治疗排序(如 CAR T 细胞和 BITE 治疗),以及在等待 CAR T 细胞治疗期间挽救性化疗获得完全缓解的患者何时治疗。

1995年发表的一项 III 期研究中,ASCT 的5年无事件生存率 (EFS) (46% vs.12%) 和 OS 率 (53% vs.32%) 均优于单独挽救性化疗,从而巩固了 ASCT 作为二线复发DLBCL 患者和难治性患者标准治疗的作用,尽管未对该组进行专门研究。随后的CORAL和 LY12 III 期研究探索了不同的挽救性化疗方案,其中部分方案联合利妥昔单抗,如利妥昔单抗、异环磷酰胺、卡铂和依托泊苷,R-DHAP以及吉西他滨、地塞米松和顺铂,并证实所有挽救性方案的疗效相似。
CORAL和 LY12的重要发现在于,原发难治疾病或诊断后12个月内复发的患者结局显著劣于12个月后复发的患者。CORAL 研究强调,既往暴露于利妥昔单抗、诊断后12个月内R/R的R/DLBCL 患者结局不佳,3年无进展生存期 (PFS) 仅23%。
REFINE 研究进一步深入探讨了为什么利妥昔单抗时代的患者可能出现初始治疗失败。在这项近300例患者的多中心回顾性研究中,超高危特征定义为在一线治疗期间发生原发性进展(定义为在免疫化疗期间或完成免疫化疗后6周内通过临床或放射学评估确定疾病进展)、初次治疗失败时NCCN-IPI中高危或高危、或 MYC 易位。整个队列中具有超高危特征的患者预测2年总生存率 (OS) 为13.6%;在132例行 ASCT 的患者中,2年 OS 与高危特征的数量直接相关,无超高危特征的患者 OS 为74.3%,有2~3个超高危特征的患者 OS 仅10.7%,
另一项117例患者的多中心回顾性研究评估了双打击(定义为 CMYC 和 BCL2 或 BCL6 基因重排)和双表达(定义为 CMYC 和 BCL2 蛋白过表达)状态对 R/R DLBCL 患者 ASCT 结局的影响。双打击和双表达淋巴瘤均与 PFS 不良相关,双打击淋巴瘤与移植后 OS 不良相关。值得注意的是,对于双打击患者,4年 PFS 和 OS 分别仅为28%和25%,而同时存在双表达和双打击的4年 PFS 为0%。
国际、多队列SCHOLAR-1研究回顾性评价了难治性 DLBCL 患者的结局,表明原发难治、对≥两线治疗难治或在 ASCT 后1年内复发的患者对下一线治疗的总缓解率 (ORR) 为26%(CR,7%),中位 OS 为6.3个月,仅20%的患者在2年后存活。
因此对于部分 R/R DLBCL 患者,ASCT可能是潜在的治愈方法;但高危亚组(如原发难治患者、早期复发患者以及符合 REFINE 研究超高危因素和双打击基因重排的患者)需要不同的治疗方式。

CD19 CAR T 细胞治疗是一种新型治疗策略,可改善复发性淋巴瘤患者的结局。等待 CAR T 细胞治疗的患者可能需要桥接治疗,桥接治疗通常包括糖皮质激素或额外的化疗,以维持疾病控制直至产品生产。CAR T 细胞输注前患者需要接受清淋化疗,通常为氟达拉滨和环磷酰胺。基于 II 期关键研究,FDA已批准3种 CAR-T 产品用于R/R LBCL(大 B 细胞淋巴瘤)的三线治疗,即axicabtagene ciloleucel (axi-cel), lisocabtagene maraleucel (liso-cel)和tisagenlecleucel (tisa-cel),均证实了极佳的缓解和持久的 PFS 和OS。ZUMA-1 研究入组了111例 R/R LBCL 患者,91%接受了 axi-cel 给药;ORR 为82%,CR率为54%,18个月 OS 为52%。TRANSCEND研究入组了344例 R/R LBCL 患者以评估 liso-cel 治疗的疗效和安全性,78.2%接受了至少一剂liso-cel;ORR 为74%,CR率为54%;随访17.5个月后中位 OS 为21.1个月。JULIET 研究入组了93例 R/R DLBCL 患者,所有患者均接受了 tisa-cel 治疗;ORR 为52%,CR率为40%。
ZUMA-1研究4 年随访的长期结果表明,中位 OS 为25.8个月,4年 OS 率为44%,提示 R/R DLBCL 部分患者可能治愈。JULIET中位随访40.3个月时,ORR为53%,39%的患者达到CR。这些研究证明了CAR T 细胞治疗作为 R/R DLBCL 患者三线治疗的安全性、疗效以及缓解持久性。鉴于大量既往多线治疗的 DLBCL 患者在接受 CAR T 细胞治疗后获得了持久缓解,故探索 CAR T 细胞治疗在二线高危 R/R DLBCL 中的疗效和安全性有重要意义,从而为 DLBCL 的治疗带来模式转变。
ZUMA-1、TRANSCEND和 JULIET 证明了 CART 细胞治疗在≥2线治疗后的获益,另外3项关键 III 期研究ZUMA-7、TRANSFORM和 BELINDA ,分别探索了axi-cel、liso-cel和tisa-cel二线治疗适合移植的原发难治和早期复发(高危R/R)DLBCL患者,并对比标准挽救性化疗后大剂量化疗和ASCT。ZUMA-7和 TRANSFORM 达到了其 EFS 的主要终点,并证明了 CAR T 细胞治疗与 ASCT 相比在可管理的毒性方面的优效性,但BELINDA 未显示 CAR T 细胞治疗优于SOC。表1概述了这三项临床试验的关键特征。
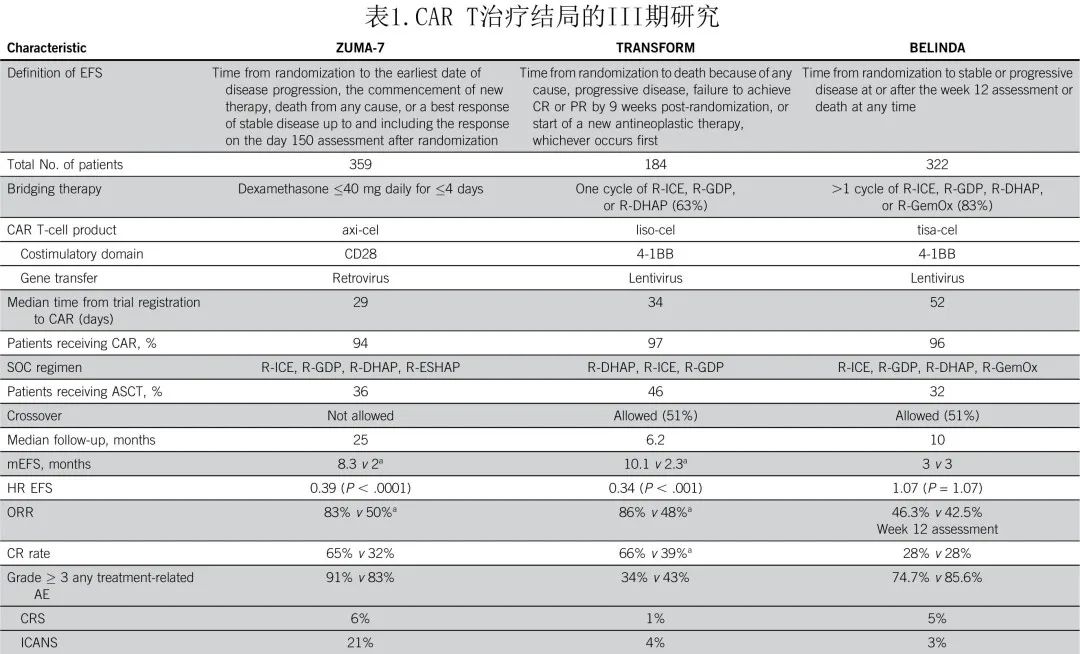
ZUMA-7 和 TRANSFORM 研究显示,与 SOC 相比axi-cel和 liso-cel 的疗效非常相似。中位随访时间为24.9个月,axi-cel治疗获得了优于 SOC 的EFS(8.3个月vs.2个月)、ORR (83% vs.50%) 和CR(65% vs.32%)。在 TRANSFORM 研究中,与 SOC 组(2.3个月)相比,liso-cel组(10.1个月)的主要终点 EFS 显著改善;且Liso-cel治疗的 CR 更高 (66% v 39%)、中位缓解持续时间更长(未达到v 14.5个月);PFS 获得统计学显著改善(分层风险比 [HR]=0.41;95%CI,0.25-0.66;P=0.0001);并且中位随访17.5个月时的主要分析继续显示liso-cel的结局优于SOC。两项研究中CAR T细胞治疗组和 SOC 组的不良事件相似,但 CAR T 组的中性粒细胞减少症更多,但并不意味着发热性中性粒细胞减少症的发生率更高。关于特别关注的毒性,在 ZUMA-7 研究中分别有6%和21%的受试者发生≥3级细胞因子释放综合征 (CRS) 和神经毒性 (NT),而TRANSFORM 研究分别有1%和4%。
上述数据导致 FDA 于2022年批准 axi-cel 和 liso-cel 用于原发难治和早期复发大细胞淋巴瘤患者的二线治疗。经历了近25年的次优结局,CAR-T细胞治疗现在是高危 R/R DLBCL 患者的新标准治疗。
上述研究的一个关键入选标准是 SOC 组中的患者必须在医学上适合ASCT。鉴于很大比例的 R/R DLBCL 患者可能因年龄或医学合并症而不适合移植,因此需要了解不适合移植R/R DLBCL患者的理想治疗方法。PILOT 研究是一项研究 liso-cel 疗效的 II 期研究,招募了不适合 ASCT 的 R/R DLBCL 患者,具体而言患者必须符合以下标准之一:年龄≥70岁, ECOG体能状态评分为2,既往接受含蒽环类药物和 CD20 靶向药物的一线治疗,肺弥散量≤60%,LVEF≤50%,肌酐清除率60 mL/min,或转氨酶为正常值上限的2倍以上。74例患者接受了白细胞单采,其中61例接受了 liso-cel 治疗。基线中位年龄74岁,26%的 ECOG 为2,42%的年龄校正 IPI 评分为2;54%的患者为难治性疾病,21%在一线治疗1年内复发,25%在一线治疗12个月后复发。主要终点为ORR。中位随访12.3个月,ORR为80%(P<0.0001),CR率为54%;中位 PFS 为9.03个月,EFS为7.23个月。达到 CR 的患者中位 PFS 为22.60个月,EFS为22.60个月。细胞因子释放综合征占38%,NT占31%,但多为低级别。未报告4-5级CRS/NT。治疗相关不良事件与既往报告的相似,无研究相关死亡。PILOT 证明,对于不适合移植的 R/R DLBCL 患者,liso-cel是一种有效的时间限制性选择。
尽管对早期复发和原发难unfit DLBCL 患者的建议是使用liso-cel,但并非所有医生和患者均可因各种原因获得该治疗(包括桥接治疗、生产时间、单采槽的可用性、CAR-T中心的可用性、缺乏护理人员)。对于无法获得 CAR T 细胞治疗的不适合移植的患者,建议尽可能参加临床试验。如果临床试验不可用,则可以考虑其他已批准的 R/R DLBCL 治疗方案,如 tafasitamab 联合来那度胺、维泊妥珠单抗联合苯达莫司汀和利妥昔单抗 (pola-BR)、R-GemOx或loncastuximab tesirine(表2)。这些治疗的数据综述如下。
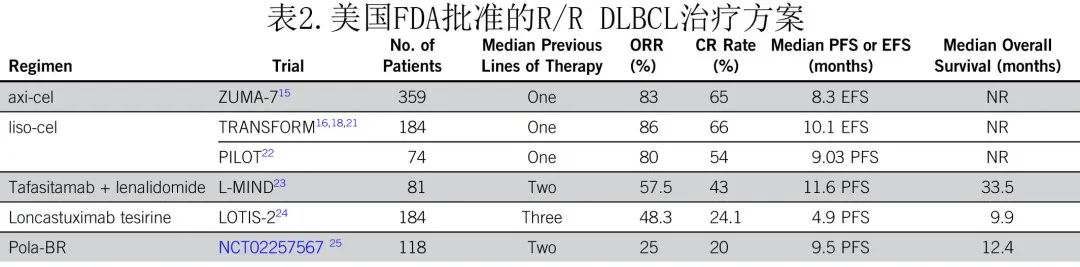
L-MIND 研究纳入不适合 ASCT 的 R/R DLBCL 患者,给予人源化抗 CD19 单克隆抗体tafasitamab(12 mg/kg每周一次,共3个周期,每个周期28天,然后每14天一次直至疾病进展)联合来那度胺(25 mg每日一次,28天为1周期,第1-21天,共12个周期)作为二线治疗。最初招募开始时排除了原发难治患者,定义为一线治疗3个月内无缓解或疾病进展。81例患者入组,56%的患者年龄大于70岁;75%的患者为 III-IV 期疾病,51%的患者 IPI 评分为3;92%的患者 ECOG 为0-1;18.5%的患者为原发难治,41.3%为利妥昔单抗难治性,43.8%为末线治疗难治。中位随访35个月,ORR为57.5%,CR率为43%,中位 PFS 为11.6个月,中位 OS 为33.5个月。达到 CR 的患者中位 PFS 和中位OS均未达到。最常见的≥3级治疗相关不良事件为中性粒细胞减少 (49.4%)、血小板减少 (17.3%) 和发热性中性粒细胞减少 (12.3%)。
维泊妥珠单抗是一种 CD79b 靶向抗体-药物偶联物,一项 Ib/II 期研究在不适合 ASCT 的 R/R DLBCL 患者中比较了 pola-BR 与 BR(既往研究中单用 BR治疗该患者人群的中位 PFS 为3.6-6.7个月)。该研究纳入了既往至少接受过一线治疗的118例 R/R DLBCL 患者,其中67例接受 pola-BR 治疗。pola-BR 组82.5%患者的 ECOG 为0-1分,中位年龄为67岁,45%患者既往接受过≥3线治疗;25%的患者既往 ASCT 失败,30%的患者既往治疗缓解不充分。在中位随访22.3个月后,pola-BR组的 PFS 为9.5个月,而 BR 组为3.7个月(HR=0.36;95%CI,0.21-0.63;P<0.001),OS也显著改善,pola-BR患者存活12.4个月,BR患者存活4.7个月(HR=0.42;95%CI,0.24~0.75;P=0.002)。
一项纳入196例不适合移植的 R/R DLBCL 患者的回顾性审查发现 R-GemOx 是一种有前景且耐受性良好的方案,该研究纳入患者为治疗期间疾病进展或稳定,或在末次治疗后1年内复发/进展,但未详细说明原发难治和早期复发之间的分类。中位年龄为72岁,63%的患者 IPI 评分为3,16%的患者接受过ASCT;58%接受 R-GemOx 作为二线治疗,23%接受 R-GemOx 作为三线治疗,19%接受 R-GemOx 作为≥四线治疗。中位随访时间为22个月时,33%的患者达到CR,中位 PFS 为5个月,中位 OS 为10个月。根据 R-GemOx 是否在二线或后续治疗给药,PFS或 OS 均无统计学显著差异。
Loncastuximab tesirine 是一种抗体-药物偶联物,由人源化抗 CD19 抗体与细胞毒性烷化剂SG3199.14偶联组成,后者被表达 CD19 的 B 细胞内化,然后递送有效载荷,引起链间 DNA 交联,阻止 DNA 复制引起细胞凋亡。II 期 LOTIS-2 研究入组了接受≥二线治疗或原发难治DLBCL患者。在入组的184例患者中,39%为原发难治,24%在一线治疗3个月内复发,39%在一线治疗6个月内复发。中位年龄为66岁,10%为双打击或三打击DLBCL。ORR 为48.3%,CR 率为24.1%,中位 PFS 为4.9个月,中位 OS 为9.9个月;达到 CR 的患者中,数据截止时57%仍为CR。
在 CAR T 细胞疗法获批为二线疗法后,对于挽救化疗显示缓解 (CR/PR) 的高危 R/R DLBCL 患者中ASCT是否已经成为过去时的问题,许多专家一直存在争议。由于这些亚组的化疗敏感率历来较差,探索 CAR-T 与 ASCT 试验的研究都是在开始挽救治疗前随机分配患者,因此并非旨在回答这个问题。基于前面概述的数据,可以认为符合 REFINE 标准的原发难治、超高危和双打击淋巴瘤患者(即使化疗敏感)似乎无法从 ASCT 中获益。
然而早期复发DLBCL 的最佳策略仍不清楚,有支持 CAR T 细胞治疗,也有建议对化疗敏感患者进行ASCT。一项国际血液和骨髓移植研究中心 (CIBMTR) 登记研究的回顾性审查中,在挽救性化疗后部分缓解的 DLBCL 患者中比较了 ASCT 与 CAR T 细胞治疗的疗效,共411例早期复发DLBCL 患者(早期复发定义为初次诊断后1年内复发或进展),266例在部分缓解期间接受ASCT、145例接受CAR T 细胞治疗。PR 期间接受 ASCT 的患者的2年 PFS 为52%,接受 CAR T 细胞治疗的患者为42%(P=0.05); 2年 OS 率分别为69%和47%(P=0.004);在1年 (34% v 45%) 和2年 (40% v 52%) 随访时,ASCT组的复发或进展率均低于 CAR T 细胞组。但ASCT患者的既往治疗程度低于 CAR T 患者,且作为回顾性综述,也存在死亡率时间偏倚。TRANSFORM研究还检查了交叉至 liso-cel 治疗的患者的EFS,在46例交叉患者中10例曾接受ASCT,中位随访4.1个月时,EFS为3.4个月,ORR为48%,CR率为39%,OS为7.8个月。这表明尽管 liso-cel 有效,但与二线治疗相比,其用于三线治疗时的疗效不太明显。
另一个尚未回答的问题是,如果患者计划接受 CAR T 细胞治疗,但挽救治疗后处于 CR 状态,该患者是否仍应接受CAR T?在对8家学术中心接受 axi-cel 或 tisa-cel 治疗的 DLBCL 患者进行的回顾性审查中发现,在364例接受 CAR T 细胞治疗的患者中,33例患者是在CR接受治疗(9例axi-cel,24例tisa-cel),其中26例在白细胞单采时有可测量疾病,并在桥接治疗后达到CR,大多数患者接受了全身治疗(20例患者)。中位随访16个月,39.3%的患者复发,患者的1年 EFS 和 OS 分别为59.6%和81.3%,表明即使在 T 细胞输注时达到 CR 的患者中,CAR T细胞治疗仍是有效的治疗。此外该患者亚组中 CRS 和 ICANS 的发生率远低于 CAR T 细胞治疗时有残留病灶的患者,证实了在该人群中的安全性。这也得到了 TRANSFORM 的支持,因为有9例患者在 lisocel 输注时达到CR,并显示有利结局。
在获得更好的预测工具确定化疗敏感性之前,建议将 CAR T 细胞治疗作为原发难治和早期复发 DLBCL 患者的二线治疗;但如果患者无法获得 CAR T 细胞治疗或在挽救治疗达到 CR/PR 后正在接受巩固治疗评估,则在早期复发 DLBCL 中考虑 ASCT 是合理的。
通常R/R患者需要及时治疗,但 CAR T 细胞的平均产生时间为3-4周,这种治疗延迟使得建立最佳桥接治疗非常重要;一般为类固醇、挽救性化疗 (RICE、R-GemOX、RDHAP) 或维泊妥珠单抗,且倾向于与利妥昔单抗联合治疗。但这一方案可能会随着 POLARIX 研究而改变,该研究比较了未经治疗的 DLBCL 患者中R-CHOP 与pola-R-CHP一线治疗。中位随访28.2个月,pola-R-CHP患者更有可能存活且无进展 (76.7% v 70.2%),但两组的2年 OS 无显著差异 (88.7% v 88.6%)。如果 pola-R-CHP 获批用于中高危 DLBCL 的一线治疗,可能导致其无法用作桥接药物,因此还需要更多的研究来确定理想的桥接策略。
尽管 CAR T 细胞治疗似乎有希望用于 R/R DLBCL 的治疗,但可能规避生产和成本问题的新策略正在探索中。靶向 CD20 的双特异性 T 细胞衔接抗体 (BITE) 是已证明极佳结果的现成疗法,目前在临床试验中的 BITE 至少有4种,包括mosunetuzumab、glofitamab、epcoritamab和odronextamab,其中 glofitamab 和 epcoritamab 在 R/R DLBCL 中具有最成熟的数据。
Glofitamab一项包含171例接受过至少一线治疗且无其他治疗选择的 NHL 患者的 I 期试验中,42.7%的患者为DLBCL,中位年龄为64岁,患者平均既往接受过3线治疗。对于具有侵袭性 NHL 组织学的患者,ORR为48%,CR率为33.1%。所有患者中有50.3%发生CRS,大多数患者发生1级 (21.6%) 或2级 (25.1%)CRS。在 II 期试验中,患者接受 glofitamab 治疗12个周期或直至疾病进展,在中位随访12.6个月的154例患者队列中,39%的患者达到CR,中位至 CR 时间为42天,12个月时78%的患者仍在 CR,12个月 PFS 为37%。最近的数据表明,glofitamab的时间限制性治疗可使复发性 DLBCL 患者获得持久的CR。在接受 glofitamab 治疗1年、中位随访期为18.1个月的61例强化预治疗 DLBCL 患者中,大多数患者(45例)可保持 CR。
Epcoritamab的一项 I/II 期研究招募了157例不适合 ASCT 的接受过≥二线治疗的 DLBCL 或其他侵袭性 NHL 患者。患者接受了中位三线治疗,61.1%的患者原发难治,75.8%的患者对≥两线治疗难治;38.9%的患者既往接受过 CAR T 细胞治疗。ORR 为63.1%,CR率为38.9%;总体而言epcoritamab可耐受,最常见的不良事件为CRS(49.7%)、注射部位反应 (19.7%) 和中性粒细胞减少症 (17.8%)。虽然仍需进一步研究以比较 BITE 与标准治疗,但它们有望成为不适合移植或 CAR T 细胞治疗的 DLBCL 患者的现成选择。
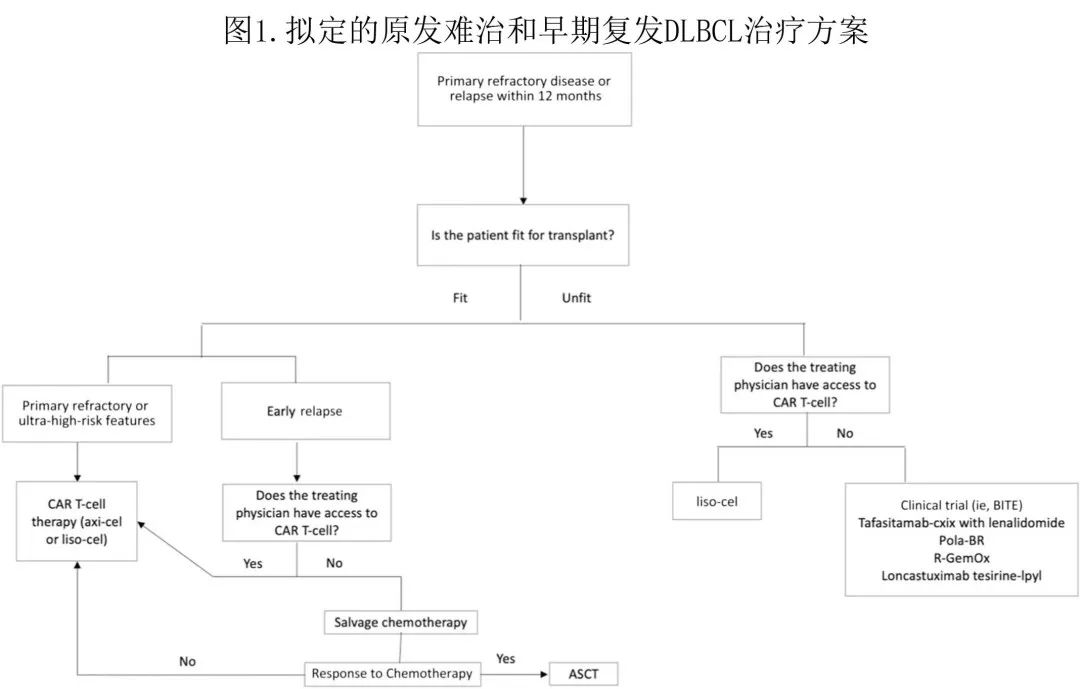
尽管大多数 DLBCL 患者可通过一线利妥昔单抗联合蒽环类免疫化疗治愈,但仍有相当一部分患者发生 R/R。鉴于 CAR T 细胞疗法在适合移植和不适合移植的高危 R/R DLBCL 患者中的获益均已得到证实,建议 CAR T 细胞应作为 R/R DLBCL 患者的首选治疗(如适用);而对于医学上fit、早期复发且不能选择 CAR T 细胞治疗的患者,ASCT挽救化疗是合理的考虑因素。对于医学上unfit患者,建议使用 liso-cel 或其他替代疗法进行治疗。作者提出了图1中治疗高危 R/R DLBCL 的策略。
即使如此,CAR T 细胞治疗长期免疫抑制的影响仍存在许多问题,包括长期感染风险和疫苗接种应答。随着 BITE 未来上市,本审查中提出的范例可能在未来发生完全转变。BITE 治疗在早期试验中已证明是有效的,与 CAR T 细胞治疗相比,有望成为一种现成的治疗选择广泛用于患者的替代治疗。虽然需要更多时间等待数据成熟,但将 CAR T 细胞治疗后疾病复发的患者转诊至 BITE 治疗是合理的。尚不清楚如果患者在 CAR T 细胞治疗前接受BITE,T 细胞耗竭是否会限制对 CAR T 细胞治疗的反应。鉴于 R/R DLBCL 患者的历史结局不佳,包括 CAR T 细胞治疗和 BITE 在内的新型疗法的兴起可以为这一历史上被忽视的患者人群的治疗选择带来了巨大的希望。
参考文献
Cassandra Duarte, Manali Kamdar.Management Considerations for Patients With Primary Refractory and Early Relapsed Diffuse Large B-Cell Lymphoma.Am Soc Clin Oncol Educ Book . 2023 Jan;43:e390802. doi: 10.1200/EDBK_390802.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言