Cell Reports:人类大脑还可以变得更强
2014-11-24 叶予 生物通
人类大脑的信息储存能力还能进一步提升么?McGill大学的一项最新研究表明,这是有可能的。 RI-MUHC的研究人员鉴定了大脑信息处理的一个刹车分子,去除这个分子能够显著提高大脑的功能和记忆力。这项发表在Cell Reports杂志上的研究,为理解神经发育和神经退行性疾病提供了重要的线索,比如自闭症谱系障碍和阿尔茨海默症。[pdf free] “之前的研究告诉我们,Glu
人类大脑的信息储存能力还能进一步提升么?McGill大学的一项最新研究表明,这是有可能的。
RI-MUHC的研究人员鉴定了大脑信息处理的一个刹车分子,去除这个分子能够显著提高大脑的功能和记忆力。这项发表在Cell Reports杂志上的研究,为理解神经发育和神经退行性疾病提供了重要的线索,比如自闭症谱系障碍和阿尔茨海默症。[pdf free]
“之前的研究告诉我们,GluA2是大脑储存记忆的基础,如果这些分子的生产受阻,大脑就无法形成新的记忆,”文章的资深作者,副教授Dr. Keith Murai说。“我们发现了限制GluA2生产的关键蛋白。抑制这个刹车蛋白,大脑就能储存更多的信息。”
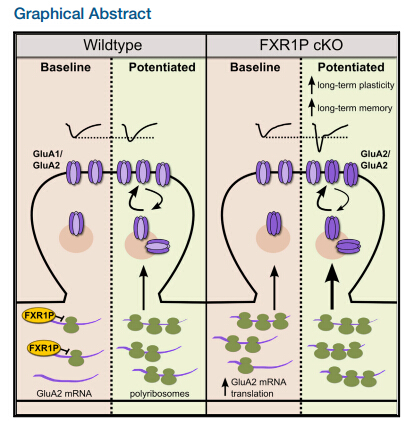
翻译水平的mRNA调控,可以实现突触蛋白的快速改变,为大脑的记忆形成提供必要基础。在非神经元细胞中,RNA结合蛋白FXR1P(Fragile X Related Protein 1)控制着mRNA的翻译。已知FXR1P在神经元中与翻译机器存在共定位,不过人们并不清楚它的作用目标,也不了解它的具体功能。
Dr. Murai及其同事通过小鼠模型发现,蛋白FXR1P负责抑制GluA2的生成。他们通过去除初生小鼠前脑的FXR1P,促进了小鼠的晚时相长时程增强(L-LTP)、空间记忆的长期储存和新GluA2的合成。研究显示,GluA2增强了脑细胞之间的连接,显著提高了小鼠的记忆能力。进一步研究表明,FXR1P能结合在GluA2 mRNA的5’ UTR,对蛋白翻译进行抑制。
“FXR1P的这种作用令我们感到意外,”Dr. Murai说。“我们首次鉴定了FXR1P在大脑中的具体作用,揭示了大脑信息处理的一个调控机制,这将有助于人们理解和治疗大脑疾病。”
“未来的研究将会非常有趣,”他补充道。“如果我们找到了能控制FXR1P刹车能力的化合物,就有望改变大脑的灵活程度。举例来说,在自闭症中人们想要减少特定的大脑活性,而在阿尔茨海默症中人们想要增强大脑活性。操纵FXR1P将能调节记忆的形成和恢复,提高大脑疾病患者的生活质量。”
原始出处:
Denise Cook1, 7, Erin Nuro1, 7, Emma V. Jones1, Haider F. Altimimi1, W. Todd Farmer1, Valentina Gandin2, Edith Hanna1, Ruiting Zong3, Alessandro Barbon4, David L. Nelson3, Ivan Topisirovic2, Joseph Rochford5, David Stellwagen1, Jean-Claude Béïque6, Keith K. Murai1,FXR1P Limits Long-Term Memory, Long-Lasting Synaptic Potentiation, and De Novo GluA2 Translation.Cell Reports.20 November 2014, Pages 1402–1416[pdf free]
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CEL#
25
#Cell#
35