癌症免疫疗法新近进展
2017-09-26 佚名 生物谷
1. Sci Transl Med:突破性成果!帮助癌症扩散的血管或能增强免疫疗法的治疗效率近日,一项刊登在国际杂志Science Translational Medicine上的研究报告中,来自芝加哥大学、洛桑大学及瑞士联邦理工学院的研究人员通过研究发现,通常被认为能够促进癌细胞从原发性位点扩散到其它位点的淋巴管或许有其另外一面特征。淋巴管能够扩张到肿瘤周围或肿瘤内部,这一过程称之为淋巴管生
1. Sci Transl Med:突破性成果!帮助癌症扩散的血管或能增强免疫疗法的治疗效率
近日,一项刊登在国际杂志Science Translational Medicine上的研究报告中,来自芝加哥大学、洛桑大学及瑞士联邦理工学院的研究人员通过研究发现,通常被认为能够促进癌细胞从原发性位点扩散到其它位点的淋巴管或许有其另外一面特征。淋巴管能够扩张到肿瘤周围或肿瘤内部,这一过程称之为淋巴管生成(lymphangiogenesis),该过程的发生常常和癌症扩散到新的位点之间存在一定关联。
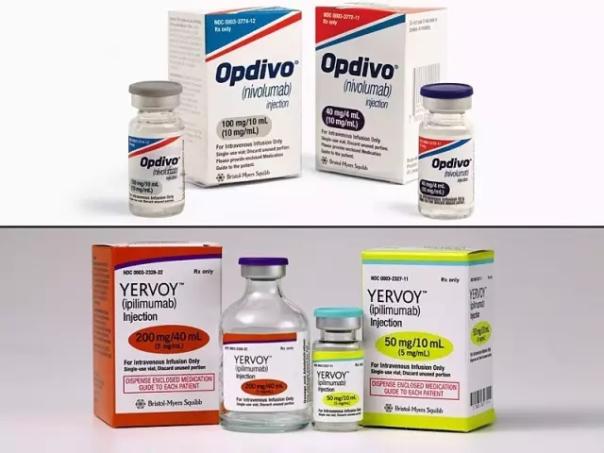
研究人员发现,在接受检查点抑制剂治疗的患者机体中,淋巴管的生成会明显增强癌症免疫疗法的效果,一些诸如易普利姆玛(Ipilimumab)和纳武单抗(Nivolumab,Opdivo)的检查点抑制剂药物能够帮助激活机体抵御肿瘤的免疫反应;研究者指出,淋巴管生成还能够增强免疫系统的主要抗癌工具—T细胞,从而促进T细胞浸润到肿瘤中杀灭癌细胞。
研究者认为,在癌症患者开始治疗之前进行简单的血液检测或许就能够帮助临床医生有效预测哪些患者会因癌症免疫疗法而获益,至少是黑色素瘤患者;目前仅有一小部分患者会因免疫疗法而获益,研究人员希望能够开发出新型的策略使得癌症免疫疗法更加有效地对癌症患者进行治疗。
Melody Swartz教授表示,这项研究中我们阐明了淋巴系统在癌症疗法中所扮演的特殊角色,淋巴管的生成部分是由化学信号、血管内皮生长因子-C(Vascular endothelial growth factor,VEGF-C)所驱动的,而这两种物质和癌症转移及患者较差的预后又直接相关,同时也能够促进肿瘤微环境发生免疫抑制。
VEGF-C同时也被认为对癌症患者有害,研究者认为,阻断VEGF-C或许就能够通过移除抑制T细胞杀灭肿瘤细胞的因子来增强癌症免疫疗法的治疗效果,这就是研究人员最初的假设,但研究人员通过对小鼠进行研究,随后在两项对黑色素瘤患者的临床试验中所得到的研究结果改变了他们的想法。
在所有试验中,研究者发现,在进行免疫疗法之前,血液中VEGF-C的水平不仅能够帮助预测癌症疫苗所产生的免疫反应的广度和质量,还能够对患者针对联合检查点阻断剂疗法所产生的长期反应进行分类,同时也能够帮助研究人员调查利用血清中的VEGF-C作为免疫疗法候选者的一种可预测的生物标记物。
Swartz说道,在试验开始之前,我们对血液样本进行了分析,测定了相关因素的水平,仅发现VEGF-C具有一定的相关性,而且差别非常显著,血液中VEGF-C水平高于平均值的几乎所有患者都会对免疫疗法产生反应,这并不会引发原发性肿瘤被根除,反而会促进T细胞浸润到转移性的肿瘤中产生长效保护作用。VEGF-C或许能够作为一种有用的生物标志物,研究者能够很容易地测定血液中VEGF-C的水平,而且其也能够帮助预测患者对免疫疗法的反应,如果VEGF-C水平较低的话,免疫疗法或许并不太可能奏效。
研究人员还提出了一些研究的局限性,其中包括VEGF-C对其它免疫细胞亚群的潜在效应,其它细胞因子的贡献以及同其它T细胞之间进行营养物质的竞争;由于存在这些局限性,因此研究人员或许需要对机体免疫微环境进行更为深入的理解。最后研究者总结道,如今我们发现了多种免疫抑制发生的机制,即T细胞活性抑制的肿瘤会生存下去,包括淋巴管生成过程等,但当开始激活那些能够支配抑制性因子的因素时,这些T细胞就会成为抗肿瘤免疫反应的有力参与者了。
2. Cancer Cell:调节T细胞的代谢或有望增强癌症免疫疗法的作用效果
近日,来自美国费城威斯达研究所(The Wistar Institute)的研究人员通过研究发现,肿瘤中发现的能够参与肿瘤细胞杀灭的T淋巴细胞能够通过利用脂肪来作为主要的能量来源应对肿瘤微环境中氧气和营养物质的缺失,推动葡萄糖转化为脂肪酸或能帮助产生更多能量来增强T细胞的抗肿瘤活性。相关研究刊登于国际杂志Cancer Cell上。
实体瘤中肿瘤浸润性T淋巴细胞(TILs)的存在和患者较好的临床预后及患者对某些免疫疗法反应较好直接相关,这些细胞常常能从癌症患者机体中分离出来,同时能够在体外被改造后再次输入相同患者机体中用来治疗疾病;然而TILs的抗肿瘤效应的有效性常常会因细胞的功能不断丧失而受限,随着T细胞同肿瘤细胞在肿瘤微环境中竞争氧气和营养物质,代谢性的压力在T细胞的耗竭上扮演着重要的作用;在某些不利的条件下,TILs的功能也会受损,从而就会降低其抵御肿瘤的潜力以及基于T细胞的免疫疗法的作用效果。
医学博士Hildegund C.J. Ertl表示,TILs耗竭背后的机制目前我们并不清楚,由于TILs的功对于癌症免疫疗法的治疗效果非常重要,因此我们认为,本文研究对于有效增强基于T细胞的治疗方法或许具有一定的意义。研究者发现,较低的氧气水平往往会同低葡萄糖利用率一起引发TILs适应机体的代谢模式,并且改变从葡萄糖到脂肪酸的能量产生的来源;诱导代谢转移或能指导T细胞增加对产生能量的脂肪酸的利用,从而就能够改善TILs效应子的功能以及减缓肿瘤的进展。
这项研究中,研究者利用了两种不同的免疫疗法对两种黑色素瘤小鼠模型进行研究,阐明了代谢操控对于改善TIL细胞功能的效果,研究者发现,分离自转移性黑色素瘤患者机体中的T细胞能够增加脂肪酸的代谢(相比正常供体中循环的淋巴细胞),这就证实了研究人员相关观察结果的临床相关性。
此外,利用FDA批准的用来降低胆固醇水平贝特类(fibrates)药物进行研究,研究者发现,着了药物能够促进脂肪酸的破裂,同时他们还观察到促进代谢开关的开启或与肿瘤中T细胞功能的改善直接相关;更重要的是,这些药物还能够同免疫检查点抑制剂阻断疗法相协同,来改善黑色素瘤疗法的进展。
最后研究者Ertl说道,进行药物介入来促进TILs应对脂肪酸代谢的代谢适应机制或许对于后期研究人员开发治疗不同类型癌症的基于T细胞的免疫疗法具有一定的意义。
3. J Immunol:鉴别出自然杀伤细胞帮助机体有效抵御癌症的新型分子机制
近日,刊登在国际杂志The Journal of Immunology上的一项研究报告中,来自新西兰奥塔哥大学的研究人员通过研究阐明了自然杀伤细胞(NK细胞)的一种特殊的新型角色,NK细胞是一种白细胞,其能够帮助机体有效抵御感染和癌症的发生;同时其作为一种维持机体治安的“杀手”分子,能够通过“标识卡”检查的过程来破坏入侵者和癌细胞等,而且还能够扮演辅助细胞来开启机体的免疫反应。
研究者Alex McLellan教授说道,NK细胞能够在机体中巡逻并且破坏异常细胞,尤其是被感染的细胞或癌细胞,NK细胞能够密切地检测所有细胞的表面并且寻找健康细胞表面的特殊分子。而特定的分子常常类似“标识卡”(ID卡),如果NK细胞没有看到细胞表面的ID卡其就会发动机体的免疫反应;在感染和癌症发生期间,这些分子的缺失会诱发NK细胞对细胞实施破坏作用。
这项研究中,研究人员通过研究鉴别出了在感染或癌症发生期间NK细胞所扮演的新角色;很多年前研究人员通过研究发现,在疫苗接种抵御癌症时NK细胞往往是必需的,如今研究者发现,NK细胞能够增强免疫系统识别释放进血液中肿瘤细胞碎片的能力,这些碎片能够诱导机体抵御癌症的潜在免疫反应。
研究者指出,NK细胞对于这些细胞碎片的免疫活性至关重要,这项最新研究同样也解释了潜在的免疫反应如何有效抵御细胞碎片;研究者在文章中阐明了NK细胞帮助机体免疫系统发挥作用的新角色,下一步他们将会进行更为深入的研究,通过注射活菌苗和生长因子的方式来改善NK细胞的功能,从而增强机体应对癌症的免疫反应。
4. Cell:重大突破!溶瘤病毒疗法有效改善癌症免疫疗法的疗效,总体反应率高达62%
免疫疗法有望治疗转移性黑色素瘤(一种侵袭性的致命性的皮肤癌);但是对大多数患者而言,免疫治疗药物迄今为止辜负了人们的期望,提供很少的益处,甚至并不提供益处。在一项针对21名患者的1b期临床试验中,来自美国、瑞士、西班牙和澳大利亚的研究人员测试了免疫治疗药物派姆单抗(pembrolizumab)和一种被称作T-VEC的溶瘤病毒组合使用时的安全性和疗效。结果提示着这种组合疗法获得62%的反应率,而且可能要比单独治疗时表现得更好。相关研究结果发表在2017年9月7日的Cell期刊上,论文标题为“Oncolytic Virotherapy Promotes Intratumoral T Cell Infiltration and Improves Anti-PD-1 Immunotherapy”。论文通信作者为美国加州大学洛杉矶分校琼森癌症中心免疫学项目主任Antoni Ribas。
派姆单抗属于一类被称作免疫检查点抑制剂的药物。免疫检查点抑制剂旨在绕过癌症保护自身免受免疫系统攻击的途径之一:肿瘤能够利用免疫检查点激活体内的天然保护性反应,因而抑制细胞毒性T细胞发起的攻击。这些药物的作用机制是取消对免疫检查点的刹车,从而允许T细胞攻击肿瘤。
Ribas解释道,“一些人将肿瘤分为‘热’肿瘤和‘冷’肿瘤。热肿瘤也被称作发炎的肿瘤,在它们的内部和周围存在着很多免疫细胞,但是冷肿瘤并不如此。”派姆单抗等药物提高存在免疫细胞的肿瘤中的反应,但是在不会促进免疫反应产生的肿瘤中不会起作用。
这正是T-VEC发挥作用的地方。T-VEC也被称作talimogene laherparepvec,是人单纯疱疹病毒经过基因改造将T细胞运送到肿瘤中和诱导一种抗肿瘤反应而产生的。它被美国食品药品管理局(FDA)批准用来治疗皮肤和淋巴结中的黑色素瘤。通过将T-VEC注射到患者的肿瘤,甚至那些位于体内更深处的肿瘤中,这些研究人员能够将冷肿瘤转化为热肿瘤,这接着允许派姆单抗提供有益的增强效应。
这种1b期多中心临床试验包括来自三大洲的21名患者,这些患者都患有转移性黑色素瘤。这些研究人员报道对这种药物组合的总体反应率为62%,这意味着体内的肿瘤发生萎缩。三分之一的患者完全缓解,这意味着他们的肿瘤是检测不到的。这些反应率比单独治疗时预计的反应率(通常大约为35%~40%)要高。
这项临床试验的副作用并不比单独治疗时观察到的更差,包括寒颤、疲劳和发热。三名患者具有更加严重的自身免疫反应,而且有时是在派姆单抗治疗后观察到的。
在这项临床试验开始时,这些患者接受两次T-VEC注射到他们的肿瘤中,注射间隔为三周。在第六周时,他们开始每两周接受派姆单抗治疗,与此同时进一步接受T-VEC注射。
这些研究人员在临床试验期间获得这些患者肿瘤的活组织样品进行分析。在第六周时,在接受两次T-VEC注射之后在开始接受派姆单抗治疗之前,大多数肿瘤浸润着T细胞。在30周时,这些T细胞仍然存在于这个区域中,但是大多数肿瘤细胞消失了。
这些研究人员已开始在全球100多所研究结构中为III期临床试验招募660名患者。这项III期随机对照临床试验将在之前未接受T-VEC或派姆单抗治疗的患者中对派姆单抗与T-VEC组合使用和派姆单抗与安慰剂组合使用进行比较。
5. J Clin Invest:新技术能够提高癌症免疫疗法与癌症疫苗的治疗效果
疫苗与癌症免疫治疗的核心是相同的:即通过增强人体的免疫系统,使其能够更好地清除靶向物质,不管是微生物还是癌细胞。这两种治疗手段均依赖于CD8+ T细胞,即一种能够发挥杀伤性作用的T细胞类型。最近,来自加州圣地亚哥分校的研究者们通过小鼠试验证明激活细胞蛋白酶体的药物能够促进CD8+ T细胞向记忆性细胞方向转化。这一发现将有助于提高疫苗以及免疫疗法的治疗效果与维持时间。相关结果发表在最近一期的《Journal of Clinical Investigation》杂志上。
"我们已经知道激活后的CD8 T细胞能够发生定向分化,形成杀伤性T细胞或记忆性T细胞",该研究的通讯作者,来自UCSD的副教授John T. Chang说道:"然而,我们并不清楚CD8+ T细胞分裂过程中细胞成分的分布情况"。
利用小鼠以及细胞培养模型,研究者们发现了CD8+ T细胞的两种不同亚群的蛋白酶体活性存在明显的差异。众所周知,蛋白酶体是负责降解以及回收蛋白质的核心元件,而最近一些研究则发现其能够调控细胞的功能。
目前有一些商业化的蛋白酶体激活剂以及抑制剂,Bortezomib是一种用于治疗多发性骨髓瘤的药物,它能够抑制蛋白酶体的活性。Chang等人发现"cyclosporine",即一种用于器官移植过程的免疫抑制类药物,能够激活CD8 T细胞中的蛋白酶体活性。
此外,作者还发现在微生物感染的早期使用cyclosporine刺激CD8+ T细胞能够导致更多周期较长的记忆性T细胞的产生。
对此,作者认为这一发现能够通过增强机体的CD8+ T细胞免疫活性,从而有效提高癌症免疫治疗以及常规疫苗的治疗效率。
6. Sci Rep:新型嵌合抗体可治疗犬类恶性癌症
与人类相似,狗的寿命在近年来也在明显延长,因癌症死亡的比例也在显著升高。同样的,目前没有针对犬类恶性癌症的有效治疗手段。犬类口腔恶性黑色素瘤(OMM)就是其中一类。
在人类中,一些恶性癌细胞表达PD-L1蛋白,其能够与T细胞表面PL-1结合导致T细胞免疫活性的抑制。因而PD-1/PD-L1的相互作用被认为是癌细胞"免疫逃逸机制"的一部分。对此,能够阻断PD-1/PD-L1相互作用的抗体被认为具有诱导抗肿瘤免疫反应的能力,而且在过去近年来在临床实践中不断地被应用于诱导人类抗肿瘤免疫反应。不过,此前一直没有针对犬类的相关临床试验。
来自Hokkaido大学的教授Satoru Konnai等人来发出了一种嵌合型PD-L1抗体,该抗体能够诱导机体产生抗犬类恶性肿瘤的免疫反应,并且能够成功实现肿瘤的退化。
首先,作者发现OMM细胞以及其它一类癌细胞表面表达PD-L1蛋白,验证了这两种癌症类型可以作为上述免疫疗法的靶点。之后,作者利用大鼠的抗PD-L1抗体开发出了狗-鼠嵌合抗PD-L1抗体,这种抗体能够避免给狗接种后出现机体免疫排斥反应。
在初步的试验中,作者发现患有OMM以及另外一种癌症的狗在接受上述抗体治疗之后出现了明显的肿瘤退化,而且这类抗体不会引发机体出现免疫排斥反应。此外,作者还发现这种治疗手段能够显著延长患病狗的寿命。因此,作者认为这种嵌合型的抗体具有治疗犬类癌症的潜力。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言