【论著】| 探讨氨磷汀对局部晚期直肠癌新辅助放疗同期伊立替康化疗的减毒作用:对154例病例的回顾性队列研究
3小时前 中国癌症杂志 中国癌症杂志
研究旨在深入分析氨磷汀对于减轻治疗过程中的胃肠道和血液学毒性的潜在作用,以期为临床治疗提供科学依据。
[摘要]背景与目的:直肠癌是全球范围内严重危害人群健康的恶性肿瘤之一,发病率位居第三,死亡率排名第二。随着社会经济水平发展,中国的结直肠癌发病率及死亡率呈增高趋势,成为全球结直肠癌高发的国家之一。局部晚期直肠癌推荐治疗方式为新辅助放化疗联合手术治疗,这极大地改善了患者的预后。然而,新辅助放化疗引起的腹泻等肠道不良反应增多,部分患者因严重的毒性和不良反应被迫延迟或中断治疗。氨磷汀是一种广谱正常细胞保护剂,对于多种放化疗毒性都有良好的防护效果。本研究通过回顾性资料分析接受新辅助放疗联合伊立替康同步化疗的局部晚期直肠癌患者,探讨同期使用氨磷汀是否可减轻胃肠道和血液学毒性。方法:本研究采用回顾性队列分析方法。回顾性收集2018年1月1日—2019年12月31日在复旦大学附属肿瘤医院接受新辅助放化疗的局部晚期直肠癌患者的临床数据。按是否同期使用氨磷汀分组。主要研究目的是分析氨磷汀是否能减轻胃肠道与血液学毒性,次要研究目的包括氨磷汀是否能改变肿瘤标志物水平、直肠系膜筋膜侵犯(mesorectal fascia invasion,MRF)阳性率、壁外血管侵犯(extramural vascular invasion,EMVI)阳性率及病理学完全缓解率(pathological complete response,pCR)。采用SAS9.4统计软件,对于连续变量,进行了正态性检验。腹泻等级不符合正态分布行Wilcoxon秩和检验;血液学毒性组内比较行方差分析,组间比较行Wilcoxon秩和检验;肿瘤标志物的变化值因为组间不均衡性,故采用广义估计方程进行前后组间差值的比较。本研究严格遵循流行病学观察性研究报告指南(STrengthening the Reporting of OBservational studies in Epidemiology,STROBE),确保研究方法的透明度和结果的可靠性。结果:最终纳入了154例符合条件的患者,按是否同期使用氨磷汀分组,其中氨磷汀组78例,对照组76例。氨磷汀组腹泻最高分级为1.00(1.00,1.00)低于对照组的2.00(2.00,3.00),组间差异有统计学意义(P<0.01)。放疗后两组间白细胞计数(white blood cell count,WBC)、血红蛋白(hemoglobin,HB)、中性粒细胞绝对值(absolute neutrophil count,ANC)和血小板计数(platelet count,PLT)变化值差异均无统计学意义(P>0.05),两组新辅助治疗期间最低血常规WBC、RBC、PLT值差异均无统计学意义(P>0.05),氨磷汀似乎不能减轻血液学毒性。两组肿瘤标志物糖类抗原72-4(carbohydrate antigen 72-4,CA72-4)(Z=2.22,P=0.03)、糖类抗原50(carbohydrate antigen 50,CA50)(Z=-2.49,P=0.01)、糖类抗原24-2(carbohydrate antigen 24-2,CA24-2)(Z=-2.29,P=0.02)差值相比均有统计学意义。两组组间MRF阳性率(P=0.11)、EMVI阳性率(P=0.61)、pCR率(P=0.94)相比差异均无统计学意义。结论:接受新辅助放化疗的局部晚期直肠癌患者同期使用氨磷汀可以减轻胃肠道毒性,并且降低肿瘤标志物CA72-4、CA50和24-2水平。但在改善血液学毒性、MRF和EMVI阳性率及pCR率等方面似无明显作用。
[关键词] 氨磷汀;伊立替康;直肠癌;新辅助放化疗
[Abstract]Background and purpose: Rectal cancer is one of the malignant tumors that seriously harm human health in the world, ranking third in incidence and second in mortality. With the development of social and economic level, the incidence and mortality of colorectal cancer in China are increasing, and China becomes one of the countries with high incidence of colorectal cancer disease in the world. The recommended treatment for locally advanced rectal cancer is neoadjuvant chemoradiotherapy combined with surgery, which greatly improves the prognosis of patients. However, intestinal adverse reactions such as diarrhea caused by neoadjuvant chemoradiotherapy are increased, and some patients are forced to delay or interrupt treatment due to serious side effects. Amifostine is a broad-spectrum normal cell protective agent, which has good protective effect against various radiochemotherapy toxicity. We conducted a retrospective analysis of patients with locally advanced rectal cancer who received neoadjuvant radiotherapy combined with irinotecan concurrent chemotherapy to investigate whether concurrent use of amifostine alleviated gastrointestinal and hematological toxicities. Methods: A retrospective cohort analysis was used in this study. Clinical data of patients with locally advanced rectal cancer who received neoadjuvant chemoradiotherapy at the Affiliated Cancer Hospital of Fudan University during the period of discharge from January 1, 2018 to December 31, 2019 were retrospectively collected. The patients were divided into 2 groups by whether amifostine was used during the same period. The main purpose of the study was to analyze whether amifostine can reduce gastrointestinal and hematological toxicities, and secondary objectives included whether amifostine could alter tumor marker levels, mesorectal fascia invasion (MRF) positive rate, extramural vascular invasion, positive rate of EMVI and pathological complete response (pCR). Using SAS9.4 statistical software, the normality test was carried out for continuous variables. The rank sum test of Wilcoxon was performed when the diarrhea grade did not conform to normal distribution. Analysis of variance was performed for intra-group comparison, and Wilcoxon rank sum test was performed for inter-group comparison. Because of the imbalance between groups, the difference between the two groups was compared using a generalized linear model. This study strictly followed the STrengthening the Reporting of OBservational studies in Epidemiology (STROBE) guidelines to ensure the transparency of the research methodology and the reliability of the results. Results: Finally, 154 eligible patients were included, of whom 78 were in the amifostine group and 76 were in the control group. The highest grade of diarrhea in amifostine group was 1.00(1.00, 1.00), lower than that in control group (2.00, 3.00), and the difference between groups was statistically significant (P<0.01). After radiotherapy, white blood cell count (WBC), hemoglobin (HB) and absolute neutrophil count (ANC) from the two groups were obtained. ANC and platelet count (PLT) showed no statistically significant difference (P>0.05), and the lowest values of WBC, RBC and PLT did not have statistically significant difference between the two groups during neoadjuvant period (P>0.05). Amifostine may not alleviate hematological toxicity. Carbohydrate antigen 72-4 (CA72-4) (Z=2.22, P=0.03), carbohydrate antigen 50 (CA50) (Z=-2.49, P=0.01) and carbohydrate antigen 24-2 (CA24-2) had statistically significant difference (Z=-2.29, P=0.02). There were no significant differences in MRF positive rate (P=0.11), EMVI positive rate (P=0.61) and pCR rate (P=0.94) between the two groups. Conclusion: Concurrent administration of amifostine in patients with locally advanced rectal cancer receiving neoadjuvant chemoradiotherapy can reduce gastrointestinal toxicity and reduce the levels of tumor markers CA72-4, CA50 and CA24-2. However, it may have no significant effect on improving hematological toxicity, MRF and EMVI positive rate and pCR rate.
[Keywords] Amifostine; Irinotecan; Rectal cancer; Neoadjuvant radiochemotherapy
直肠癌是全球范围内严重危害人群健康的恶性肿瘤之一,目前在全球所有恶性肿瘤中发病率位居第三,死亡率位居第二[1]。近10年来,随着社会经济水平发展及生活习惯的改变,中国的结直肠癌发病率及死亡率呈增长趋势,已然成为全球结直肠癌疾病负担较为沉重的国家之一,2022年中国直肠癌发病率在所有恶性肿瘤中位居第2位,死亡率位居第4位[2]。目前局部晚期直肠癌推荐治疗方式为新辅助放化疗联合手术治疗,这极大地改善了患者的预后,但是腹泻等肠道不良反应增多,甚至部分患者因严重的毒性及不良反应而被迫延迟或中断治疗[3-4]。氨磷汀是临床使用和研究最广泛的放化疗广谱正常细胞保护剂,对于多种放化疗毒性都有良好的防护效果[5],但是在局部晚期直肠癌中,目前对该药用于伊立替康联合放疗的保护作用少有研究报道,尚不清楚是否减少腹泻等肠道不良反应。本研究通过回顾性队列研究方法,对局部晚期直肠癌患者在接受新辅助放化疗期间使用氨磷汀的疗效进行了评估。研究旨在深入分析氨磷汀对于减轻治疗过程中的胃肠道和血液学毒性的潜在作用,以期为临床治疗提供科学依据。
1 资料和方法
1.1 临床资料
本项研究为单中心、回顾性队列研究,旨在探讨氨磷汀对局部晚期直肠癌患者接受新辅助放疗同期伊立替康化疗过程中的减毒作用。研究纳入的患者为2018年1月—2019年12月在复旦大学附属肿瘤医院接受新辅助放化疗的局部晚期直肠癌患者。本队列研究严格遵循《加强流行病学中观察性研究报告质量》(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE)指南中的各项条目。根据患者在新辅助放化疗期间是否同期使用氨磷汀,分为氨磷汀组和对照组,比较两组的胃肠道及血液学毒性是否有差异。
纳入标准:① 病理学检查确诊为直肠腺癌;基线临床分期为T3~T4和(或)N+;距肛距离 ≤12 cm;无远处转移;② 年龄18~70岁,性别不限;③ Karnofsky体力状况评分≥70;④ UGT1A1基因表型为6/6或6/7;⑤ 新辅助治疗前未用化疗或其他抗肿瘤治疗。
排除标准:① 妊娠或哺乳妇女;② 有癫痫、中枢神经系统疾病或精神障碍史者;③ 临床上严重的(即活动的)心脏病,如有症状的冠心病、纽约心脏病协会(New York Heart Association,NYHA)Ⅱ级或更严重的充血性心力衰竭或严重的需药物干预的心律失常,或接受治疗前12个月内有心肌梗死史;④ 器官移植需要免疫抑制治疗者;⑤ 严重的未控制的反复感染者,或其他严重的未控制的伴随疾病;⑥ 基线血常规和生化指标不符合下列标准:血红蛋白≥90 g/L;中性粒细胞绝对计数(absolute neutrophil count,ANC)≥1.5×109/L;血小板(platelet count PLT)≥100×109/L;谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)≤2.5倍正常上限值;碱性磷酸酶(alkaline phosphatase,ALP) ≤2.5倍正常上限值;血清总胆红素<1.5倍正常上限值;血清肌酐<1倍正常上限值;血清白蛋白≥30 g/L。
1.2 术前新辅助放化疗和术后化疗方案
本研究对象纳入的流程图见图1。研究对象治疗方案为术前新辅助放化疗+间隔期化疗+手术+术后辅助化疗。氨磷汀组方案为新辅助化疗期间使用伊立替康+卡培他滨+氨磷汀;对照组使用伊立替康+卡培他滨。间隔期化疗方案使用XELIRI方案(放化疗后2周,方案:伊立替康200 mg/m2,第1天+卡培他滨1 000 mg/m2,第1~14天),术后辅助化疗为XELOX方案(奥沙利铂130 mg/m2,第1天+卡培他滨1 000 mg/m2,第1~14天)。放疗以盆腔淋巴结引流区为CTV,外放0.5 cm为PTV,计划总剂量为50 Gy/25 Fx,放疗期间同步化疗方案(伊立替康80 mg/m2,第1天+卡培他滨625 mg/m2,第1~5天,或联合使用氨磷汀600 mg/m2,qw)。术前同步放化疗5个周期,化放疗2周后行1个疗程XELIRI方案治疗,新辅助化放疗后8周行手术治疗,手术治疗后2周行5个疗程XELOX方案治疗(图2)。
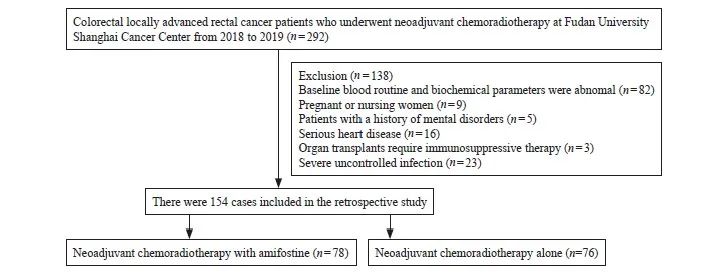
图1 研究对象纳入流程图
Fig. 1 Flow chart showing patients enrollment
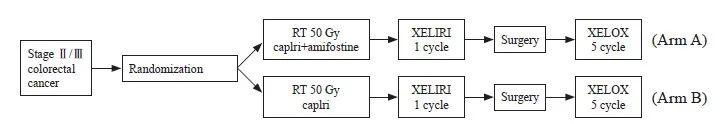
图2 研究方案流程图
Fig. 2 Research program flow chart
1.3 观察指标
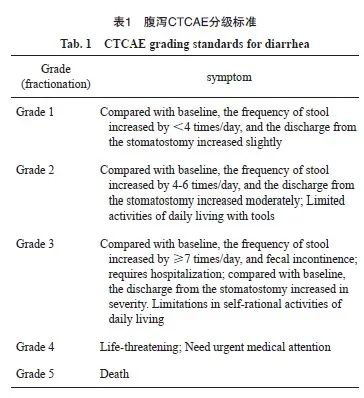
① 胃肠道毒性:主要通过记录和评估患者在接受新辅助放化疗期间的腹泻最高等级来衡量。腹泻的严重程度根据表1中的腹泻CTCAE分级标准进行分类。
② 血液学毒性:通过监测患者治疗前后的白细胞计数(white blood cell,WBC)、血红蛋白(hemoglobin,HB)、中性粒细胞绝对值(absolute neutrophil count,ANC)和血小板计数(platelet count,PLT)来评估。这些指标的变化反映放化疗对患者血液系统的影响。
③肿瘤标志物:包括糖类抗原72-4 (carbohydrate antigen 72-4,CA72-4)、糖类抗原50(CA50)和糖类抗原24-2(CA24-2)。这些肿瘤标志物在新辅助治疗前后的变化被用来评估氨磷汀对肿瘤生物学行为的潜在影响。
④ 直肠系膜筋膜侵犯(mesorectal fascia,MRF)和壁外血管侵犯(extramural vascular invasion,EMVI):通过磁共振成像评估MRF和EMVI的变化,以了解治疗对肿瘤局部控制的影响。
⑤ 病理学完全缓解率(pathological complete response,pCR):通过手术切除标本术后病理学检查未见癌细胞残留来确定。pCR是评估新辅助放化疗效果的重要指标。
1.4 统计学处理
采用SAS 9.4统计软件,对于连续变量,进行了正态性检验。符合正态分布的计量资料以x±s表示,组间比较行独立样本方差分析;不符合正态分布数据以中位数(下四分位数,上四分位数)表示,组间比较使用Wilcoxon秩和检验。分类变量以例数和百分率用 [例(%)]表示,采用卡方检验组内差异的显著性。P<0.05为差异有统计学意义。考虑不同时间点测量指标不均衡,采用广义估计方程进行前后组间差值的比较[6]。显著性检验水平α=0.05。
2 结 果
2.1 入组的患者及其临床特征
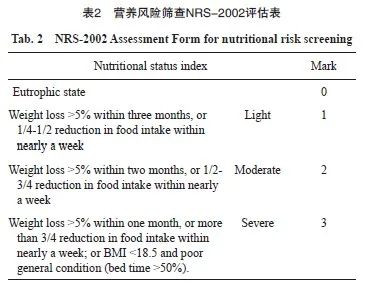
符合纳入和排除标准的直肠癌患者共154例。按照不同治疗方案分为氨磷汀组(新辅助放化疗+氨磷汀,N=78)和对照组(单纯新辅助放化疗,N=76)。氨磷汀组中,男性56例,女性22例,年龄54.00(48.00,60.00)岁,营养评分1.00(1.00,2.00),身高168.00(162.00,172.00)cm,体重66.25(57.50,73.00)kg;对照组中男48例,女28例,年龄58.00(48.00,64.00)岁,营养评分1.00(1.00,2.00),身高165.00(160.00,170.00)cm,体重61.00 (57.00,68.00)kg。其中,营养评分根据营养风险查NRS-2002评估表进行(表2)。以上一般资料两组均衡,不符合正态分布数据以中位数表示,组间比较使用Wilcoxon秩和检验。结果显示,患者的一般状况两组差异均无统计学意义(P>0.05,表3)。
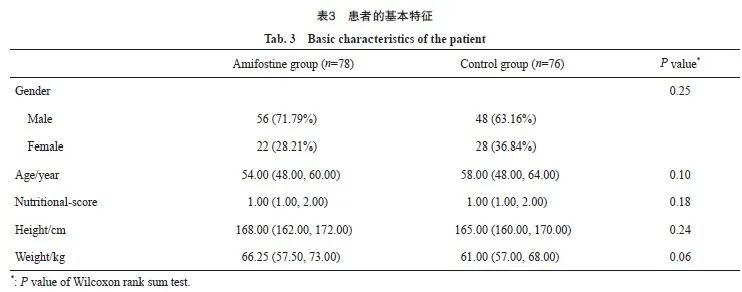
2.2 腹泻情况的比较
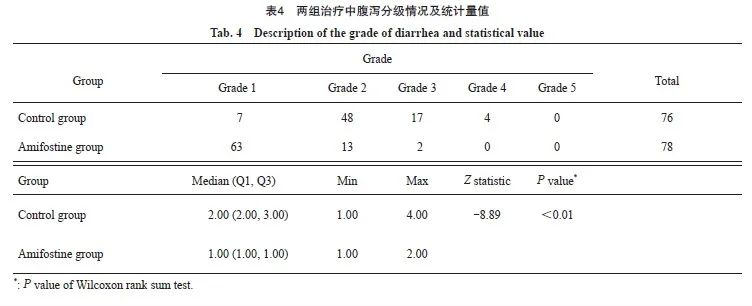
针对两组的腹泻分级资料(腹泻的严重程度根据表1中的腹泻CTCAE分级标准),进行正态性检验,不符合正态分布,故两组腹泻分级以中位数表示,组间比较行Wilcoxon秩和检验。结果显示,氨磷汀组腹泻最高分级1.00(1.00,1.00)小于对照组2.00(2.00,3.00),两组间比较组间差异有统计学意义(P<0.01,表4)。由此可见,氨磷汀可以减轻胃肠道毒性。
2.3 血细胞指标变化的比较
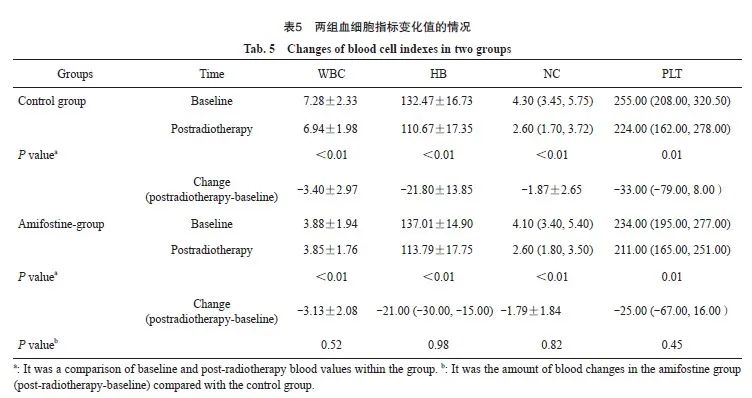
针对血液毒性的比较,放疗后两组组内WBC、HB、NC和PLT对比均有降低:两组组内WBC、HB符合正态分布,使用方差分析(WBC:对照组F=95.69,氨磷汀组F=106.33,两组P均<0.01;HB:对照组F=62.19,氨磷汀组F=77.9,两组P<0.01);两组NC、PLT不符合正态分布,使用秩和检验(NC:对照组Z=-6.06,氨磷汀组Z=-6.45,两组P均<0.01;PLT:对照组Z=-2.59,P=0.01;氨磷汀组Z=-2.51,P=0.01)。
两组各组内变化值(每组内放疗后- 基线)对比:WBC、NC前后的变化量符合正态分布,使用方差分析,两组差异无统计学意义(F=0.42,P=0.52;F=0.05,P=0.82);对照组和氨磷汀组的HB、PLT前后的变化量不符合正态分布,使用秩和检验,差异均无统计学意义(Z=0.02,P=0.98;Z=-0.75,P=0.45)。
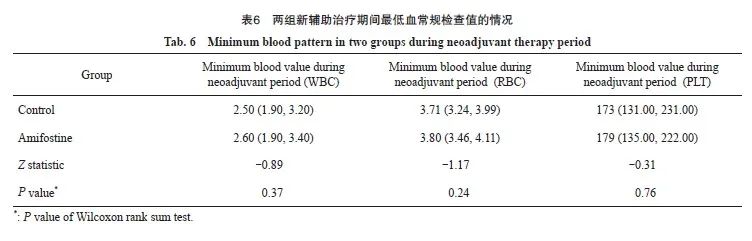
结果显示,放疗后两组各组内WBC、HB、NC和 P LT变化值差异有统计学意义(P= <0.01),两组各组内治疗后增加了血液系统毒性。两组间WBC、HB、NC和PLT变化值比较差异均无统计学意义(P>0.05,表5)。新辅助治疗期间最低血常规WBC、RBC、PLT两组组间数据不符合正态分布,使用秩和检验。结果显示,两组新辅助治疗期间最低血常规WBC、RBC、PLT值差异均无统计学意义(P>0.05,表6)。
2.4 肿瘤标志物变化的比较
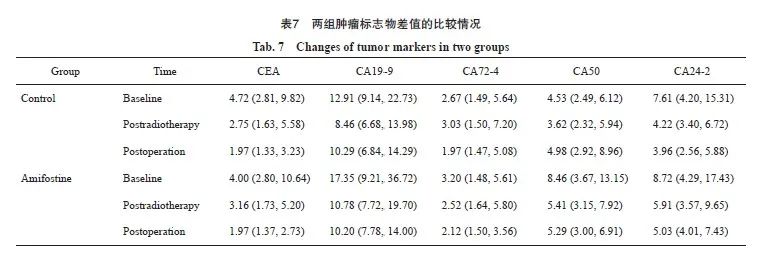
对于重复测量资料,肿瘤指标的检测因时间不同组间不均衡,采用广义估计方程进行两组组间肿瘤指标差值(放疗后-基线)比较。结果显示,氨磷汀组和对照组相比,CEA放疗后与基线的差值、手术后与基线的差值差异均无统计学意义(Z=0.85,P=0.39;Z=1.17,P=0.24);糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)两组放疗后、手术后较基线的变化量差异均无统计学意义(Z=-0.81,P=0.42;Z=-1.09,P=0.28)。两组放疗后CA72-4较基线变化值差异有统计学意义(Z=2.22,P=0.03),两组手术后CA72-4较基线变化值差异有统计学意义(Z=2.31,P=0.02)。氨磷汀组与对照组相比,放疗后CA50较基线变化值,差异有统计学意义(Z=-2.49,P=0.01);手术后CA50较基线变化值两组差异无统计学意义(Z=-1.73,P=0.08);糖类抗原24-2(carbohydrate antigen 24-2,CA24-2)两组放疗后与基线的变化值相比差异有统计学意义(Z=-2.29,P = 0.02),手术后两组相比差异无统计学意义(Z=-1.94,P=0.05;表7)。
根据统计学结果提示氨磷汀能够更显著地降低放疗后的CA72-4、CA50和CA24-2的水平,然而并不能显著降低放疗后的CEA和CA19-9 的水平。
2.5 MRF、EMVI和pCR的比较
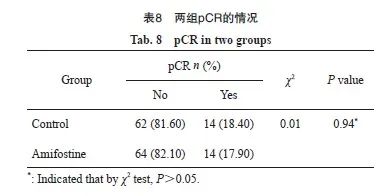
采用卡方检验来比较两组治疗前后MRF、EMVI的阳性率和pCR缓解率。结果显示,对照组组内MRF阳性率放疗后略低于基线,氨磷汀组组内放疗后MRF阳性率降低8.46%,高于对照组5.48%,两组组间比较差异无统计学意义(P=0.11)。两组EMVI阳性率放疗后较基线有所降低,氨磷汀组放疗后EMVI阳性率降低10.96%,高于对照组7.35%,两组比较差异无统计学意义(P=0.61)。我们进一步探索氨磷汀是否在减轻治疗毒性的同时能够提高疗效,采用卡方检验术后pCR,结果发现,氨磷汀组pCR缓解率不高于对照组(17.90% vs 18.40%),两组比较差异无统计学意义(P=0.94,表8)。
3 讨 论
新辅助放化疗联合手术治疗是目前局部晚期直肠癌的推荐治疗方式,可以显著改善患者的预后[7]。然而,新辅助放化疗往往引起诸多不良反应如骨髓抑制、放射性肠炎及乏力等,严重影响患者的生活质量甚至导致治疗中断[8]。因此,如何改善新辅助放化疗相关不良反应对于确保抗肿瘤治疗顺利进行显得尤为重要。氨磷汀作为一种广谱小分子放射防护药物,能够显著地减少放化疗对多种器官(如肾脏、骨髓、神经系统等)的毒性及不良反应,且不影响抗肿瘤效果[9]。氨磷汀是一种有机硫代磷酸类化合物,本身并无保护作用,其进入细胞后在碱性磷酸酯酶作用下去磷酸化成为有活性的代谢产物WR-1065,正常组织中WR-1065积累量高于肿瘤细胞,因而对正常组织产生选择性保护作用。在转基因斑马鱼模型中,氨磷汀不仅能够明显地减轻单纯放疗对大脑的损伤,而且在放疗联合铂类药物化疗时也具有显著的大脑保护作用[10]。在甲氨蝶呤处理的人脐静脉内皮细胞中,氨磷汀能抑制细胞凋亡并减轻氧化应激及基因毒性,提示其对心脏及血管具有一定的保护作用[11]。一项 Ⅱ期临床研究[12]表明,氨磷汀能够显著减少接受盆腔放疗的肿瘤患者发生放射性结肠炎的概率并且减轻相应症状,并且药物相关不良反应可接受。尽管氨磷汀在部分基础及临床研究中被证实具有保护器官作用,但是其是否能够在局部晚期直肠癌患者中减轻新辅助放化疗相关不良反应尚未清楚。
本研究回顾性对比分析154例局部晚期直肠癌患者中氨磷汀组和对照组不良反应情况。腹泻作为同步放化疗期间最常见的胃肠道不良反应,严重时可能导致治疗中断甚至威胁患者生命[13]。本研究结果表明,氨磷汀组腹泻情况明显轻于对照组,提示氨磷汀能够有效地改善患者腹泻症状,这与既往相关研究结果一致。例如,在接受高剂量美法仑治疗的多发性骨髓瘤患者中,氨磷汀组Ⅱ级以上腹泻发生率为56.1%,显著低于对照组(72.7%)[14]。在接受放疗的盆腔肿瘤患者中,高剂量氨磷汀(1 000 mg)能显著降低急性腹泻和2/3级直肠炎的发生率,且超过一半患者能够耐受上述剂量[15]。放疗通过产生活性氧(reactive oxygen species,ROS)来诱导细胞死亡及组织损伤,进而介导放射性肠炎的发生并引起腹泻、腹痛等相应症状[16]。有研究[17]表明,氨磷汀可以在人成纤维细胞中抑制转化生长因子β1诱导的ROS产生。因此,氨磷汀可能通过减少ROS来抑制放射性肠炎的发生发展,最终改善接受同步放化疗患者的腹泻症状。
在造血系统毒性反应比较中,放疗后氨磷汀组和对照组WBC、HB、NC和PLT计数均有所降低,但是两者相对于基线水平并无显著变化,该结果与部分既往文献报道保持一致。例如,在卵巢癌患者中,试验组(氨磷汀+紫杉醇+卡铂)与对照组(紫杉醇+卡铂)的血小板、白细胞和血红蛋白差异均无统计学意义,提示氨磷汀可能对骨髓无明显保护作用[18]。一项meta分析结果表明,在接受放疗的头颈部恶性肿瘤患者中氨磷汀干预组和对照组在3 ~ 4级白细胞减少、贫血及血小板减少发生率方面的差异无统计学意义[19]。由此可见,氨磷汀对放化疗导致的骨髓抑制是否具有保护作用仍不清楚,仍需未来进一步临床试验和基础研究来确证。
本研究发现氨磷汀能够更显著地降低放疗后的CA72-4、CA50和CA24-2的水平,但上述数值均在正常范围内,且进一步研究发现其对MRF、 EMVI和pCR无显著影响。一项随机对照研究[20]表明,氨磷汀对接受放化疗的局部进展期非小细胞肺癌患者总体生存及无疾病生存无显著影响。一项纳入2 279例患者的meta分析同样表明,氨磷汀对接受放疗或放化疗患者的总体生存和无进展生存无显著影响[21]。因此,基于本研究结果及既往文献,笔者认为氨磷汀对接受同步放化疗的直肠癌患者预后无显著影响。
本研究存在如下局限性:首先,本研究样本量较少且随访时间有限,因此氨磷汀在接受同步放化疗的直肠癌患者中的实际效用仍需大样本多中心临床研究来证实;其次,本研究主要聚焦于放化疗相关胃肠道毒性及血液毒性,氨磷汀是否对放化疗引起的肝肾功能不全有防护作用尚不清楚;最后,氨磷汀是否能够通过影响肠道菌群或者屏障功能来预防腹泻等不良反应也有待于未来相关研究来明确。
综上所述,本研究发现接受新辅助放化疗的局部晚期直肠癌患者同期使用氨磷汀可减轻胃肠道毒性及不良反应,并且降低肿瘤标志物水平。因此,氨磷汀有望成为局部晚期直肠癌新辅助放化疗的潜在辅助药物。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:储亚娟参与收集和分析数据,撰写和修改文章;张蕾参与研究构思和分析数据;马金利参与研究设计和构思,为撰写和修改文章提供指导;李云海为研究设计和构思提供指导,为文章修改提供指导;罗伟明、张静、莫晓晨协助收集数据。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] 郑荣寿, 陈 茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231.
ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022[J]. Chin J Oncol, 2024, 46(3): 221-231.
[3] LI Y, WANG J, MA X W, et al. A review of neoadjuvant chemoradiotherapy for locally advanced rectal cancer[J]. Int J Biol Sci, 2016, 12(8): 1022-1031.
[4] 刘思潮, 陈小娇, 杨怡萍.新辅助放疗在直肠癌中的应用及研究进展[J]. 临床医学进展, 2023,13(7): 10854-10862.
LIU S C, CHEN X J, YANG Y P. Application and advances of neoadjuvant radiotherapy in rectal cancer [J]. Adv Clin Med, 2023,13(7): 10854-10862.
[5] KOUVARIS J R, KOULOULIAS V E, VLAHOS L J. Amifostine: the first selective-target and broad-spectrum radioprotector[J]. Oncologist, 2007, 12(6): 738-747.
[6] 冯国双. 重复测量数据的常用统计分析方法[J]. 中华预防医学杂志, 2020, 54(7): 804-812.
FENG G S. Statistical methods for repeated measurement data in scientific research[J]. Chin J Prev Med, 2020, 54(7): 804-812.
[7] SMITH H G, NILSSON P J, SHOGAN B D, et al. Neoadjuvant treatment of colorectal cancer: comprehensive review[J]. BJS Open, 2024, 8(3): zrae038.
[8] XU Y Y, ZOU H Z, SHAO Z Y, et al. Efficacy and safety of different radiotherapy doses in neoadjuvant chemoradiotherapy in patients with locally advanced rectal cancer: a retrospective study[J]. Front Oncol, 2023, 13: 1119323.
[9] JI L H, CUI P F, ZHOU S W, et al. Advances of amifostine in radiation protection: administration and delivery[J]. Mol Pharm, 2023, 20(11): 5383-5395.
[10] SUN L W H, ASANA MARICAN H T, BEH L K, et al. Imaging the radioprotective effect of amifostine in the developing brain using an apoptosis-reporting transgenic zebrafish[J]. Int J Radiat Biol, 2024, 100(3): 433-444.
[11] AGHAJANSHAKERI S, SALM ANM AHINY A, AGHAJANSHAKERI S, et al. Modulatory effect of amifostine (WR-1065) against genotoxicity and oxidative stress induced by methotrexate in human umbilical vein endothelial cells (HUVECs)[J]. Toxicol Mech Methods, 2023, 33(9): 755-765.
[12] KATSANOS K H, BRIASOULIS E, TSEKERIS P, et al. Randomized phase Ⅱ exploratory study of prophylactic amifostine in cancer patients who receive radical radiotherapy to the pelvis[J]. J Exp Clin Cancer Res, 2010, 29(1): 68.
[13] VAN REES J M, HARTMAN W, NUYTTENS J J M E, et al. Relation between body composition and severe diarrhea in patients treated with preoperative chemoradiation with capecitabine for rectal cancer: a single-centre cohort study[J]. BMC Gastroenterol, 2021, 21(1): 313.
[14] MALEK E, GUPTA V, CREGER R, et al. Amifostine reduces gastro-intestinal toxicity after autologous transplantation for multiple myeloma[J]. Leuk Lymphoma, 2018, 59(8): 1905-1912.
[15] KOUKOURAKIS M I, KYRGIAS G, PANTELIADOU M, et al. Dose escalation of amifostine for radioprotection during pelvic accelerated radiotherapy[J]. Am J Clin Oncol, 2013, 36(4): 338-343.
[16] CHEN Y F, YANG Y W, TANG H K, et al. ROS-responsive and pH-sensitive aminothiols dual-prodrug for radiation enteritis[J]. Antioxidants, 2022, 11(11): 2145.
[17] GUO F, XU F, LI S J, et al. Amifostine ameliorates bleomycininduced murine pulmonary fibrosis via NAD+/SIRT1/AMPK pathway-mediated effects on mitochondrial function and cellular metabolism[J]. Eur J Med Res, 2024, 29(1): 68.
[18] DE VOS F Y, BOS A M, SCHAAPVELD M, et al. A randomized phase Ⅱ study of paclitaxel with carboplatin +/- amifostine as first line treatment in advanced ovarian carcinoma[J]. Gynecol Oncol, 2005, 97(1): 60-67.
[19] GU J D, ZHU S W, LI X B, et al. Effect of amifostine in head and neck cancer patients treated with radiotherapy: a systematic review and meta-analysis based on randomized controlled trials[J]. PLoS One, 2014, 9(5): e95968.
[20] LAWRENCE Y R, PAULUS R, LANGER C, et al. The addition of amifostine to carboplatin and paclitaxel based chemoradiation in locally advanced non-small cell lung cancer: long-term follow-up of Radiation Therapy Oncology Group (RTOG) randomized trial 9801[J]. Lung Cancer, 2013, 80(3): 298-305.
[21] BOURHIS J, BLANCHARD P, MAILLARD E, et al. Effect of amifostine on survival among patients treated with radiotherapy: a meta-analysis of individual patient data[J]. J Clin Oncol, 2011, 29(18): 2590-2597.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#直肠癌# #伊立替康# #氨磷汀#
2