ADC连接子的集成设计
2024-10-06 小药说药 小药说药 发表于上海
介绍抗体偶联药物中连接子设计对稳定性和有效载荷释放的影响,强调集成设计及结合剂量方案以获最佳疗效,为 ADC 发展提供思路。
前言
由于有效载荷、连接子和偶联方法的改进,抗体偶联药物(ADC)的发展在过去十年中取得了显著进展。特别是,连接子设计在调节ADC在体循环中的稳定性和肿瘤中的有效载荷释放效率方面起着关键作用,从而影响ADC的药代动力学(PK)、疗效和毒性特征。
一些关键的连接子参数,如偶联化学、连接子长度和连接子空间位阻都会对ADC药物的PK和功效产生影响。因此,在ADC药物的设计中,正确调整连接子的这些重要参数,从而实现ADC稳定性和有效载荷释放效率之间的平衡,才能达到ADC药物预期的效果。
连接子设计调节ADC稳定性
ADC在体循环和组织细胞中进行生物转化,除了抗体代谢和分解代谢外,连接子去偶联、连接子降解和有效载荷代谢被认为是典型的主要生物转化途径。
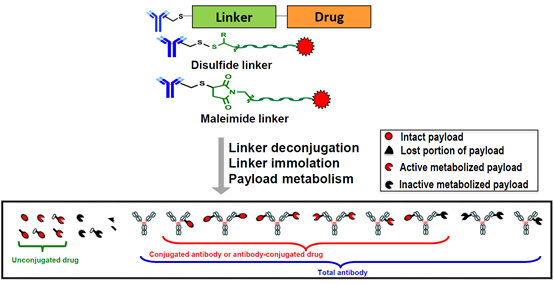
理想情况下,ADC希望在进入靶细胞之前在循环中保持完整和稳定,已经开发出许多涉及偶联位点选择和连接子修饰的方法来增强ADC稳定性。通常,可以出于这种目的对每个组件(包括抗体、连接子和有效载荷)进行修改,然而研究表明,调节偶联位点、连接子长度和连接子空间位阻是更有效的通用方法。
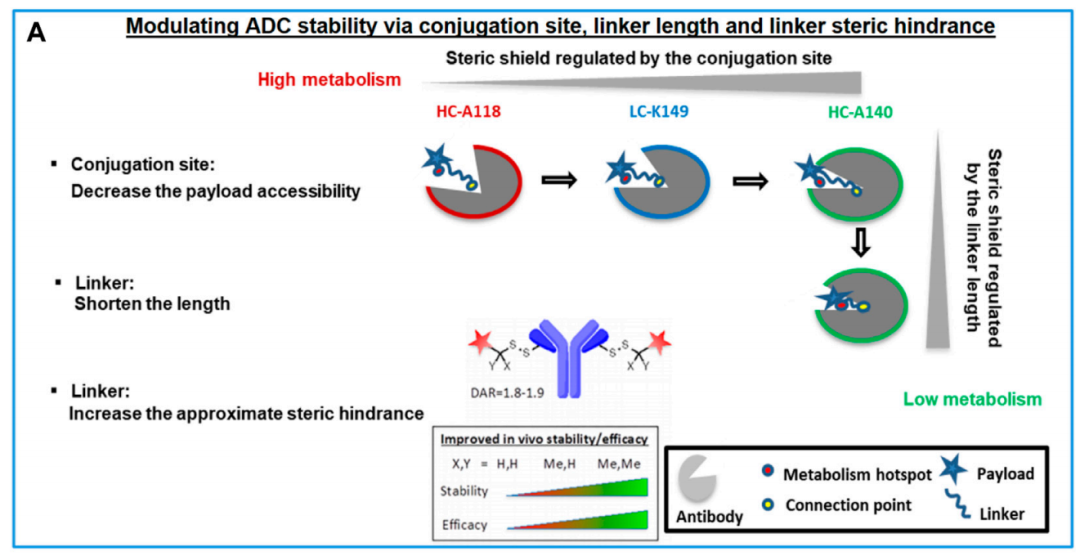
通过选择更具空间位阻的偶联或附着位点,可以实现由抗体提供的空间屏蔽。另一方面,已经证明,在连接子上引入近端空间位阻的替代化学修饰是提高稳定性的有效方法。抗体提供的空间屏蔽有助于减少连接子裂解以及有效载荷代谢。例如,位点HC-A118、LC-K149和HC-A140提供了增强的ADC稳定性,降低了部分溶剂可及性(FSA),对应于偶联位点周围增加的空间屏蔽。
在此基础上,通过改变另一个主要因素,即连接子长度,可以通过抗体和有效载荷之间的距离对空间屏蔽的影响来调节ADC稳定性。研究发现,较短的连接子相对于较长的连接子,通过将有效载荷进一步固定在抗体的空间屏蔽内,通常会导致更好的ADC稳定性。
此外,偶联化学也是影响ADC稳定性的重要因素,马来酰亚胺和二硫键代表两种主要类型的偶联化学。马来酰亚胺已被广泛用作抗体偶联方式,并与可切割或不可切割的连接子一起使用。因此,根据有效载荷的作用机制,药理有效成分可以是有效载荷本身或具有部分或全长连接子的有效载荷。对于可切割或不可切割的连接子,有效释放活性成分可以通过最佳连接子设计实现。基于二硫键的抗体偶联最近被开发为一种生成可切割连接子的新策略。对于马来酰亚胺和二硫键可裂解的连接子而言,裂解位点附近产生的空间位阻非常关键,可以通过化学修饰来调节偶联物的稳定性。
连接子设计调节ADC有效载荷释放
有效载荷释放可能是ADC内化到细胞后的限速步骤。对于不可切割的连接子,在溶酶体中,抗体被蛋白酶分解或水解为肽或氨基酸(AA)。在这些情况下,产生生物活性分解代谢产物,其中有效载荷在其结构中保留某种类型的肽或AA,有效载荷溶酶体释放可能需要一种转运体。相反,可切割连接子被设计通过酶或化学方式,在连接基团断裂后自降解,以释放附着的有效载荷。因此,在这些情况下,有效载荷释放的速率取决于连接子裂解和随后的固定步骤。
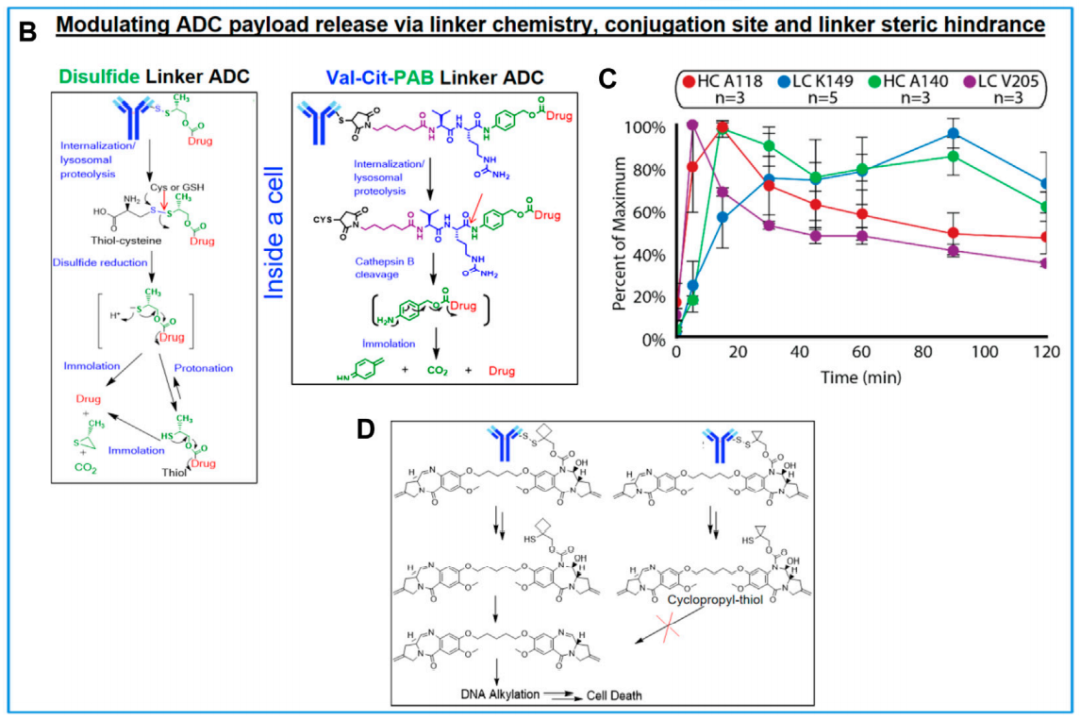
在相同的连接子化学条件下,结合位点会影响有效载荷释放的动力学。例如,对于连接到LC-V205、HC-A118、HC-A140和LC-K149位点的连接子,观察到一系列从快到慢的有效载荷释放动力学。特别是,HC-A118C位点的吡咯[2,1-c]苯二氮卓二聚体(PBD)有效载荷释放(15分钟)比LC-K149C位点(60分钟)快。
结合位点直接影响释放动力学,与单克隆抗体无关。在裂解位点引入空间位阻的化学修饰有助于提高ADC稳定性。此外,空间位阻也可能导致有效载荷的缓慢或无效释放。一个很好的例子是环丁基与环丙基二硫化物连接子之间的比较,环丁基类似物对小鼠有效,而环丙基类似物对小鼠无效。深入研究表明,含有环丁基的分子能够有效释放活性PBD二聚体,然而,在环丙基类似物中未观察到二硫键连接子断裂后的自降解,因此,有效载荷并没有得到有效释放发挥生物活性。
连接子集成设计获得最佳疗效
总体而言,想要获得最佳的ADC需要集成连接子的设计方法。如前所述,这种方法应包括多个参数,包括偶联位点、连接子长度、连接子化学、可切割/不可切割连接和近端连接空间位阻。
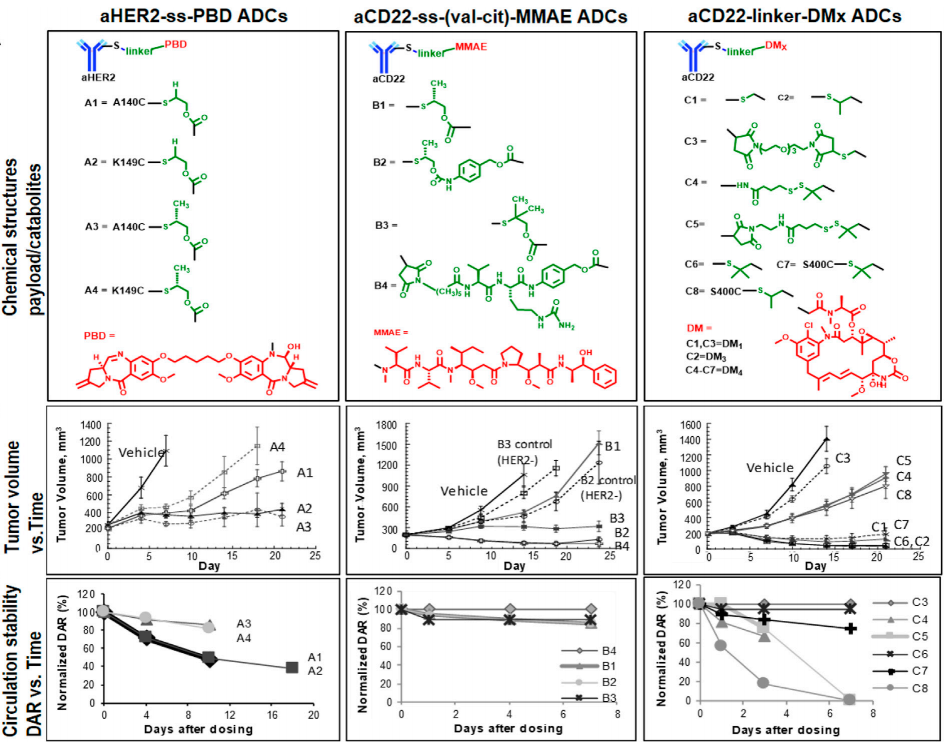
如上图所示,相对稳定性排名为A1∼ A2<A3∼ A4 aHER2-ss-PBD TDC。特别是,与S-S二硫键两侧的H相比,CH3增强的空间位阻提高了ADC稳定性:A1<A3(LC-K149C),A2<A4(HC-A140C)。A4是最稳定的PBD-TDC,但在小鼠异种移植模型中,其活性最低。总体疗效排名顺序为A4<A1<A3/A2。另一方面,肿瘤中释放的PBD二聚体浓度的排名与观察到的疗效趋势大致一致(A4<A1<A3<A2)。
此外,在同一偶联位点LC-K149C处,aCD22单甲基auristatin E(MMAE)的TDC稳定性在不同的连接子(B1-B3的S-S与B4的马来酰亚胺)之间相似。然而,当B4/B2达到100%肿瘤生长抑制(TGI)时,观察到显著不同的活性(B1<B3<B4/B2),同样与肿瘤内释放的MMAE浓度(B1<B3<B4<B2)一致。
此外,还测试了一系列aCD22 ss maytansine(DMx)TDC,分别在LC-K149C(C1-C6)和S400C(C7-C8)位置对二硫化物连接子进行了不同的化学修饰。疗效排名(C3<C4/C5/C8<C1/C7/C2/C6),与肿瘤中测得的DMx浓度(C3<C4/C5/C8<C1<C7<C2<C6)一致,其中C1/C7/C2/C6达到100%TGI。因此,最终有效载荷释放是ADC循环稳定性和有效载荷释放动力学的顺序累积结果。
在三组TDC类似物中,尽管肿瘤内有效载荷浓度不同,PBD-A3/A2、MMAE-B4/B2、DMx-C1/C7/C2/C6 TDC观察到完全TGI。与之前的aHER2 MMAE TDC相比,TDC A-C的功效与血浆中的稳定性、DAR或总抗体(Tab)暴露无关。抗肿瘤疗效与肿瘤内有效载荷暴露相关,具有“平台”效应。因此,以达到预期疗效所需的最低阈值水平的方式向肿瘤提供有效载荷非常重要。
因此,连接子的设计应该优化,以达到ADC稳定性和有效载荷释放动力学之间的平衡,从而在肿瘤细胞中实现有效载荷的释放高于疗效阈值。肿瘤有效载荷浓度评估可用于预测ADC在临床前模型中的疗效。
连接子集成设计结合剂量方案设计
较高的ADC剂量并不总是有助于提高疗效,一旦达到关键阈值,可能只会增加潜在毒性。因此,需要综合连接子设计与剂量方案设计,以找到最小有效剂量。
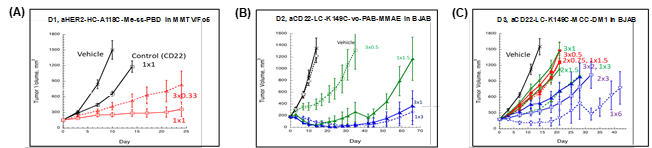
以上图为例,TDC aHER2-HC-A118C-Me-SS-PBD在静脉注射1×1mg/kg剂量时达到完全TGI;而在MMTV-HER2/Fo5小鼠中,超过3周的3×0.33 mg/kg(每周)方案未能达到完全的肿瘤抑制终点。当在BJAB小鼠中测试时,相比3×0.5 mg/kg 的剂量,TDC aCD22-LC-K149C-vc-PAB-MMAE在1×1.5 mg/kg时表现出更好的活性,同样,在1×3 mg/kg和3×1 mg/kg剂量持续7周以上时显示出相似的疗效。
另一项试验,TDC aCD22-LC-K149C-MCC-DM1分3个剂量组进行,分别采用3种剂量方案:1.5mg/kg总剂量(3×0.5 mg/kg,2×0.7mg/kg,1×1.5 mg/kg),3 mg/kg总剂量(3×1 mg/kg,2×1.5 mg/kg,1×3 mg/kg),6 mg/kg总剂量(2×3 mg/kg,2×3 mg/kg)。尽管所有受试剂量方案均显示出一定的活性,但较大的每日总剂量组产生了更好的肿瘤抑制作用。此外,在每个剂量组中,单剂量显示出最佳疗效,表明有效载荷Cmax对肿瘤的驱动效应。在这种情况下,当达到完全TGI和比其他相应的分数剂量方案更好的肿瘤抑制时,单剂量可作为疗效的阈值剂量。在单剂量和多剂量部分方案产生相似疗效的情况下,可根据提供足够而不过量有效载荷的原则选择最小有效剂量,以获得最佳疗效曲线和最小毒性。。
小结
ADC的发展在过去十年中取得了快速的进步,而为了获得最佳疗效的ADC,应考虑采用连接子集成设计的方法。可采用的重要参数包括偶联位点、偶联化学、连接子长度、可切割/不可切割连接以及局部连接空间位阻。需要解决的关键点是在ADC稳定性和有效载荷释放之间实现平衡,以获得最佳的肿瘤内有效载荷PK曲线和疗效。此外,建议将集成连接子设计与剂量设计相结合,以找到理想疗效和最小毒性的最佳剂量方案。
参考文献:
1.Linker Design Impacts Antibody-DrugConjugate Pharmacokinetics and Efficacy via Modulating the Stability and Payload Release Efficiency. Front Pharmacol. 2021; 12: 687926.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#抗体偶联药物# #ADC# #有效载荷释放#
46